文章信息
- 康艾注射液联合OFL方案治疗胃癌随机对照多中心临床试验
- A Multi-center Randomized Controlled Clinical Study of Kang'ai Injection Combined with OFL Regimen on Gastric Cancer Patients
- 肿瘤防治研究, 2019, 46(3): 257-261
- Cancer Research on Prevention and Treatment, 2019, 46(3): 257-261
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1177
- 收稿日期: 2018-08-17
- 修回日期: 2018-12-21
2. 237000 六安,六安市中医院肿瘤放疗科;
3. 230031 合肥,安徽省中医院肿瘤科;
4. 241000 芜湖,芜湖市中医院肿瘤科;
5. 236600 阜阳,阜阳市太和县中医院肿瘤内科
2. Department of Radiation Oncology, Lu'an City Hospital of Traditional Chinese Medicine, Lu'an 237000, China;
3. Department of Oncology, Anhui Hospital of Traditional Chinese Medicine, Hefei 230031, China;
4. Department of Oncology, Wuhu City Hospital of Traditional Chinese Medicine, Wuhu 241000, China;
5. Department of Oncology, Taihe County Hospital of Traditional Chinese Medicine, Fuyang 236600, China
胃癌是目前临床上常见的消化系统恶性肿瘤之一,曾有报道,胃癌的发病率在所有恶性肿瘤中排名第四,而死亡率仅次于肺癌,这已成为一个严重影响居民健康和生活质量的公共卫生问题[1]。流行病学相关研究报道,目前,胃癌在我国呈现出“三低一高”的现象:较低的早期诊断率、手术切除率和远期生存率、较高的复发率,故提高胃癌早期诊断率、手术切除率和远期生存时间是目前临床医生的研究热点[2]。而对于错失手术治疗时机的胃癌患者,化疗是其首选治疗方式,但曾有学者提出,单纯化疗方案治疗会给患者带来一系列的不良反应,而在化疗的基础上结合一定的中医疗法有望获得更好的临床疗效,但对于何种中医药物联合使用效果更好尚未形成统一共识[3]。本研究通过采用多中心、随机、空白对照研究对来自五所不同医院的300例胃癌患者的临床及随访资料进行分析,探讨康艾注射液联合奥沙利铂(L-OHP)+氟尿嘧啶(5-Fu)+甲酰四氢叶酸钙(LV)(OFL方案)治疗胃癌的临床价值。
1 资料与方法 1.1 一般资料本组患者一共300例,所有病例均为安徽医科大学第一附属医院、太和中医院、芜湖中医院、安徽省中医院、六安市中医院就诊的患者,对照组和试验组各150例。300例胃癌患者中286例(95.3%)患者进入符合方案集(per protocol set, PPS),其中对照组140例(93.3%),试验组146例(97.3%)。对照组:男92例、女48例,年龄46~80岁,平均年龄(56.38±9.32)岁,TNM分期:Ⅲb期44例、Ⅳ期96例;病程3~16月,平均病程(8.32±3.12)月。试验组:男100例、女46例,年龄45~85岁,平均年龄(57.02±9.42)岁,TNM分期:Ⅲb期52例、Ⅳ期94例;病程2~18月,平均病程(7.94±3.02)月。两组患者在性别、年龄、临床分期以及病程等一般资料方面比较差异无统计学意义(P > 0.05),具有可比性。
1.2 纳入标准所有患者均符合2007年世界卫生组织(WHO)中胃癌明确诊断标准[4]:(1)经病理学或细胞学确诊为胃癌;(2)KPS评分≥60分;(3)年龄18~75岁;(4)中性粒细胞 > 1.5×109/L,血小板 > 100×109/L,血红蛋白 > 9.0 g/dl;胆红素正常或 < 1.5×ULN;谷草转氨酶(AST)、谷丙转氨酶(ALT) < 2.5×ULN;血清肌酐 < 1.5×ULN;(5)签署知情同意,依从性好;(6)本研究经本试验总负责单位中国中医科学院广安门医院伦理委员会审核批准。
1.3 排除标准(1)妊娠期或哺乳期妇女,精神病患者;(2)有严重、未控制的器质性病变或感染,如失代偿的心、肺、肾功能衰竭等导致不能耐受化疗的患者;(3)同时采用其他试验药物或正在进行其他临床试验者;(4)对本试验药物过敏者。
1.4 治疗方法对照组:单纯采用OFL化疗方案进行化疗:奥沙利铂(L-OHP)(浙江海正药业股份有限公司,国药准字H20093811,用法:130 mg/m2静脉滴注d1)+亚叶酸钙(CF)(国药一心制药有限公司,国药准字H20053392,用法:200 mg/m2静脉滴注d1-5)+5-氟尿嘧啶(5-Fu)(西安海欣制药有限公司,国药准字H20050511,用法:500 mg/m2,静脉滴注d1-5),21天为一个治疗周期。试验组:采用康艾注射液联合OFL化疗方案进行治疗:康艾注射液(长白山制药股份有限公司,国药准字Z20026868,用法:60 ml静脉滴注d1-10),21天为一个治疗周期,两组患者均连续治疗2个周期后,评估疗效。并对患者进行随访,随访3年。
1.5 观察指标两组患者均在治疗2周期后进行近期临床疗效和生活质量的评价,并记录疾病无进展生存时间(PFS)、3年生存率、肿瘤标志物CEA水平和神经毒性、消化道不良反应以及骨髓抑制等不良反应发生情况。
1.5.1 近期疗效评价根据RECIST1.1标准[5]评价:分为完全缓解(CR)、部分缓解(PR)、疾病稳定(NC)以及疾病进展(PD),临床总有效率=(CR+PR)/总例数×100%。PFS指所有患者自治疗时间开始至原有肿瘤病灶进行任何增长或出现任何其他新的病灶时的这一段时间。
1.5.2 生活质量采用生活质量评定量表(JQOL-74)[6]进行评定,包括躯体功能、心理功能、社会功能和物质生活四个维度,每个维度总分为100分,得分越高表明生活质量越好。
1.5.3 CEA检测方法所有患者在检测当日清晨于空腹状态下抽取静脉血5 ml,采用3 000 r/min离心后通过酶联免疫吸附法(ELISA)检测CEA水平,检测试剂盒由上海生物科技有限公司提供,所有操作过程均严格按照试剂盒操作步骤进行。
1.5.4 不良反应不良反应按WHO毒性分级标准分为0~Ⅳ级[7]。
1.6 统计学方法采用SPSS23.0统计软件进行统计学处理,计量资料以(x±s)表示,采用t检验比较;计数资料采用率/构成比(%)描述,采用χ2检验比较,以P < 0.05为差异有统计学意义。
2 结果 2.1 试验总体情况根据随访资料可知,在随访过程中共有32例(10.7%)患者提前终止试验,另有44例患者,由于疗效数据缺失,但因使用了药物,故也纳入本次统计。对照组有15例(10.7%)患者提前终止试验,其中7例(5.0%)为疾病进展、4例(2.9%)为患者终止治疗、2例(1.4%)为失访、2例(1.4%)为其他原因。试验组有17例(11.6%)患者提前终止试验,其中8例(5.5%)为疾病进展、4例(2.7%)为患者终止治疗、2例(1.3%)为失访、3例(2.1%)为其他原因,两组是否完成试验情况的比较差异无统计学意义(P > 0.05)。
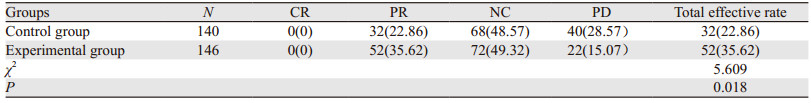
2.2 两组患者临床疗效比较试验组的近期临床疗效(35.62%)明显高于对照组(22.86%)(P < 0.05),见表 1。
|
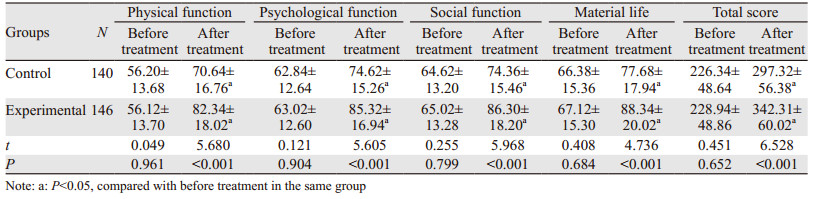
试验组患者治疗后生活质量明显优于对照组(P < 0.05),见表 2。
|
根据随访资料可知,对照组化疗2~5周期,平均(3.47±0.61)周期;试验组化疗2~5周期,平均(3.55±0.65)周期,两组化疗周期比较差异无统计学意义(P > 0.05)。对照组和试验组PFS相比较(25.89月vs. 26.35月)差异无统计学意义(P > 0.05);对照组和试验组3年生存率分别为70.7%、71.9%,两组比较差异无统计学意义(P > 0.05);对照组患者CEA水平为8.96 μg/L,试验组为8.62 μg/L,两组比较差异无统计学意义(P > 0.05)。
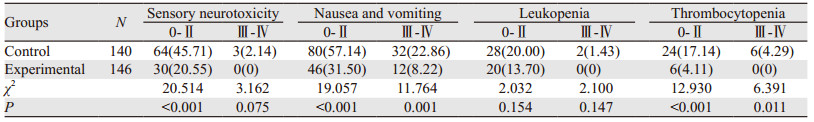
2.5 两组患者不良反应发生情况比较试验组患者其神经毒性不良反应发生率、消化道不良反应发生率以及血小板下降发生率均明显低于对照组,且大部分为轻度,在患者予以停药后均可自行消失,两组患者白细胞下降发生率差异比较无统计学意义(P > 0.05),见表 3。
|
目前,临床上对于晚期胃癌患者尚未有标准的一线治疗方案,根据药理学研究的不断深入,多种化疗药物也逐渐被人们所认识,但是单纯的西药化疗药物可为患者带来较为严重的不良反应,延误了治疗,从而影响其预后[8]。近年随着中医理论研究的不断深化,有学者提出,在单纯化疗药物治疗基础上加用适当中医治疗,在一定程度上可能提高其临床效果。本研究共有300例胃癌患者通过筛选并随机化入组,其中单纯OFL化疗组(对照组)和OFL化疗联合康艾注射液治疗组(试验组)各150例,其中286例(95.3%)患者符合PPS。
本研究结果显示,采用康艾注射液联合OFL方案治疗的胃癌患者其近期临床总有效率明显较单纯OFL化疗方案治疗者高,符合既往研究结果[9],且前者治疗后生活质量较后者明显改善。考虑康艾注射液的主要成分为人参、黄芪以及苦参,根据其药理学研究表明,该药物具有益气扶正,增强免疫力的作用[10],由此认为,在使用西药化疗药物时,除破坏肿瘤细胞外,对正常组织也可产生一定损害,从而进一步降低患者的机体免疫力,而康艾注射液则可弥补这一缺点,提高患者机体免疫力,从而提高临床效果[11]。另一方面,本组研究结果显示,采用康艾注射液联合OFL化疗方案治疗的胃癌患者其治疗后产生的神经毒性反应明显较单纯OFL化疗方案治疗者低,前者明显占有优势。且在消化道不良事件中,前者发生恶心呕吐次数明显低于后者,除此之外,采用康艾注射液联合OFL化疗方案治疗的胃癌患者其在骨髓抑制不良事件中的白细胞下降发生率与单纯OFL化疗方案治疗者比较无差异,但在血小板下降事件中,前者发生率明显低于后者,差异有统计学意义,占有显著优势[12]。但除上述资料外,本组研究结果还显示,两组患者治疗后其PFS和CEA水平之间的比较差异无统计学意义,考虑原因可能是康艾注射液其主要作用在于提高胃癌化疗患者的机体免疫力,从而减少化疗药物对其他正常组织造成的损害,进而降低不良事件发生率[13]。由此看来,西药化疗药物主要作用于患者其肿瘤病灶本身,从而对肿瘤细胞产生一定的杀伤力,而康艾注射液主要提高胃癌患者的机体免疫力,从而加强患者机体对抗外界刺激的作用力,故而进一步加强胃癌患者的临床效果。采用中西结合治疗方案,在提高患者临床治疗有效率的同时降低机体不良事件的发生率,进一步改善患者预后情况,提高患者生活质量[14]。
综上所述,康艾注射液联合OFL化疗方案治疗胃癌患者可提高近期临床疗效、降低不良反应发生率,具有较好的安全性,可作为临床上治疗胃癌的一种首选方式。但本组研究数据所选样本量过小、研究时间过短,尚存在不足之处,下一步可加大样本量,同时延长研究时间进行深入探讨。
作者贡献
孙鑫:参与选题、研究方案制定、数据收集、论文撰写及修改
梁惠、周晋华、查名宝:研究方案制定、实施研究、进行数据整理
刘振昌:统计学分析
李平:研究方案制定、论文终审
| [1] | 杨璐, 田劭丹, 侯丽, 等. 中医药治疗胃癌贫血的临床试验方案设计特色与评价[J]. 中华中医药杂志, 2015, 30(3): 751–4. [ Yang L, Tian JD, Hou L, et al. Evaluation and features of clinical trial program of treating anemia in gastric cancer with tradiitonal Chinese medicine[J]. Zhonghua Zhong Yi Yao Za Zhi, 2015, 30(3): 751–4. ] |
| [2] | Wang J, Xu R, Li J, et al. Randomized multicenter phase Ⅲ study of a modified docetaxel and cisplatin plus fluorouracil regimen compared with cisplatin and fluorouracil as first-line therapy for advanced or locally recurrent gastric cancer[J]. Gastric Cancer, 2016, 19(1): 234–44. DOI:10.1007/s10120-015-0457-4 |
| [3] | Yang XB, Wu WY, Long SQ, et al. Fuzheng Kang'ai decoction combined with gefitinib in advanced non-small cell lung cancer patients with epidermal growth factor receptor mutations:study protocol for a randomized controlled trial[J]. Trials, 2015, 16: 146. DOI:10.1186/s13063-015-0685-2 |
| [4] | 赵群, 李勇, 乔喜, 等. 胃癌组织中Her-2蛋白的过表达与临床病理的相关分析[J]. 肿瘤学杂志, 2015, 21(5): 360–4. [ Zhao Q, Li Y, Qiao X, et al. Correlation Between Overexpression of Her-2 Protein and Clinicopathology in Gastric Cancer[J]. Zhong Liu Xue Za Zhi, 2015, 21(5): 360–4. ] |
| [5] | Fervenza FC, Canetta PA, Barbour SJ, et al. A multicenter randomized controlled trial of rituximab versus cyclosporine in the treatment of idiopathic membranous nephropathy (MENTOR)[J]. Nephron, 2015, 130(3): 159–68. DOI:10.1159/000430849 |
| [6] | Chen M, May BH, Zhou IW, et al. Meta-Analysis of Oxaliplatin-Based chemotherapy combined with traditional medicines for colorectal cancer:contributions of specific plants to tumor response[J]. Integr Cancer Ther, 2016, 15(1): 40–59. DOI:10.1177/1534735415596424 |
| [7] | 孙燕, 石远凯. 临床肿瘤内科手册[M]. 北京: 人民卫生出版社, 2007: 97-107.] [ Sun Y, Shi YK. Handbook of clinical tumor department of Internal Medicine[M]. Beijing: People's Medical Publishing House, 2007: 97-107. ] |
| [8] | Young K, Chau I. Targeted therapies for advanced oesophagogastric cancer:recent progress and future directions[J]. Drugs, 2016, 76(1): 13–26. DOI:10.1007/s40265-015-0510-y |
| [9] | Chia S, Gradishar W, Mauriac L, et al. Double-blind, randomized placebo controlled trial of fulvestrant compared with exemestane after prior nonsteroidal aromatase inhibitor therapy in postmenopausal women with hormone receptor-positive, advanced breast cancer:results from EFECT[J]. J Clin Oncol, 2008, 26(10): 1664–70. DOI:10.1200/JCO.2007.13.5822 |
| [10] | 樊慧婷, 林洪生. 康艾注射液治疗肿瘤的临床应用概况[J]. 肿瘤防治研究, 2014, 41(9): 1045–8. [ Fan HT, Lin HS. Review on Clinical Application and Basic Research of Kang'ai Injection on Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(9): 1045–8. DOI:10.3971/j.issn.1000-8578.2014.09.019 ] |
| [11] | 吴贵成, 郭岚岚, 杨平生, 等. 康艾注射液联合异甘草酸镁对原发性肝癌患者肝动脉化疗栓塞术后免疫及肝功能的影响[J]. 陕西中医, 2017, 38(11): 1497–8. [ Wu GC, Guo LL, Yang PS, et al. Effect of Kang Ai injection combined with magnesium isoglycyrrhizinate on immunity and liver function in patients with primary liver cancer after transcatheter arterial chemoembolization[J]. Shaanxi Zhong Yi, 2017, 38(11): 1497–8. DOI:10.3969/j.issn.1000-7369.2017.11.004 ] |
| [12] | 霍志刚, 马小莉, 武纪生, 等. 康艾注射液治疗化疗后白细胞减少症临床研究[J]. 中医学报, 2017, 32(3): 332–5. [ Huo ZG, Ma XL, Wu JS, et al. Therapeutic Study of Kang' ai Injection in Treatment of Leukopenia After Chemotherapy[J]. Zhong Yi Xue Bao, 2017, 32(3): 332–5. ] |
| [13] | Vecchi V, Pileri S, Burnelli R, et al. Treatment of pediatric Hodgkin disease tailored to stage, mediastinal mass, and age. An Italian (AIEOP) multicenter study on 215 patients[J]. Cancer, 1993, 72(6): 2049–57. DOI:10.1002/(ISSN)1097-0142 |
| [14] | Lapolla A, Frison V, Bettio M, et al. Correlation between baseline characteristics and clinical outcomes in a large population of diabetes patients treated with liraglutide in a real-world setting in Italy[J]. Clin Ther, 2015, 37(3): 574–84. DOI:10.1016/j.clinthera.2014.11.015 |
 2019, Vol. 46
2019, Vol. 46


