文章信息
- 新辅助与辅助膀胱热灌注化疗治疗高危非肌层浸润性膀胱癌的疗效对比
- Effectiveness of Neoadjuvant and Adjuvant Bladder Intracavitary Hyperthermic Perfusion Chemotherapy (BHPC) on High-risk Non-muscle-invasive Bladder Cancer Patients
- 肿瘤防治研究, 2019, 46(3): 253-256
- Cancer Research on Prevention and Treatment, 2019, 46(3): 253-256
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1176
- 收稿日期: 2018-08-17
- 修回日期: 2018-12-17
膀胱癌是泌尿系统常见的恶性肿瘤,75%的膀胱癌患者初次就诊时均诊断为非肌层浸润性膀胱癌(non-muscle invasive bladder cancer, NMIBC),且预后较肌层浸润性膀胱癌好[1-2]。一直以来,经尿道膀胱肿瘤电切术(transurethral resection of the bladder tumor, TURBT)被认为是非肌层浸润性膀胱癌的标准治疗。为预防TURBT术后复发及进展,术后辅助膀胱热灌注治疗目前应用较广泛,术前新辅助治疗则是一种探索性治疗,被应用于肿瘤覆盖面积较广、预估多次电切仍不能保证无肿瘤残留的病例,二者疗效、实施方案、不良反应等方面究竟孰优孰劣,目前尚无定论,本研究旨在探讨二者在临床应用中的有效性、可行性以及患者耐受性。
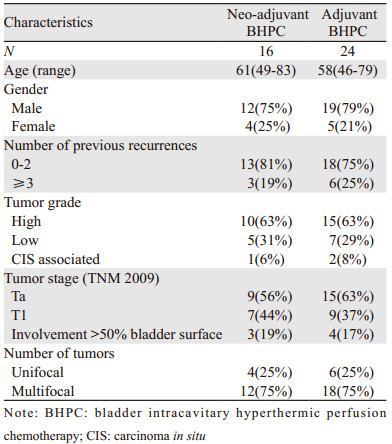
1 资料与方法 1.1 一般资料回顾性收集湖北省肿瘤医院2013年7月—2018年7月经病理证实为尿路上皮癌、多发、复发NMIBC行吉西他滨BHPC的患者40例。其中男31例,女9例;年龄46~83岁;单发肿瘤10例,多发肿瘤30例;初发或者2次复发者31例,3次或3次以上复发者9例;术后病理证实高级别尿路上皮癌25例,低级别尿路上皮癌12例,原位癌3例;分期:Ta 24例,T1 16例;肿瘤侵犯超过50%膀胱黏膜的7例。其中16例行术前(吉西他滨1 000 mg,45℃,45 min)新辅助膀胱热灌注化疗3次,隔天一次,治疗结束后3~7天行经尿道膀胱肿瘤电切术,定义为新辅助组;另外24例患者先行TURBT手术,术后即刻或者隔天行(吉西他滨1 000 mg,45℃,45 min)辅助膀胱热灌注化疗,定义为辅助组。热灌注治疗过程由BR-TRG-Ⅱ型体腔热灌注治疗仪完成,该治疗系统包括加热和循环两部分,通过三腔尿管完成治疗。40例患者均按以上治疗完毕后行常规吉西他滨1 000 mg膀胱灌注1年,术后每3月行膀胱镜检查、每半年行CT检查,随访截至2018年7月31日,复发或死亡记录为终点事件,记录患者无疾病复发生存期(recurrence free survival, RFS)及不良反应,随访结果数据通过绘制生存曲线展示。患者一般情况见表 1。
|
所有数据采用Graphpad 7.0软件进行分析,P < 0.05为差异有统计学意义。
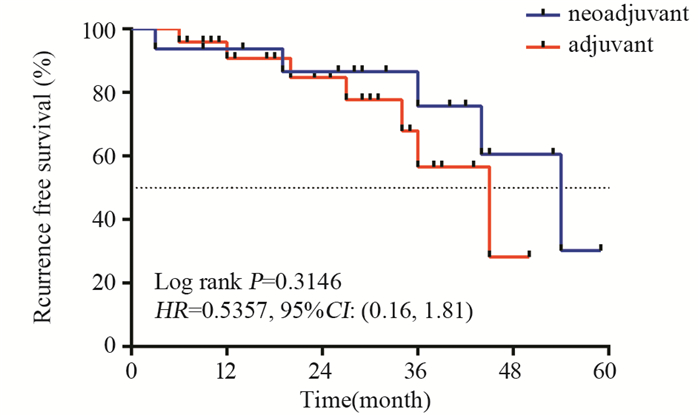
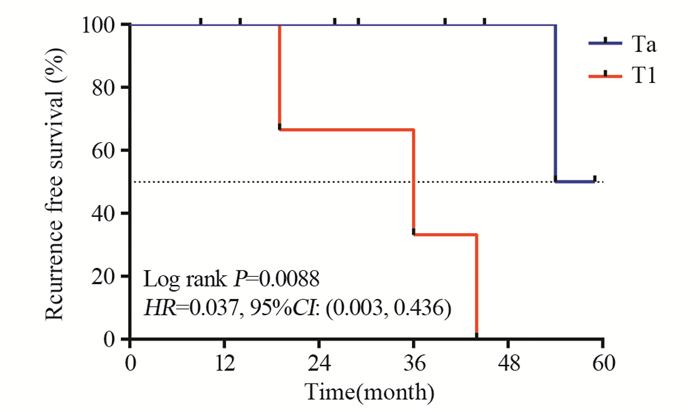
2 结果全部40例患者均完成3次吉西他滨BHPC治疗,新辅助组中11例(68.8%)患者已观察不到任何乳头状肿瘤(pT0),判定为完全缓解(CR),这11例患者中Ta期肿瘤6例,T1期肿瘤5例;其余5例(31.2%)患者的病灶均有不同程度缩小,判定为部分缓解(PR),包括3例Ta期患者和2例T1期患者。16例患者随访0~59月,其中4例复发,分别发生在第19(T1)、36(T1)、44(T1)、54(Ta)月时,该4例中有1例复发,分期分级从Ta低级别进展为T1高级别,其余3例均维持原分期分级(1例Ta高级别,1例T1低级别,1例原位癌)。所有复发患者均再次入院行TURBT治疗。另有1例在治疗后3月因心肌梗死去世,出现终点事件。16例患者中位RFS为54月。辅助组随访0~50月,7例患者分别在第6、12、20、27、34、36、45月复发,均为原分期分级复发(2例Ta高级别,1例Ta低级别,2例T1高级别,1例T1低级别,1例原位癌),均再次入院行TURBT手术治疗。24例患者中位RFS为45月。新辅助BHPC组与辅助BHPC组中位RFS比较,差异无统计学意义(P=0.3146, HR=0.5357, 95%CI: 0.16, 1.81),见图 1。对16例新辅助BHPC组中的CR(pT0)的11例患者亚组分析显示,6例Ta期患者对比5例T1期患者的RFS,差异有统计学意义(P=0.0088,HR=0.037,95%CI: 0.003, 0.436),见图 2。
|
| 图 1 高危非肌层浸润性膀胱癌(NMIBC)新辅助与辅助膀胱热灌注化疗(BHPC)患者Kaplan-Meier生存曲线比较 Figure 1 Kaplan-Meier survival curves of high-risk non-muscle-invasive bladder cancer (NMIBC) patients treated with neoadjuvant and adjuvant bladder intracavitary hyperthermic perfusion chemotherapy (BHPC) |
|
| 图 2 高危NMIBC新辅助BHPC组完全缓解Ta期与T1期患者Kaplan-Meier生存曲线比较 Figure 2 Kaplan-Meier survival curves of high-risk NMIBC patients with pathological complete response pTa and pT1 in neoadjuvant BHPC group |
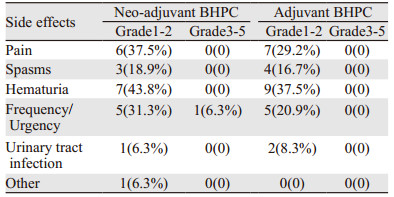
热灌注治疗过程中及治疗结束后患者耐受性均良好,不良反应可耐受,主要不良反应包括排尿疼痛、膀胱痉挛、血尿、尿频尿急尿路刺激、尿路感染等,绝大多数均为常见不良反应事件评价标准(Common Terminology Criteria for Adverse Events, CTCAE)1~2级,不需要临床干预。仅1例新辅助治疗的患者于3次灌注治疗完毕后出现尿频尿急不良反应3级,行利多卡因膀胱灌注、解痉、延迟常规灌注等对症处理后好转,见表 2。
|
据美国国立癌症研究所的数据显示,近40%高危非肌层浸润性膀胱癌患者经电切术后复发仍为非肌层浸润性膀胱癌,另有33%的患者发展成为肌层浸润性膀胱癌,在这部分进展为肌层浸润性膀胱癌的患者中,40%最终因为肿瘤进展而死亡[3]。为了预防TURBT术后复发及进展,欧洲泌尿外科非肌层浸润性膀胱癌指南推荐,对非肌层浸润性膀胱癌按预后因素危险程度分为:低危、中危、高危,其中符合以下任意一条或者多条则定义为高危:T1期肿瘤;高级别肿瘤;多发、复发和直径 > 3 cm的Ta期低级别肿瘤。高危非肌层浸润性膀胱癌患者推荐应用膀胱灌注化疗,尤其是卡介苗,被认为是中高危NMIBC患者最有效的术后辅助治疗,但卡介苗药物不良反应较大,患者难以耐受,且伴随全球药物短缺,所以膀胱热灌注化疗(bladder intracavitary hyperthermic perfusion chemotherapy, BHPC)被推荐应用于高危NMIBC患者的术前及术后治疗[4],其相较于普通膀胱灌注化疗的优势在于升高温度提高了化疗药物通过尿路上皮的渗透性,从而增加了化疗药物在肿瘤细胞中吸收和扩散,同时,热灌注系统的循环灌注增加了化疗药物的均匀分布,也增加了膀胱黏膜的吸收面积[5]。有专家预测,BHPC有望成为不宜行根治性膀胱全切手术以及卡介苗过敏或不能耐受的高危、复发NMIBC患者标准替代治疗[4]。
NMIBC是一种高复发肿瘤,TURBT术后需要辅助膀胱腔内灌注治疗,既往研究表明,常规膀胱灌注化疗使用最普遍的化疗药物为丝裂霉素和卡介苗,但丝裂霉素的疗效主要受低吸收率、药物稀释、药物黏度、尿液pH值、灌注时间等影响[6]。实际有效吸收剂量不足30%。而腔内灌注卡介苗被认为是中高危NMIBC的金标准[7],但卡介苗存在过敏、不良反应较大、药物短缺、耐药、治疗失败等问题[8]。所以经丝裂霉素、卡介苗治疗后,仍有61%的NMIBC患者在术后1年内复发,并伴有疾病进展的风险,尤其是高级别、多发、复发等高危NMIBC患者[9]。有学者对比膀胱热灌注与常规膀胱灌注的疗效,发现热灌注通过提高温度、循环灌注速度明显提高药物在体内分布浓度,而没有达到中毒剂量。膀胱热灌注明显提高了药物溶解度和细胞渗透性,在25℃时最大溶解浓度为0.8 mg/ml,40℃时则可达到1.7 mg/ml[10]。热疗引起细胞内代谢改变,损伤细胞DNA,从而诱导细胞凋亡。此外,热疗还能激活人体免疫应答机制,通过模拟发热、热休克蛋白激活树突状细胞、T细胞和自然杀伤细胞,触发抗肿瘤效应[11]。总之,热灌注疗法联合了局部热疗和化疗,既直接杀伤肿瘤细胞又增强了化疗药物抑制肿瘤细胞的作用,二者起协同作用[12-13],并且循环灌注的冲刷作用对减少残余肿瘤细胞黏附效果也是显而易见的。欧洲泌尿外科指南推荐卡介苗治疗失败或者不适宜根治性膀胱全切的患者联合BHPC治疗[14]。
BHPC目前较多应用于TURBT术后的辅助治疗,而TURBT术前的新辅助治疗主要用于术前预估一次TURBT手术无法完全切除肿瘤以及证实CIS存在的患者[15]。对于肿瘤覆盖超过50%膀胱黏膜、反复多次TURBT手术仍不能保证术后无肿瘤残留的患者,术前新辅助BHPC给患者带来了超过70%的肿瘤完全缓解率[16]。Sousa等[16]注册了一项关于新辅助BHPC治疗中高危非肌层浸润性膀胱癌的临床试验,15例患者共进行了119次治疗,不良反应主要集中在1、2级,无3级以上不良反应,53%的患者CR(pT0),47%患者PR。本研究结果显示CR 68.8%,PR 32.2%,同时,针对CR组11例患者的亚组分析显示,6例Ta期患者中仅有1例复发,出现在第54月,5例T1患者中3例复发,分别出现在第19、36、44月,两者差异有统计学意义。
值得注意的是,现阶段BHPC尚处于探索阶段,灌注药物、时间、频率、实施时机等均没有标准,究竟何种方式更有效、毒性更小,尚存在争论[17]。我们在此进行了一些探索性研究,对比新辅助和辅助吉西他滨BHPC在高危NMIBC中的应用,疗效满意,不良反应可耐受,两组中位RFS达到45月以上,但生存率差异无统计学意义,说明二者可以成为高危NMIBC的有效辅助治疗手段,值得临床应用推广。并且,对新辅助治疗组亚组分析显示,对于Ta期患者的治疗更推荐新辅助BHPC。但是,本研究也有一定的局限性:基于回顾性的非随机对照研究,不可避免存在内在的选择偏倚,并且入组病例数较少,对辅助治疗组的Ta、T1期患者没有进行亚组分析,故有效性尚需要更进一步的大样本前瞻性随机对照研究证实。
作者贡献
刘三河:论文撰写;崔殿生:论文设计
贾全安:病例收集;邓康俐:统计指导
黄雷:方案实施;李有元:论文修订
魏少忠:论文指导
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | Hizli F, Argun G, Guney I, et al. Obturator nerve block transurethral surgery for bladder cancer:comparison of inguinal and intravesical approaches:prospective randomized trial[J]. Ir J Med Sci, 2016, 185(3): 555–60. DOI:10.1007/s11845-015-1300-y |
| [3] | Chamie K, Litwin MS, Bassett JC, et al. Recurrence of high-risk bladder cancer:a population-based analysis[J]. Cancer, 2013, 119(17): 3219–27. DOI:10.1002/cncr.28147 |
| [4] | Sousa A, Piñeiro I, Rodriguez S, et al. Recirculant hyperthermic IntraVEsical chemotherapy (HIVEC) in intermediate-high-risk non-muscle-invasive bladder cancer[J]. Int J Hyperthermia, 2016, 32(4): 374–80. DOI:10.3109/02656736.2016.1142618 |
| [5] | Ba M, Cui S, Wang B, et al. Bladder intracavitary hyperthermic perfusion chemotherapy for the prevention of recurrence of non-muscle invasive bladder cancer after transurethral resection[J]. Oncol Rep, 2017, 37(5): 2761–70. DOI:10.3892/or.2017.5570 |
| [6] | Inman BA, Etienne W, Rubin R, et al. The impact of temperature and urinary constituents on urine viscosity and its relevance to bladder hyperthermia treatment[J]. Int J Hyperthermia, 2013, 29(3): 206–10. DOI:10.3109/02656736.2013.775355 |
| [7] | Arends TJ, van der Heijden AG, Witjes JA. Combined Chemohyperthermia:10-Year Single Center Experience in 160 Patients with Nonmuscle Invasive Bladder Cancer[J]. J Urol, 2014, 192(3): 708–13. DOI:10.1016/j.juro.2014.03.101 |
| [8] | Schooneveldt G, Bakker A, Balidemaj E, et al. Thermal dosimetry for bladder hyperthermia treatment. An overview[J]. Int J Hyperthermia, 2016, 32(4): 417–33. DOI:10.3109/02656736.2016.1156170 |
| [9] | Gözen AS, Umari P, Scheitlin W, et al. Effectivity of intravescical thermo-chemotherapy prophylaxis for patients with high recurrence and progression risk for non-muscle invasive bladder cancer[J]. Arch Ital Urol Androl, 2017, 89(2): 102–5. DOI:10.4081/aiua.2017.2.102 |
| [10] | Milla P, Fiorito C, Soria F, et al. Intravesical thermo-chemotherapy based on conductive heat:a first pharmacokinetic study with mitomycin C in superficial transitional cell carcinoma patients[J]. Cancer Chemother Pharmacol, 2014, 73(3): 503–9. DOI:10.1007/s00280-014-2381-4 |
| [11] | Liem EI, Crezee H, de la Rosette JJ, et al. Chemohyperthermia in non-muscle-invasive bladder cancer:An overview of the literature and recommendations[J]. Int J Hyperthermia, 2016, 32(4): 363–73. DOI:10.3109/02656736.2016.1155760 |
| [12] | Järvinen R, Marttila T, Kaasinen E, et al. Long-term outcome of patients with frequently recurrent non-muscle-invasive bladder carcinoma treated with one perioperative plus four weekly instillations of mitomycin C followed by monthly bacillus Calmette-Guerin (BCG) or alternating BCG and interferon-alpha2b instillations:prospective randomised FinnBladder-4 study[J]. Eur Urol, 2015, 68(4): 611–7. DOI:10.1016/j.eururo.2015.02.022 |
| [13] | Lammers RJ, Witjes JA, Inman BA, et al. The role of a combined regimen with intravesical chemotherapy and hyperthermia in the management of non-muscle-invasive bladder cancer:a systematic review[J]. Eur Urol, 2011, 60(1): 81–93. |
| [14] | Babjuk M, Böhle A, Burger M, et al. EAU Guidelines on Non-Muscle-invasive Urothelial Carcinoma of the Bladder:Update 2016[J]. Eur Urol, 2017, 71(3): 447–61. DOI:10.1016/j.eururo.2016.05.041 |
| [15] | Arends TJ, Nativ O, Maffezzini M, et al. Results of a Randomised Controlled Trial Comparing Intravesical Chemohyperthermia with Mitomycin C Versus Bacillus Calmette-Guerin for Adjuvant Treatment of Patients with Intermediate-and High-risk Non-Muscle-invasive Bladder Cancer[J]. Eur Urol, 2016, 69(6): 1046–52. DOI:10.1016/j.eururo.2016.01.006 |
| [16] | Sousa A, Inman BA, Piñeiro I, et al. A clinical trial of neoadjuvant hyperthermic intravesical chemotherapy (HIVEC) for treating intermediate and high-risk non-muscle invasive bladder cancer[J]. Int J Hyperthermia, 2014, 30(3): 166–70. DOI:10.3109/02656736.2014.900194 |
| [17] | Ekin RG, Akarken I, Cakmak O, et al. Results of Intravesical Chemo-Hyperthermia in High-risk Non-muscle Invasive Bladder Cancer[J]. Asian Pac J Cancer Prev, 2015, 16(8): 3241–5. DOI:10.7314/APJCP.2015.16.8.3241 |
 2019, Vol. 46
2019, Vol. 46


