文章信息
- 外周血细胞计数及其比值对初诊伴非骨相关髓外病变的多发性骨髓瘤患者预后的评估价值
- Value of Peripheral Blood Cell Count and Its Ratio in Evaluating Prognosis of Newly Diagnosed Multiple Myeloma Patients with Non-bone-related Extramedullary Diseases
- 肿瘤防治研究, 2019, 46(5): 456-462
- Cancer Research on Prevention and Treatment, 2019, 46(5): 456-462
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1075
- 收稿日期: 2018-08-02
- 修回日期: 2019-03-06
多发性骨髓瘤(multiple myeloma, MM)是一种起源于骨髓的恶性浆细胞肿瘤,特征为骨髓浆细胞异常增生并伴有单克隆免疫球蛋白过度生成,部分患者出现髓外器官或组织的浆细胞增生异常(初诊或治疗过程中),称为髓外病变(extramedullary disease, EMD)。EMD根据传播机制及途径的不同分为两类,一类为定义提出较早的严格的髓外病变(strict EMD, sEMD),即病灶是经血液传播由骨髓原发灶传播至非骨及骨旁组织;另一类为近年来部分学者提出的骨相关髓外病变(bone-related EMD, bEMD),即由骨髓原发灶直接浸润形成的灶性病变,但更多学者认为,bEMD是由于肿瘤负荷较重的行为表现,sEMD往往更能体现髓外病变的特征特点及对预后的预测性。国外多篇相关报道显示,初诊即伴sEMD的MM患者约占MM总患者的7%~18%[1],且多为预后不良的标志[2]。外周血细胞计数作为一种经济、普及的检验指标,临床工作中常常作为重要参考指标用于指导后续治疗,而外周血淋巴细胞计数(ALC)、单核细胞计数(AMC)作为炎性指标,亦可在一定程度上反映机体的免疫状态,已有多篇报道表明,ALC、AMC、ALC与AMC比值(LMR)、血小板与ALC比值(PLR)高低不同可影响多种恶性肿瘤的预后[3-6]。但国内对于初诊伴sEMD的MM患者预后与外周血细胞计数及比值的相关性研究报道较少,本文进行了相关探讨。
1 资料与方法 1.1 病例资料收集2005年1月—2017年6月就诊于天津医科大学肿瘤医院的81例患者,所有患者均具有完整病例资料,经确诊均为初诊MM患者,并均伴有sEMD,所有患者均为初始起病,均无恶性肿瘤病史,均未接受过放化疗治疗。年龄为18~75岁,sEMD定义为经病变部位活检病理检查证实的累及骨髓及骨骼之外的浆细胞瘤,除髓外孤立性浆细胞瘤外,且除骨相关EMD外。81例患者中,男性46名(56.79%)、女性35名(43.21%);发病中位年龄58岁(19~82岁),其中老年发病(≥65岁)占23例(28.40%);初始发病ISS分期Ⅰ期26例(32.10%)、Ⅱ期21例(25.93%)、Ⅲ期34例(41.97%);贫血患者39例(48.15%);LDH水平高于正常44例(54.32%);β2微球蛋白水平高于正常34例(41.98%);肌酐偏高23例(28.40%);低蛋白血症患者28例(34.57%);免疫球蛋白分型,IgG型最多38例(46.91%),IgD型最少3例(3.70%);初诊时大部分患者骨破坏数目3处以上61例(75.31%);骨髓浆细胞比例20%以上的20例(24.69%)。髓外病变部位以软组织最多见有56例(69.14%),其次依次为中枢神经系统有12例(14.81%)、胸腔脏器有6例(7.41%)、胸膜及腹膜有5例(6.17%)及其他少见的部位如皮肤、眼睑等。为探讨遗传学因素对初诊伴sEMD患者预后的影响,本研究对具有完整FISH检测结果的19例患者做了相关分析。
1.2 治疗方法81例患者中,除5例姑息治疗外,76例患者均接受治疗,其中2例单纯放疗,74例患者行以化疗为主的综合治疗。74例接受化疗的患者中,有2例患者因个人原因未能行完整周期化疗。接受化疗患者中30例选择单纯化疗,化疗联合放疗13例,化疗基础上自体基因造血干细胞移植10例,另有21例患者行化疗联合手术形式改善局部肿物的压迫。化疗方案主要以烷化剂、糖皮质激素、免疫调节剂、蒽环类药物为基础,并有部分患者接受了含硼替佐米(蛋白酶体抑制剂)方案的化疗。
1.3 观察指标及疗效评定观察指标包括:外周血ALC、AMC、LMR、PLR、年龄、性别、乳酸脱氢酶水平(LDH)、外周血血红蛋白水平(Hb)、β2微球蛋白水平(β2-MG)、肌酐水平、血清白蛋白水平(Alb)、ISS分期、初诊骨髓浆细胞比例、骨破坏数目、治疗疗效及预后生存情况。疗效评价参照国际骨髓瘤工作组(IMWG)指南,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),总体反应率(ORR)定义为CR+PR[7]。
1.4 随访情况全部患者随访时间为1~115月,平均随访时间33.8月,通过电话、门诊复诊、信件等随诊形式,81例患者中,2例失访、79例获得随访,随访率97.53%。总生存时间(OS)定义为从疾病确诊至任何原因引起的患者死亡事件出现或随访截止时间。
1.5 统计学方法采用SPSS25.0软件进行统计学分析。单因素预后分析采用Kaplan-Meier法,多因素预后分析采用Cox比例风险回归模型。组间资料的相互比较及对应组生存率的比较采用χ2检验或连续校正χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各观察指标及分组研究外周血细胞计数及其比值对伴sEMD的MM患者预后影响,分别采用外周血ALC、AMC、PLR、LMR的中位数作为界值将此四组分为高值组和低值组,ALC、LMC、PLR、LMR中位值分别为1.38×109/L、0.48×109/L、134.9、3.11。全组ALC范围(0.35~2.71)×109/L,高ALC组(> 1.38×109/L)40例、低ALC组(≤1.38×109/L)41例;全组AMC范围(0.05~1.21)×109/L,高AMC组(≥0.48×109/L)41例、低AMC组(< 0.48×109/L)40例;全组PLR范围16.33~500,高PLR组(≥134.9)41例、低PLR组(< 134.9)40例;全组LMR范围0.57~43.6,高LMR组(> 3.11)39例、低LMR组(≤3.11)42例。
2.2 疗效分析81例患者中,74例可评价疗效(91.36%)。结果示ORR为67.57%(50/74),其中CR 18例(24.32%)、PR 32例(43.24%)、SD 7例(9.46%),PD 17例(22.97%)。13例患者接受了含硼替佐米的化疗方案,9例有效,有效率69.23%。外周血ALC、AMC值高低在疗效上差异无统计学意义(均P > 0.05),而PLR、LMR高值组与低值组在疗效上差异有统计学意义(P=0.032、0.030)。
2.3 生存情况79例获得随访患者中,59例死亡、20例存活,总生存率25.32%,其中高ALC组与低ALC组的3年生存率分别为35.90%(14/39)、15.00%(6/40),差异有统计学意义(P=0.033);高AMC组与低AMC组的3年生存率分别为15.38%(6/39)、35.00%(14/40),差异有统计学意义(P=0.045);高PLR组与低PLR组的3年生存率分别为15.38%(6/39)、35.00%(14/40),差异有统计学意义(P=0.045);高LMR组与低LMR组的3年生存率分别为42.11%(16/38)、9.76%(4/41),差异有统计学意义(P=0.002)。
2.4 外周血ALC、AMC、PLR、LMR与临床病理特征的关系高ALC组与低ALC组在Alb水平(P=0.005)、ISS分期(P=0.031)、Hb水平(P=0.019)、LDH水平(P=0.011)、β2微球蛋白水平(P=0.031)上差异均有统计学意义,而在年龄、性别、肌酐水平、骨破坏数目、骨髓浆细胞比例上差异均无统计学意义(均P > 0.05);高AMC组与低AMC组在ISS分期(P=0.031)、LDH水平(P=0.011)、β2微球蛋白水平(P=0.031)上差异均有统计学意义,而在年龄、性别、Hb水平、Alb水平、肌酐水平、骨破坏数目、骨髓浆细胞比例上差异均无统计学意义(均P > 0.05);高LMR组与低LMR组在ISS分期(P=0.004)、LDH水平(P=0.001)、β2微球蛋白水平(P=0.004)上差异均有统计学意义,而在年龄、性别、Hb水平、Alb水平、肌酐水平、骨破坏数目、骨髓浆细胞比例上差异均无统计学意义(均P > 0.05);高PLR组与低PLR组在ISS分期(P=0.002)、LDH水平(P=0.035)、β2微球蛋白水平(P=0.002)上差异均有统计学意义,而在年龄、性别、Hb水平、Alb水平、肌酐水平、骨破坏数目、骨髓浆细胞比例上差异均无统计学意义(均P > 0.05),见表 1。
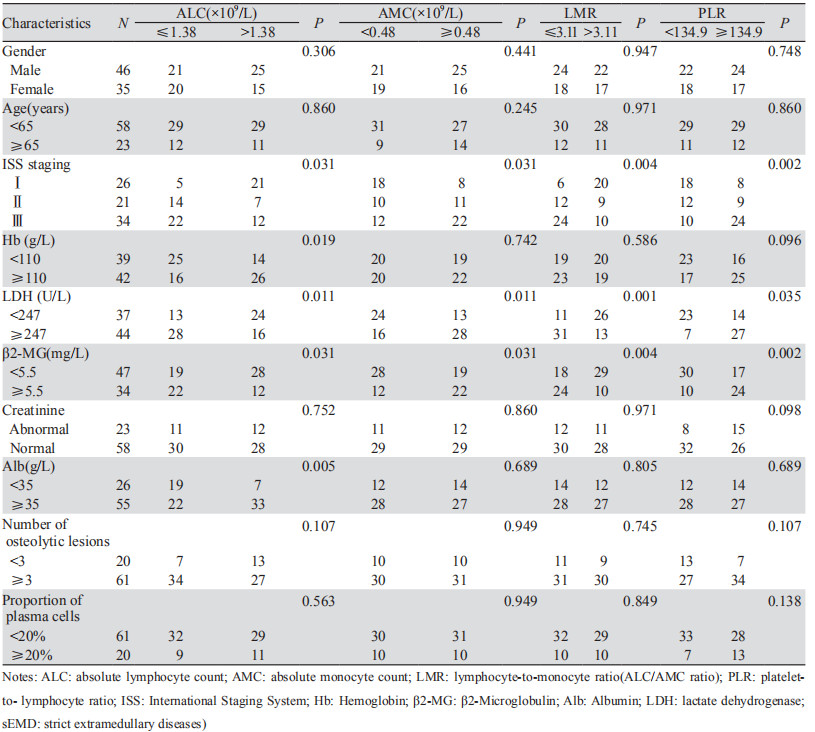
|
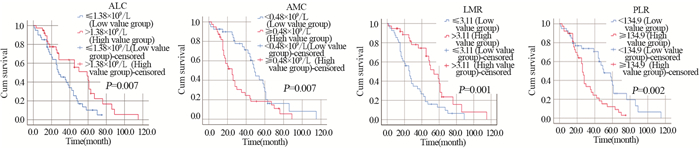
79例获得随访结果的患者中,预后单因素分析显示:ALC≤1.38×109/L(P=0.007)、AMC≥0.48×109/L(P=0.007)、LMR≤3.11(P=0.001)、PLR≥134.9(P=0.002)是初诊时伴sEMD患者的预后不良因素,见图 1。此外,分析显示β2微球蛋白≥5.5 mg/L(P=0.047)、LDH≥247 U/L(P=0.012)、Hb≤110 g/L(P=0.024)、ISS分期(P=0.047)、骨破坏数目≥3处(P=0.048)、骨髓浆细胞比例≥20%(P=0.049)亦为初诊时伴sEMD患者的预后不良因素。而单纯从放疗这一项指标来看,单因素分析显示,患者接受放疗与否与其预后生存情况并无显著关系(P=0.089)。
|
| ALC: absolute lymphocyte count; AMC: absolute monocyte count; LMR: ALC/AMC ratio; PLR: platelet-to- lymphocyte ratio 图 1 初诊时伴sEMD的MM患者外周血ALC、AMC、LMR、PLR高值组与低值组生存曲线 Figure 1 Survival curves of initially-diagnosed MM patients with sEMD in high and low value groups of peripheral blood ALC, AMC, LMR and PLR |
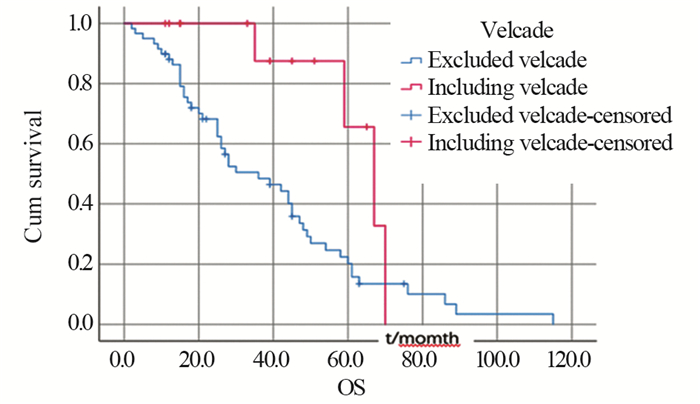
为了研究硼替佐米对预后生存的影响,另将获得完整随访且接受了完整周期化疗的共计72例患者重新纳入单因素分析,结果显示化疗方案中含硼替佐米与否对患者预后生存的影响有统计学意义(P=0.022),见图 2。(由于和上述分析收纳病例范围不同,此部分患者并未纳入以下多因素分析中。)
|
| 图 2 72例初诊时伴sEMD的MM患者化疗方案中含硼替佐米与不含硼替佐米组生存曲线 Figure 2 Survival curves of 72 initially diagnosed MM patients with sEMD receiving velcade and non-velcade chemotherapy regimen |
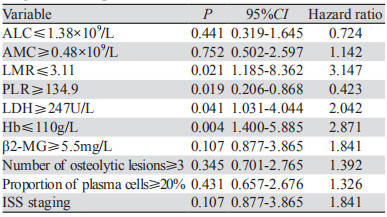
将单因素分析结果显示差异有统计学意义的因素进一步纳入预后多因素分析,结果显示LMR≤3.11、PLR≥134.9、LDH≥247 U/L、Hb≤110 g/L是初诊时伴sEMD的MM患者的独立预后不良因素,见表 2。
|
我院2015年开始全面开展FISH对于初诊骨髓瘤患者相关基因及染色体片段的检测工作,主要检测四项,分别为RB-1基因缺失、Iq21扩增、TP53缺失、IgH重排。在本研究81例MM患者,进行全套骨髓FISH检测的初诊伴sEMD的MM患者共19例,出现染色体异常患者11例,其中9例为单项异常、2例为双项异常(RB-1缺失阳性合并Iq21扩增阳性1例、TP53缺失阳性合并Iq21扩增阳性1例)。总体来看,RB-1基因缺失阳性3例,Iq21扩增阳性3例,TP53缺失阳性2例,IgH重排阳性6例(其中t(11,14)5例,t(14,16)1例)。
为探讨遗传学因素对该部分患者预后的影响意义,将初诊伴染色体异常的11例患者纳入单因素分析,结果显示Iq21扩增阳性(P=0.026)、TP53缺失阳性(P=0.001)、t(11,14)阳性(P=0.030)、t(14,16)阳性(P=0.002)是影响初诊伴sEMD的MM患者预后的显著因素,而RB-1基因缺失阳性可能对该部分患者无明显预后指导意义(P=0.803),见图 3。
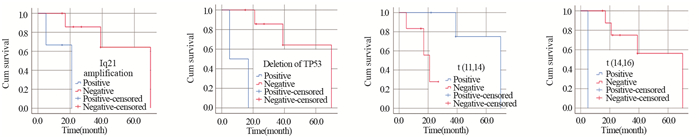
|
| 图 3 FISH检测11例相关基因阳性与阴性患者的生存曲线 Figure 3 Survival curves of 11 related gene positive and negative patients detected by FISH |
MM是一种以浆细胞异常增生为特征的恶性肿瘤,发病率约占血液系统恶性肿瘤的10%,且呈逐年上升趋势[8],现已成为血液系统肿瘤发病率第二位[9]。MM患者的髓外转移发病机制尚未完全明确。无论发生于初诊还是疾病治疗阶段,伴EMD的MM患者生存期均较无EMD患者缩短,对常规治疗不敏感,预后较差[1]。有研究对比了伴EMD与无EMD的MM患者分别进行大剂量化疗后的反映,结果提示两组患者具有相似的预后,提示临床工作中对伴EMD的MM患者的治疗应重视大剂量化疗,可能有助于改善疾病患者预后[10]。另有研究显示以蛋白酶体抑制剂(硼替佐米)为主体的化疗方案可较好改善伴EMD的MM患者预后,同时更多关于第二代蛋白酶体抑制剂卡非佐米的药物临床研究也正在进行中,有望进一步改善此部分患者的预后[11]。本研究回顾性分析81例初诊时伴sEMD的MM患者临床资料,发现LDH水平高于正常、贫血、β2-MG水平高于正常、初诊时骨破坏数目≥3处、骨髓浆细胞比例≥20%、ISS分期高的患者OS较短(均P < 0.05),提示预后相对不良,而性别、年龄、白蛋白水平、肌酐水平对生存率无显著影响(均P > 0.05)。进一步分析显示LMR≤3.11、PLR≥134.9、LDH≥247U/L、Hb≤110 g/L(均P < 0.05)是此类患者的独立预后不良因素。
白细胞是炎性反应的重要细胞组分,淋巴细胞、单核细胞是白细胞的重要成分,而炎性反应程度又在肿瘤的发生发展中起着重要作用。淋巴细胞是体液免疫的重要环节,作为炎性反应的重要成分,在免疫反应中,担任效应细胞,具有抗肿瘤和抗感染功能[12]。近年来,Yan等[13]通过建立小鼠卵巢癌模型,证实了在血管外的肿瘤微环境中存在大量血小板,而这些肿瘤微环境中的血小板可以直接或间接影响肿瘤细胞的形成,促进癌细胞的生长。PLR为外周血血小板计数与淋巴细胞计数比值,二者比值可作为一项更直观的指标预测肿瘤患者预后。单核细胞来源于骨髓造血干细胞,作为炎性反应发生过程中的主要细胞成分,其数量增多往往提示较重的炎性反应。多项研究表明,外周血炎性细胞与肿瘤的发生与发展之间存在密切的关系,包括中性粒细胞、淋巴细胞、单核细胞,且与多种肿瘤的预后有着显著相关性[14-15]。
多项研究已证实LMR与肺癌、鼻咽癌、胃癌等多种实体肿瘤预后的相关性[16-18],但有关LMR与初诊即伴有sEMD的MM患者的预后关系研究较少,本研究发现,对于此部分患者,LMR依旧是一项可有效预测患者预后的敏感指标。外周血计数作为各级医院普遍开展的常规化验项目,化验取材简易、耗材小、普及度高,且较为经济,经本文研究证实,可作为初诊时伴髓外病变的多发性骨髓瘤患者的预后判断指标之一。
LDH作为临床肿瘤科室常用的一种肿瘤标志物,可反映肿瘤细胞负荷。多项研究证实LDH水平升高与多种血液系统疾病的相关性[19-21]。本研究发现LDH水平偏高亦可作为初诊伴sEMD的MM患者预后不良的独立影响因素之一。LDH是反映细胞增殖活性的重要指标,对多种肿瘤包括MM患者的预后有重要影响意义,与本研究结果相同[22-23]。MM患者具有染色体不稳定的特征,当前研究普遍认为具有染色体异常的MM患者与其预后有密切的关系[7, 24-25]。FISH是检测间期细胞核染色体异常的技术手段,克服了常规R/G显带核型分析需要检测中期细胞核分裂项的弊端,因而现已经成为MM患者异常核型检查的标准化检查方法[26]。我院2015年开始对收治的初诊MM患者规范化开展染色体异常的FISH检测工作,对于MM患者预后转归、危险度分层提供了很好的参考依据。
本研究仍存在一些不足之处,如样本量相对较少,选取样本受地域局限影响较大,尚不能完全阐明血细胞计数对此研究部分患者的全部影响,期待早日建立多中心、大样本、更规范的临床试验研究,以期更好的造福更多的血液病患者。
作者贡献
井瑶瑶: 患者随访、数据收集录入及分析、文章撰写及修改
杨洪亮、赵海丰: 数据收集
于泳、张翼鷟: 数据分析
赵智刚、王亚非: 数据录入
王晓芳: 文章的选题、数据分析及文章修改工作
| [1] | Bladé J, Fernández de Larrea C, Rosiñol L, et al. Soft-tissue plasmacytomas in multiple myeloma: incidence, mechanisms of extramedullary spread, and treatment approach[J]. J Clin Oncol, 2011, 29(28): 3805–12. DOI:10.1200/JCO.2011.34.9290 |
| [2] | Weinstock M, Aljawai Y, Morgan EA, et al. Incidence and clinical features of extramedullary multiple myeloma in patients who underwent stem cell transplantation[J]. Br J Haematol, 2015, 169(6): 851–8. DOI:10.1111/bjh.2015.169.issue-6 |
| [3] | Lin B, Chen C, Qian Y, et al. Prognostic role of peripheral blood lymphocyte/monocyte ratio at diagnosis in diffuse large B-cell lymphoma: a meta-analysis[J]. Leuk Lymphoma, 2015, 56(9): 2563–8. DOI:10.3109/10428194.2015.1014367 |
| [4] | Chen L, Zhang F, Sheng XG, et al. Decreased pretreatment lymphocyte/monocyte ratio is associated with poor prognosis in stage Ⅰb1-Ⅱa cervical cancer patients who undergo radical surgery[J]. Onco Targets Ther, 2015, 8: 1355–62. |
| [5] | Haruma T, Nakamura K, Nishida T, et al. Pre-treatment neutrophil to lymphocyte ratio is a predictor of prognosis in endometrial cancer[J]. Anticancer Res, 2015, 35(1): 337–43. |
| [6] | Porrata LF, Ristow K, Colgan JP, et al. Peripheral blood lymphocyte/monocyte ratio at diagnosis and survival in classical Hodgkin's lymphoma[J]. Haematologica, 2012, 97(2): 262–9. DOI:10.3324/haematol.2011.050138 |
| [7] | Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma[J]. Lancet Oncol, 2014, 15(12): e538-48. |
| [8] | Gerecke C, Fuhrmann S, Strifler S, et al. The Diagnosis and Treatment of Multiple Myeloma[J]. Dtsch Arztebl Int, 2016, 113(27-28): 470–6. |
| [9] | Ma J, Liu S, Wang Y. MicroRNA-21 and multiple myeloma: small molecule and big function[J]. Med Oncol, 2014, 31(8): 94. DOI:10.1007/s12032-014-0094-5 |
| [10] | Bjorklund CC, Baladandayuthapani V, Lin HY, et al. Evidence of a role for CD44 and cell adhesion in mediating resistance to lenalidomide in multiple myeloma: therapeutic implications[J]. Leukemia, 2014, 28(2): 373–83. DOI:10.1038/leu.2013.174 |
| [11] | Highsmith KN, Chen SE, Horowitz S. Carfilzomib and pomalidomide: recent advances in the treatment of multiple myeloma[J]. Pharmacotherapy, 2014, 34(9): 927–40. DOI:10.1002/phar.1463 |
| [12] | Le Jeune C, Bertoli S, Elhamri M, et al. Initial absolute lymphocyte count as a prognostic factor for outcome in acute myeloid leukemia[J]. Leuk Lymphoma, 2014, 55(4): 855–62. DOI:10.3109/10428194.2013.813504 |
| [13] | Yan M, Jurasz P. The role of platelets in the tumor microenvironment: From solid tumors to leukemia[J]. Biochim Biophys Acta, 2016, 1863(3): 392–400. DOI:10.1016/j.bbamcr.2015.07.008 |
| [14] | Zhou D, Liang J, Xu LI, et al. Derived neutrophil to lymphocyte ratio predicts prognosis for patients with HBV-associated hepatocellular carcinoma following transarterial chemoembolization[J]. Oncol Lett, 2016, 11(5): 2987–94. DOI:10.3892/ol.2016.4359 |
| [15] | Friedman DR, Sibley AB, Owzar K, et al. Relationship of blood monocytes with chronic lymphocytic leukemia aggressiveness and outcomes: a multi-institutional study[J]. Am J Hematol, 2016, 91(7): 687–91. DOI:10.1002/ajh.24376 |
| [16] | Song YJ, Wang LX, Hong YQ, et al. Lymphocyte to monocyte ratio is associated with response to first-line platinum-based chemotherapy and prognosis of early-stage non-small cell lung cancer patients[J]. Tumour Biol, 2016, 37(4): 5285–93. DOI:10.1007/s13277-015-4397-8 |
| [17] | Li J, Jiang R, Liu WS, et al. A large cohort study reveals the association of elevated peripheral blood lymphocyte-to-monocyte ratio with favorable prognosis in nasopharyngeal carcinoma[J]. PLoS One, 2013, 8(12): e83069. DOI:10.1371/journal.pone.0083069 |
| [18] | Lin JP, Lin JX, Cao LL, et al. Preoperative lymphocyte-to-monocyte ratio as a strong predictor of survival and recurrence for gastric cancer after radical-intent surgery[J]. Oncotarget, 2017, 8(45): 79234–47. |
| [19] | Kiba T, Ito T, Nakashima T, et al. Bortezomib and dexamethasone for multiple myeloma: higher AST and LDH levels associated with a worse prognosis on overall survival[J]. BMC Cancer, 2014, 14: 462. DOI:10.1186/1471-2407-14-462 |
| [20] | 黄莉, 姚红霞. 61例继发性噬血细胞综合征临床治疗及预后分析[J]. 中国实验血液学杂志, 2016, 24(2): 580–3. [ Huang L, Yao HX. Clinical therapy and prognostic analysis of 61 patients with secondary hemophagocytic syndrome[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2016, 24(2): 580–3. ] |
| [21] | Yi JH, Kim JH, Baek KK, et al. Elevated LDH and paranasal sinus involvement are risk factors for central nervous system involvement in patients with peripheral T-cell lymphoma[J]. Ann Oncol, 2011, 22(7): 1636–43. DOI:10.1093/annonc/mdq645 |
| [22] | Chim CS, Sim J, Tam S, et al. LDH is an adverse prognostic factor independent of ISS in transplant-eligible myeloma patients receiving bortezomib-based induction regimens[J]. Eur J Haematol, 2015, 94(4): 330–5. DOI:10.1111/ejh.2015.94.issue-4 |
| [23] | Lust JA, Lacy MQ, Zeldenrust SR, et al. Reduction in C-reactive protein indicates successful targeting of the IL-1/IL-6 axis resulting in improved survival in early stage multiple myeloma[J]. Am J Hematol, 2016, 91(6): 571–4. DOI:10.1002/ajh.v91.6 |
| [24] | Palumbo A, Anderson K. Multiple myeloma[J]. N Engl J Med, 2011, 364(11): 1046–60. DOI:10.1056/NEJMra1011442 |
| [25] | Morgan GJ, Walker BA, Davies FE. The genetic architecture of multiple myeloma[J]. Nat Rev Cancer, 2012, 12(5): 335–48. DOI:10.1038/nrc3257 |
| [26] | Sonneveld P, Avet-Loiseau H, Lonial S, et al. Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group[J]. Blood, 2016, 127(24): 2955–62. DOI:10.1182/blood-2016-01-631200 |
 2019, Vol. 46
2019, Vol. 46


