文章信息
- 阿帕替尼联合其他方法治疗肿瘤的研究进展
- Research Progress of Combination Therapy of Apatinib on Tumor
- 肿瘤防治研究, 2019, 46(3): 275-280
- Cancer Research on Prevention and Treatment, 2019, 46(3): 275-280
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1059
- 收稿日期: 2018-08-01
- 修回日期: 2018-10-09
2. 200120 上海,同济大学附属东方医院转化医学研究中心肿瘤干细胞研究所;
3. 100029 北京,中日友好医院普外科;
4. 100029 北京,中日友好医院临床医学研究所
2. Research Center for Translational Medicine, Cancer Stem Cell Institute, East Hospital, Tongji University School of Medicine, Shanghai 200120, China;
3. Department of General Surgery, China-Japan Friendship Hospital, Beijing 100029, China;
4. Institute of Clinical Medical Sciences, China-Japan Friendship Hospital, Beijing 100029, China
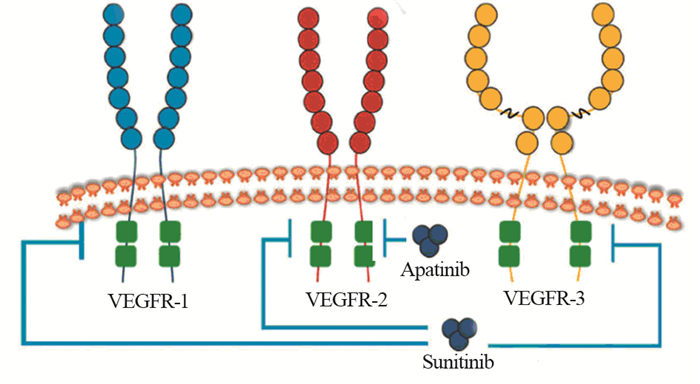
阿帕替尼是我国历经十年自主研制的一种小分子酪氨酸酶抑制剂,可以与血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)的ATP结合位点高特异性结合,抑制血管新生,发挥抗肿瘤疗效[1],见图 1。目前,阿帕替尼单药治疗已经成功应用于晚期胃癌、非小细胞肺癌和乳腺癌等[2-5]。但是,单一用药会使人体对特定药物产生耐药性的概率增大,减弱药物的疗效[6-7],合理的联合用药可以增加药物的疗效或减轻药物的不良反应。根据抗肿瘤药物的作用机制和肿瘤细胞增殖动力学进行合理联合用药,是近年来联合用药抗肿瘤的重要方向。目前临床上已经将阿帕替尼与其他药物或治疗方法进行同步联合治疗,并得到较单药更好的治疗效果。本文将分别讨论阿帕替尼与化疗药物、靶向药物、放疗、中药制剂以及免疫疗法联合应用的治疗效果以及研究进展。
|
| In contrast to multi-targeted anti-angiogenesis inhibitor sunitinib, apatinib is a highly selective VEGFR2-targeted drug. 图 1 阿帕替尼的作用机制 Figure 1 Mechanism of apatinib |
化疗药物如紫杉醇、阿霉素、依托泊苷等是通过干扰肿瘤细胞核酸代谢或有丝分裂,达到阻止或减缓肿瘤细胞的生长的效果。化疗往往会产生耐药性,从而降低药效,影响治疗效果。药物产生耐药性的原因之一是进入肿瘤细胞内部的化疗药物会由胞膜上的ABC转运蛋白外排出去[7],其中P-糖蛋白(ABCB1),多耐药蛋白(MRP1, ABCC1)、乳腺癌耐药蛋白(BCRP, ABCG2)为主要的转运蛋白[8]。研究显示阿帕替尼与化疗药物联用时能显著抑制转运蛋白的外排功能,增加耐药细胞对药物的敏感度,甚至逆转细胞的多药耐药性,增强药物的抗肿瘤疗效[9]。目前临床已将阿帕替尼与多种化疗药物联用并且取得了较好的治疗效果[10-12]。
1.1 阿帕替尼联合紫杉醇/阿霉素杨涛等[13]报道了60例晚期非小细胞肺癌患者联合治疗的双臂临床实验,患者被随机平均分为常规化疗组(紫杉醇)和实验组(紫杉醇+阿帕替尼),结果发现:实验组完全缓解6例,部分缓解13例,病情稳定10例,疾病进展1例,总缓解率为63.3%,而常规化疗组完全缓解2例,部分缓解10例,病情稳定12例,疾病进展6例,总缓解率为40%,阿帕替尼联合治疗组相对于化疗单药组的临床效果确切,并且治疗后患者的生活质量、卡氏评分改善幅度更大(P < 0.05),同时减少了常规化疗出现的不良反应。对于阿帕替尼和阿霉素的联合应用,Tong等[14]研究了在ABCB1高表达的白血病细胞中,阿帕替尼与阿霉素的联合应用可通过阿帕替尼靶向侧群富集的白血病干细胞而增强疗效,为治疗白血病提供了新的方案;赵攀攀等[15]报道了8例复发性卵巢癌患者联合阿帕替尼和阿霉素进行治疗的临床实验。其中7例(87.5%)肿瘤部分缓解,1例(12.5%)病情稳定。CT检测提示,肿瘤病灶在治疗第3周期时开始缩小(平均缩小约20%),第6周期时缩小更明显(约60%)。阿帕替尼的不良反应通过对症治疗均可控可耐受,结果表明阿帕替尼与脂质体阿霉素联合治疗复发性卵巢癌的有效率较高,不良反应可控,有望成为复发性卵巢癌有效、安全的候选治疗方案。
1.2 阿帕替尼联合依托泊苷Lan等[16]开展了一项编号NCT02867956关于阿帕替尼联合依托泊苷治疗卵巢癌的Ⅱ期临床单臂实验,实验共入组38名患者并采用依托泊苷(50 mg,1次/日,1~14天)联合口服阿帕替尼(500毫克/(次·天)进行为期21天的治疗。直至实验结束,20例(57%)患者终止研究,15例(43%)患者继续治疗,联合用药患者的客观反应率为54%。治疗中出现的不良反应为中性粒细胞减少(17(50%))、疲劳(11(32%))、贫血(10(29%))和黏膜炎(8(24%))。实验结果显示阿帕替尼联合口服依托泊苷对铂耐药或铂难治性卵巢癌患者有较好的疗效和可控制的不良反应,可以延长患者的生存期,提高患者的生活质量。
1.3 阿帕替尼联合替吉奥阮寒光等[17]的研究数据表明,阿帕替尼联合替吉奥在治疗晚期胃癌过程中为有效药物并且安全性好,不良反应可控且患者出现手足综合征及继发性高血压预示疗效可能更好。杨欣怡等[18]回顾性分析了38例经一线化疗失败的晚期胃癌患者的资料,其中19例为单药组(阿帕替尼),19例为双药组(阿帕替尼联合替吉奥),比较两组患者的临床疗效以及不良反应。结果发现双药组和单药组总有效率分别为21.1%和10.5%(P=0.370);疾病控制率分别为68.4%和42.1%(P=0.023);中位无进展生存时间分别为4.5和3.0月(P=0.013),中位生存时间分别为9.49和5.78月(P=0.022)。双药组和单药组均出现Ⅰ、Ⅱ度不良反应。说明晚期胃癌二线治疗中采用阿帕替尼联合替吉奥方案疗效优于阿帕替尼单药组,可能成为晚期胃癌二线治疗方案一种新的选择。
1.4 阿帕替尼联合化疗栓塞Lu等[19]报道了44例中晚期肝癌患者,随机平均分为经导管动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)联合阿帕替尼(A组)或单独TACE(B组)。治疗3月后A、B组甲胎蛋白(AFP)水平较治疗前明显下降(P < 0.05)。A、B组治疗9月后的ORR分别为13.64%和45%(P < 0.05)。单独TACE组的不良反应相比联合治疗组更严重。说明阿帕替尼联合TACE的长期治疗效果优于单独TACE,并且可以显著延长患者的PFS,不良反应可接受。Liu等[20]回顾性分析19例肝癌合并肝细胞癌门静脉癌栓(portal vein tumor thrombus, PVTT)患者,联合阿帕替尼和TACE进行治疗。直至实验结束,所有患者完成随访,中位随访时间为13月。19例中有63.16%发生疾病进展, 21.05%疾病稳定,肿瘤的客观缓解率和疾病控制率分别为63.16%和84.21%,对于门静脉癌栓的客观缓解率和疾病控制率分别为10.93%和89.48%。中位OS为11.9月、6月和1年的总生存率(OS)分别为94.7%和48.8%。中位无进展生存期(PFS)8.1月、6月和1年PFS率分别为73.3%和22.9%。结果表明阿帕替尼联合TACE治疗肝癌合并门静脉癌栓患者是安全的并且可以改善患者的OS和PFS。
2 阿帕替尼与靶向药物联用 2.1 阿帕替尼与EGFR-TK抑制剂联用EGFR-TK为表皮生长因子受体酪氨酸激酶,其抑制剂如吉非替尼、埃克替尼,可阻碍肿瘤的生长、转移和血管生成,并增加肿瘤细胞的凋亡。EGFR-TK与VEGFR2抑制剂联用可以达到多靶点抗肿瘤、增加治疗效果以及在肿瘤细胞发生T790M耐药突变后[21-22]发挥协同抗肿瘤作用。Li等[23]研究了阿帕替尼与吉非替尼联用对获得性耐药的细胞系H1975、肿瘤移植(H1975)动物模型以及EGFR-TKI耐药患者(n=16)的作用。结果发现两药联用在体内外均有协同作用,EGFR-TKI耐药患者联用阿帕替尼和吉非替尼后PFS可达4.60月(95%CI: 2.23~12.52月),临床效果优于吉非替尼单药组。Xu等[24]研究了27例经埃克替尼治疗失败后的晚期非小细胞肺癌(NSCLC)患者,采用埃克替尼联合阿帕替(500 mg/d)进行治疗,治疗至疾病发生进展,实验结束。联合治疗的PFS中位数为5.33月,疾病控制率(DCR)为81.5%,其中共14例患者采用联合治疗作为二线治疗,ORR和DCR分别为7.1%和78.6%。此外16例患者在6月后出现进展,中位生存期为2.6月。常见不良反应为高血压(44.4%)以及疲劳(37.0%),结果表明阿帕替尼联合埃克替尼治疗经埃克替尼治疗失败后的晚期非小细胞肺癌,疗效肯定且不良反应可接受。
2.2 阿帕替尼与VEGF抑制剂联用贝伐珠单抗的作用靶点为血管内皮生长因子(VEGF),可以阻断血管生成的通路;阿帕替尼作用于VEGF的受体VEGFR2,同样阻断血管生成的通路。贝伐珠单抗与阿帕替尼联用可以发挥双重抗血管生成的作用。刘建等[25]研究了60例结直肠癌患者,将其随机平均分为对照组(阿帕替尼单药)和试验组(贝伐珠单抗联合阿帕替尼)。治疗后,试验组总有效率93.33%明显高于对照组76.67%(P < 0.05);试验组患者无进展生存期7.51月、总生存期12.92月和生存质量评分62.41分,均明显高于对照组4.41月、9.12月和55.56分(P < 0.05)。此外,实验组患者不良反应总发生率为13.33%,低于对照组43.33%(P < 0.05)。结果表明贝伐珠单抗联合阿帕替尼治疗结直肠癌的临床疗效显著,并且不良反应较低,可以有效地提高病患的生存质量。
2.3 阿帕替尼与HER2抑制剂联用曲妥珠单抗是抗人类表皮生长因子受体2(HER2)的单克隆抗体,临床应用于晚期转移乳腺癌的治疗。曲妥珠单抗与VEGFR2抑制剂阿帕替尼联用可以同时发挥抑制血管和抑制表皮生成的双重作用。有个例报道显示接受曲妥珠单抗治疗后效果不明显的晚期胃癌患者,在原方案治疗基础上增加阿帕替尼联合用药时,患者的靶病灶显著缩小,并且无明显的不良反应。实验结果证明对于晚期胃癌患者阿帕替尼联合曲妥珠单抗的治疗效果更优[26],值得进行下一步研究。
2.4 阿帕替尼与c-Met抑制剂联用沃利替尼为肝细胞生长因子受体(c-Met)抑制剂,抑制由于c-Met通路的激活所引发的肿瘤侵袭与转移,抗血管生成药物与其联用可以减少由于抑制血管生成造成肿瘤内部缺氧从而导致的缺氧间充质的侵袭,增加抗血管生成药物的抗肿瘤效果[27]。Chen等[28]建立了异种移植结直肠癌的动物模型,通过体内实验发现阿帕替尼与c-Met抑制剂沃利替尼联合应用可以显著抑制由于c-Met高表达导致的肿瘤增殖,证明阿帕替尼与沃利替尼联合应用可以发挥较好的抗肿瘤效果。
3 阿帕替尼与放疗联用立体定向放射治疗(SBRT)可以在靶区形成高剂量区而在周围组织中剂量急剧下降,从而保护周围组织,起到靶向治疗的效果[29]。单一的放疗可能会引起肿瘤的耐药性[30],放射治疗或SBRT与阿帕替尼联合应用可以发挥协同作用,增强抗肿瘤疗效[31]。赵凤等[32]选择前列腺癌骨转移受试者29例,分为试验组19例及对照组10例,分别给予250 mg阿帕替尼联合或不联合SBRT(剂量为6 Gy/次,共计5次)治疗。结果试验组平均疼痛评分变化优于对照组;试验组患者出现前列腺特异抗原(PSA)下降50%以上者多于对照组,两组PSA下降持续时间均可达2~6月;放疗并未增加3级不良反应的发生,说明服用250 mg阿帕替尼联合SBRT可协同控制前列腺癌骨转移患者的病情及癌痛,不良反应可耐受,可进行大样本试验验证。
4 阿帕替尼与中药方剂联用目前已有大量研究证实以中西医结合治疗为主的综合治疗模式多具有“减毒增效”的特点,可以提高患者生存质量改善临床症状,并缓解西药所产生的不良反应。虽然中药抗肿瘤的机制目前并未研究透彻,但阿帕替尼与中药方剂联合使用往往可以改善晚期患者的生存质量。
4.1 阿帕替尼联合黄芪多糖Wu等[33]研究了黄芪多糖联合阿帕替尼在胃癌AGS细胞中的抗肿瘤作用。结果证明阿帕替尼和黄芪多糖能剂量依赖性地显著抑制AGS细胞的增殖,与阿帕替尼单药相比,联合黄芪多糖对细胞增殖、迁移和侵袭显示出增强抑制效应。此外,经阿帕替尼治疗后细胞凋亡能被黄芪多糖增强。此外,Wu等[34]还研究了阿帕替尼联合黄氏多糖对于人胰腺癌的相关实验,结果表明联合应用可以促进细胞凋亡,阿帕替尼可以抑制胰腺癌细胞的增殖,并且黄氏多糖的应用可以下调AKT、ERK以及MMP-9的磷酸化,可以更好地抑制肿瘤的生长。
4.2 阿帕替尼联合肿节风宋朝阳[35]回顾性分析了46例晚期胃癌患者的临床资料,根据治疗方案的差别分成对照组(阿帕替尼单药每次850 mg,1次/天)和治疗组(在阿帕替尼的基础上静脉滴注肿节风每次4 ml,1次/天)。两组患者均治疗4周,治疗结束后对照组客观缓解率和临床获益率分别为39.13%、47.83%,均显著低于治疗组的65.22%和78.26%。肿节风注射液联合阿帕替尼治疗晚期胃癌的临床效果显著,具有一定的临床推广应用价值。
4.3 阿帕替尼联合消岩汤加减方李小江等[36]选取晚期非鳞NSCLC患者38例,随机将其中的18例分为阿帕替尼治疗组,另外20例分为阿帕替尼联合消岩汤加减方治疗组。两组治疗期间均未行手术及放、化疗。治疗结果显示,虽然阿帕替尼联合消岩汤组的中位无进展生存期、客观缓解率及疾病控制率较阿帕替尼单药组差异无统计学意义(P > 0.05),但在改善临床症状及不良反应方面阿帕替尼联合消岩汤均优于阿帕替尼单药组。
5 阿帕替尼与免疫治疗联用默克公司的Pembrolizumab(商品名为Keytruda)是一种PD-1抑制剂,可以与PD-1高特异性结合,选择性阻断PD-1与其配体PD-L1和PD-L2的结合,增强T细胞繁殖、生存、杀伤活性而达到肿瘤免疫治疗的效果。由美国国立卫生研究院报道的目前正在开展的九项关于阿帕替尼联合PD-1抑制剂的临床试验(https://www.clinicaltrials.gov/ct2/results?cond=&term=apatinib+PD-1&cntry=&state=&city=&dist=),其中一项Ⅱ期临床试验(编号NCT03394287)入组了58名晚期三阴乳腺癌患者,应用阿帕替尼联合PD-1抑制剂SHR-1210进行联合治疗并在实验结束后进行治疗效果评价(https://www.clinicaltrials.gov/ct2/results?recrs=&cond=&term=NCT03394287&cntry=&state=&city=&dist=)。
多靶点抗原肽自体免疫细胞治疗(multiple antigens specific cell therapy, MASCT)是通过激活和增强机体免疫力发挥疗效的一种生物治疗方法。一项编号NCT02844881的临床试验研究了阿帕替尼联合自体免疫治疗用于治疗晚期实质性肿瘤的临床效果(https://www.clinicaltrials.gov/ct2/show/NCT02844881?term=MASCT+apatinib&rank=1)。此外乔云等[37]报道6例经手术、放化疗治疗失败的肉瘤患者。其中4例患者至少接受3周期的MASCT治疗,同时每天给予阿帕替尼500 mg。另外2例单独服用阿帕替尼最作为对照。直至实验结束,联合治疗患者中有1例肿瘤完全缓解,3例为部分缓解;另2例单独使用阿帕替尼的患者1例疾病稳定,1例疾病进展,PFS分别为1、2月。结果显示阿帕替尼与MASCT联合应用延长了病患的生存期,改善了患者生存质量。虽然阿帕替尼与免疫治疗的联用在临床上的相关报道很少,但已报道的临床案例显示阿帕替尼这种血管生成抑制剂与免疫治疗的联合应用可能会是肿瘤治疗的新方向。
6 总结阿帕替尼与不同类型的抗肿瘤药物或方法联合应用通过不同的机制发挥着相似的作用:使复发或发生转移的晚期肿瘤患者肿瘤灶变小甚至消失,有效提高患者的生活质量,延长患者的生存期,同时双药联用的不良反应在可控范围之内,也扩大了阿帕替尼的适用范围。与化疗药物联用能够减少耐药性、增强药效;与EGFP酪氨酸激酶抑制剂等靶向药物联用可以对肿瘤细胞的生长通路采取双重抑制,更好地阻断肿瘤细胞的生长;与中药制剂联合应用往往可以增加药效,并且有效改善晚期肿瘤患者的生存质量;与免疫疗法联用可以发挥两者的优势,取长补短。同时基于其惠民的价格也使得阿帕替尼成为越来越多患者的首选。如何利用分子靶向药物的优势,合理地联合用药,达到增效减毒的效果;以及联合用药达到更优效果背后的机制将成为分子靶向药物未来研究的方向。目前阿帕替尼在全球的抗肿瘤临床试验达到216项(https://www.clinicaltrials.gov/ct2/results/map?cond=tumor&term=Apatinib&cntry=&state=&city=&dist=&Search=Search),其中涉及联合治疗的就有85项,其中大部分是在中国进行的(https://www.clinicaltrials.gov/ct2/results/map/click?map.x=794&map.y=224&term=Apatinib+combination+therapy&mapw=1419),有望在未来的抗肿瘤实践中真正成为利器。
作者贡献
武姗:撰写文章
花瞻:从临床角度提供建议
李建晨:从药物的角度提供建议
王在、周建军:文章的构思以及修改
| [1] | Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102(7): 1374–80. DOI:10.1111/cas.2011.102.issue-7 |
| [2] | Hu X, Cao J, Hu W, et al. Multicenter phase Ⅱ study of apatinib in non-triple-negative metastatic breast cancer[J]. BMC Cancer, 2014, 14: 820. DOI:10.1186/1471-2407-14-820 |
| [3] | Aoyama T, Yoshikawa T. Targeted therapy:Apatinib-new third-line option for refractory gastric or GEJ cancer[J]. Nat Rev Clin Oncol, 2016, 13(5): 268–70. DOI:10.1038/nrclinonc.2016.53 |
| [4] | Li J, Qin S, Xu J, et al. Randomized, Double-Blind, Placebo-Controlled Phase Ⅲ Trial of Apatinib in Patients with Chemotherapy-Refractory Advanced or Metastatic Adenocarcinoma of the Stomach or Gastroesophageal Junction[J]. J Clin Oncol, 2016, 34(13): 1448–54. DOI:10.1200/JCO.2015.63.5995 |
| [5] | Liu Z, Ou W, Li N, et al. Apatinib monotherapy for advanced non-small cell lung cancer after the failure of chemotherapy or other targeted therapy[J]. Thorac Cancer, 2018, 9(10): 1285–90. DOI:10.1111/tca.2018.9.issue-10 |
| [6] | Bosanquet AG, Richards SM, Wade R, et al. Drug cross-resistance and therapy-induced resistance in chronic lymphocytic leukaemia by an enhanced method of individualised tumour response testing[J]. Br J Haematol, 2009, 146(4): 384–95. DOI:10.1111/bjh.2009.146.issue-4 |
| [7] | Pérez-Tomás R. Multidrug resistance:retrospect and prospects in anti-cancer drug treatment[J]. Curr Med Chem, 2006, 13(16): 1859–76. DOI:10.2174/092986706777585077 |
| [8] | Dean M, Hamon Y, Chimini G. The human ATP-binding cassette (ABC) transporter superfamily[J]. J Lipid Res, 2001, 42(7): 1007–17. |
| [9] | Mi YJ, Liang YJ, Huang HB, et al. Apatinib (YN968D1) reverses multidrug resistance by inhibiting the efflux function of multiple ATP-binding cassette transporters[J]. Cancer Res, 2010, 70(20): 7981–91. DOI:10.1158/0008-5472.CAN-10-0111 |
| [10] | Cheng H, Sun A, Guo Q, et al. Efficacy and safety of apatinib combined with chemotherapy for the treatment of advanced gastric cancer in the Chinese population:a systematic review and meta-analysis[J]. Drug Des Devel Ther, 2018, 12: 2173–83. DOI:10.2147/DDDT |
| [11] | Han T, Luan Y, Xu Y, et al. Successful treatment of advanced pancreatic liposarcoma with apatinib:A case report and literature review[J]. Cancer Biol Ther, 2017, 18(9): 635–9. DOI:10.1080/15384047.2017.1345394 |
| [12] | Xia P, Cao J, Lv X, et al. Combination therapy of apatinib with icotinib for primary acquired icotinib resistance in patients with advanced pulmonary adenocarcinoma with EGFR mutation[J]. Thorac Cancer, 2018, 9(5): 656–61. DOI:10.1111/tca.2018.9.issue-5 |
| [13] | 杨涛, 李一辉. 甲磺酸阿帕替尼片治疗晚期非小细胞肺癌的临床效果评价[J]. 中国社区医师, 2018, 34(7): 80–1. [ Yang T, Li YH. Evaluation on the clinical effect of apatinib mesylate tablets in the treatment of advanced non-small cell lung cancer[J]. Zhongguo She Qu Yi Shi, 2018, 34(7): 80–1. DOI:10.3969/j.issn.1007-614x.2018.7.49 ] |
| [14] | Tong XZ, Wang F, Liang S, et al. Apatinib (YN968D1) enhances the efficacy of conventional chemotherapeutical drugs in side population cells and ABCB1-overexpressing leukemia cells[J]. Biochem Pharmacol, 2012, 83(5): 586–97. DOI:10.1016/j.bcp.2011.12.007 |
| [15] | 赵攀攀, 邱海峰, 苑中甫, 等. 阿帕替尼与脂质体阿霉素联合治疗复发性卵巢癌的短期疗效和安全性[J]. 现代妇产科进展, 2017, 26(12): 921–3. [ Zhao PP, Qiu HF, Yuan ZP, et al. Short-term efficacy and safety of apatinib in combination with liposomal doxorubicin in the treatment of recurrent ovarian cancer[J]. Xian Dai Fu Chan Ke Jin Zhan, 2017, 26(12): 921–3. ] |
| [16] | Lan CY, Wang Y, Xiong Y, et al. Apatinib combined with oral etoposide in patients with platinum-resistant or platinum-refractory ovarian cancer (AEROC):a phase 2, single-arm, prospective study[J]. Lancet Oncol, 2018, 19(9): 1239–46. DOI:10.1016/S1470-2045(18)30349-8 |
| [17] | 阮寒光, 王红, 董俊林, 等. 甲磺酸阿帕替尼联合替吉奥治疗晚期胃癌的疗效及影响因素分析[J]. 现代医药卫生, 2017, 33(19): 2932–6. [ Ruan HG, Wang H, Dong JJ, et al. Analysis on efficacy and influencing factors of apatinib mesylate combined with S-1 for treatment of advanced gastric cancer[J]. Xian Dai Yi Yao Wei Sheng, 2017, 33(19): 2932–6. DOI:10.3969/j.issn.1009-5519.2017.19.013 ] |
| [18] | 杨欣怡, 李宁, 邓文英, 等. 阿帕替尼联合替吉奥与阿帕替尼二线治疗晚期胃癌的临床疗效比较[J]. 肿瘤基础与临床, 2017, 30(6): 483–6. [ Yang XY, Ling N, Deng WY, et al. Clinical comparision of apatinib combined with S-1 and apatinib in the second line treatment of patients with advance gastric cancer[J]. Zhong Liu Ji Chu Yu Lin Chuang, 2017, 30(6): 483–6. DOI:10.3969/j.issn.1673-5412.2017.06.007 ] |
| [19] | Lu W, Jin XL, Yang C, et al. Comparison of efficacy between TACE combined with apatinib and TACE alone in the treatment of intermediate and advanced hepatocellular carcinoma:A single-center randomized controlled trial[J]. Cancer Biol Ther, 2017, 18(6): 433–8. DOI:10.1080/15384047.2017.1323589 |
| [20] | Liu C, Xing W, Si T, et al. Efficacy and safety of apatinib combined with transarterial chemoembolization for hepatocellular carcinoma with portal venous tumor thrombus:a retrospective study[J]. Oncotarget, 2017, 8(59): 100734–45. DOI:10.18632/oncotarget.20140 |
| [21] | Thress KS, Paweletz CP, Felip E, et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M[J]. Nat Med, 2015, 21(6): 560–2. DOI:10.1038/nm.3854 |
| [22] | Planchard D, Loriot Y, Andre F, et al. EGFR-independent mechanisms of acquired resistance to AZD9291 in EGFR T790M-positive NSCLC patients[J]. Ann Oncol, 2015, 26(10): 2073–8. DOI:10.1093/annonc/mdv319 |
| [23] | Li F, Zhu T, Cao B, et al. Apatinib enhances antitumour activity of EGFR-TKIs in non-small cell lung cancer with EGFR-TKI resistance[J]. Eur J Cancer, 2017, 84: 184–92. DOI:10.1016/j.ejca.2017.07.037 |
| [24] | Xu J, Liu X, Yang S, et al. Apatinib plus icotinib in treating advanced non-small cell lung cancer after icotinib treatment failure:a retrospective study[J]. Onco Targets Ther, 2017, 10: 4989–95. DOI:10.2147/OTT |
| [25] | 刘建, 李颖, 温福刚. 贝伐珠单抗联合阿帕替尼治疗结直肠癌的疗效分析[J]. 中国实用医药, 2017, 12(12): 136–7. [ Liu J, Li Y, Wen FG. Efficacy analysis of bevacizumab combined with apatinib in the treatment of colorectal cancer[J]. Zhongguo Shi Yong Yi Yao, 2017, 12(12): 136–7. ] |
| [26] | 李加桩, 隋红, 郑红艳, 等. 阿帕替尼联合曲妥珠单抗治疗晚期胃癌1例[J]. 临床肿瘤学杂志, 2016, 21(11): 1054–6. [ Li JZ, Sui H, Zheng HY, et al. Apatinib combined with trastuzumab in the treatment of advanced gastric cancer:a case report[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2016, 21(11): 1054–6. ] |
| [27] | Lu KV, Chang JP, Parachoniak CA, et al. VEGF inhibits tumor cell invasion and mesenchymal transition through a MET/VEGFR2 complex[J]. Cancer Cell, 2012, 22(1): 21–35. |
| [28] | Chen X, Guan Z, Lu J, et al. Synergistic antitumor effects of cMet inhibitor in combination with anti-VEGF in colorectal cancer patient-derived xenograft models[J]. J Cancer, 2018, 9(7): 1207–17. DOI:10.7150/jca.20964 |
| [29] | Salazar OM, Sandhu T, da Motta NW, et al. Fractionated half-body irradiation (HBI) for the rapid palliation of widespread, symptomatic, metastatic bone disease:a randomized Phase Ⅲtrial of the International Atomic Energy Agency (IAEA)[J]. Int J Radiat Oncol Biol Phys, 2001, 50(3): 765–75. DOI:10.1016/S0360-3016(01)01495-X |
| [30] | Barker HE, Paget JT, Khan AA, et al. The tumour microenvironment after radiotherapy:mechanisms of resistance and recurrence[J]. Nat Rev Cancer, 2015, 15(7): 409–25. DOI:10.1038/nrc3958 |
| [31] | Carmeliet P, Jain RK. Principles and mechanisms of vessel normalization for cancer and other angiogenic diseases[J]. Nat Rev Drug Discov, 2011, 10(6): 417–27. DOI:10.1038/nrd3455 |
| [32] | 赵凤, 田伟, 曾铭, 等. 阿帕替尼联合立体定向放射治疗用于前列腺癌骨转移治疗的研究[J]. 实用医院临床杂志, 2017, 14(4): 15–8. [ Zhao F, Tian W, Zeng M, et al. Application of apatinib combined with radiotherapy in the treatment of prostate cancer with bone metastasis[J]. Shi Yong Yi Yuan Lin Chuang Za Zhi, 2017, 14(4): 15–8. DOI:10.3969/j.issn.1672-6170.2017.04.004 ] |
| [33] | Wu J, Yu J, Wang J, et al. Astragalus polysaccharide enhanced antitumor effects of Apatinib in gastric cancer AGS cells by inhibiting AKT signalling pathway[J]. Biomed Pharmacother, 2018, 100: 176–83. DOI:10.1016/j.biopha.2018.01.140 |
| [34] | Wu J, Wang J, Su Q, et al. Traditional Chinese medicine Astragalus polysaccharide enhanced antitumor effects of the angiogenesis inhibitor apatinib in pancreatic cancer cells on proliferation, invasiveness, and apoptosis[J]. Onco Targets Ther, 2018, 11: 2685–98. DOI:10.2147/OTT |
| [35] | 宋朝阳. 肿节风注射液联合阿帕替尼治疗晚期胃癌的临床研究[J]. 现代药物与临床, 2017, 32(6): 1114–7. [ Song CY. Clinical study on Zhongjiefeng injiection combined with apatinib in treatment of advanced gastric cancer[J]. Xian Dai Yao Wu Yu Lin Chuang, 2017, 32(6): 1114–7. ] |
| [36] | 李小江, 姜珊, 郭姗琦, 等. 阿帕替尼联合消岩汤治疗晚期非鳞非小细胞肺癌临床疗效观察[J]. 中国肿瘤临床, 2017, 44(14): 701–5. [ Li XJ, Jiang S, Guo SQ, et al. Clinical research on apatinib combined with Xiaoyan decoction for the treatment of non-squamous non-small cell lung cancer[J]. Zhongguo Zhong Liu Lin Chuang, 2017, 44(14): 701–5. DOI:10.3969/j.issn.1000-8179.2017.14.609 ] |
| [37] | 乔云, 惠开元, 任岩, 等. 甲磺酸阿帕替尼联合多靶点抗原肽自体免疫细胞治疗骨与软组织肉瘤的临床实践(小样本报道)[J]. 中国免疫学杂志, 2017, 33(1): 114–9. [ Qiao Y, Hui KY, Reng Y, et al. Clinical research on apatinib mesylate combined with multiple antigens specific cell therapy in treatment of osteosarcoma and soft tissue sarcoma (small sample report)[J]. Zhongguo Mian Yi Xue Za Zhi, 2017, 33(1): 114–9. DOI:10.3969/j.issn.1000-484X.2017.01.024 ] |
 2019, Vol. 46
2019, Vol. 46


