文章信息
- miR-135a-5p、GATA3和STAT3在宫颈癌中的表达及其相关性
- Expression and Correlation of miR-135a-5p, GATA3 and STAT3 in Cervical Cancer
- 肿瘤防治研究, 2019, 46(4): 338-344
- Cancer Research on Prevention and Treatment, 2019, 46(4): 338-344
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1040
- 收稿日期: 2018-08-22
- 修回日期: 2018-11-29
2. 063210 唐山,华北理工大学公共卫生学院;
3. 063210 唐山,华北理工大学冀唐学院医学实验中心;
4. 063000 唐山,唐山工人医院妇二科
2. Public Health School of North China University of Science and Technology, Tangshan 063210, China;
3. Medical Experiment Center Jitang College of North China University of Science and Technology, Tangshan 063210, China;
4. Department of Obstetrics and Gynecology, Tangshan Gongren Hospital, Tangshan 063000, China
近年来宫颈癌的发病趋于年轻化,放化疗及靶向药物治疗预后仍有约30%的患者出现局部复发或转移[1]。由于宫颈癌的发病机制不明确,因此宫颈癌的个体化治疗仍难以实现。近年有研究发现非编码微小RNA(MicroRNA, miRNA)与宫颈癌细胞凋亡、增殖、侵袭和血管生成等生物学过程密切相关,被认为是宫颈癌诊断、治疗和预后评估的新靶点[2]。miR-135a-5p参与多种恶性肿瘤的发生、发展[3-5],但其在宫颈癌中的研究未见报道。
GATA结合蛋白(GATA)3是GATA转录因子家族(GATA1~6)中的一员,它们以高亲和力结合于共同序列(A/T)GATA(A/G),共有一个类固醇激素受体超家族的C4锌指结构DNA结合序列,定位于染色体10p15。生物信息学分析显示miR-135a-5p与GATA3 3’非翻译区(UTR)有结合位点,提示miR-135a-5p可能通过靶向调节GATA3的转录活性而发挥作用。
信号转导与转录激活因子(STAT)3是STAT家族中的一员,其在许多细胞进程包括细胞生长、凋亡及癌变中起到关键作用。最新研究报道GATA3在某些辅助因子的协同作用下直接作用于STAT3的启动子区从而抑制其转录活性[6]。因此推测miR-135a-5p、GATA3及STAT3三者之间可能通过某种作用机制共同参与了宫颈癌的发生及发展。本研究旨在检测分析不同病理类型宫颈组织及细胞系中miR-135a-5p、GATA3及STAT3的表达变化及相互关系,以期为宫颈癌的靶向治疗提供实验依据。
1 资料与方法 1.1 研究对象选取2014年9月—2017年9月唐山市工人医院收治的155例宫颈手术标本,包括宫颈上皮内瘤变(CIN组)81例,其中CINⅠ组39例,平均年龄为(44.5±3.1)岁; CINⅡ~Ⅲ组42例,年龄(43.7±6.2)岁; 宫颈鳞癌(cervical squamous cell carcinoma, CSCC)37例为宫颈癌组(CSCC组),年龄(45.3±4.2)岁; 选取同期因良性子宫疾病行全子宫切除术的患者37例为正常对照组,年龄(46.7±2.6)岁。四组患者年龄比较,差异无统计学意义(F=0.168, P > 0.706)。CIN组及CSCC组纳入标准:(1)临床资料完整; (2)病理明确诊断为CINⅠ、CINⅡ~Ⅲ或宫颈鳞癌; (3)术前未接受过放、化疗。排除标准:(1)术前3月内曾行宫颈治疗,如阴道用药、激光治疗等; (2)患者为妊娠状态; (3)同时合并其他妇科恶性肿瘤,如子宫内膜癌、卵巢癌等; (4)同时合并其他脏器肿瘤,如肠道、乳腺肿瘤等。正常对照组纳入标准:(1)因子宫良性疾病行全子宫切除术者; (2)宫颈薄层液基细胞学检查未见非典型鳞状细胞或癌细胞。排除标准与CIN组及CSCC组相同。所有标本均经本院病理科主任医师证实,且取材前均未行放、化疗或免疫治疗。标本收集后于本院中心实验室-80℃冰箱保存。CSCC组(37例)患者按国际妇产科联盟(FIGO)2009年的标准进行临床分期:Ⅰ期27例,Ⅱa期10例; 病理分级按2003年WHO标准分为:高分化26例,中低分化11例。本研究经唐山工人医院伦理委员会批准(批准号:15070),所有患者均知情同意。
1.2 研究方法 1.2.1 体外细胞培养正常人宫颈上皮细胞(HcerEpic)和人宫颈癌细胞株HeLa、SiHa细胞均由河北医科大学附属第四医院肿瘤研究所馈赠,分别以含10%胎牛血清RPMI1640培养基、5%CO2、37℃恒温培养箱中常规培养,细胞密度为4×104/L,取对数生长期细胞用于实验。HEK-293A细胞由河北医科大学附属第四医院肿瘤研究所馈赠,高糖伯克改良伊格尔培养基+10%胎牛血清,5%CO2、37℃恒温培养箱中培养。
1.2.2 主要试剂TRIzol试剂盒、反转录试剂盒、Real-time PCR反应试剂盒及Lipofectamine 2000试剂盒均购自美国Invitrogen公司; PCR引物由北京赛百盛基因技术有限公司合成; 鼠抗人GATA3单克隆抗体、鼠抗人STAT3单克隆抗体购自美国Santa Cruz公司,兔抗鼠IgG抗体及鼠抗人β-肌动蛋白抗体购自武汉谷歌生物技术有限公司; Dual-luciferase Assay System购自美国Promega公司。
1.2.3 实时定量RT-PCR检测不同宫颈组织及宫颈癌细胞系中miR-135a-5p、GATA3和STAT3 mRNA的表达水平[7-9]将液氮保存的宫颈组织按照TRIzol试剂盒说明书提取总RNA,以RNA为模板,采用反转录试剂盒进行反转录。miR-135a-5p茎环结构:5’-GCCTATGGCTTTTTATTCCTATGT-3’。反转录条件:16℃ 30 min,42℃ 30 min,75℃ 15 min。反转录结束后进行PCR扩增。PCR反应体系按试剂盒说明配制。具体引物序列:miR-135a-5p-F:5’-TTGGTCTTGTTTCCCGGTCC-3’; miR-135a-5p-R:5’-TCACAGCTCCACAGGCTAAC-3’; GATA3-F:5’-AAGGCATCCAGACCAGAAACCG-3’; GATA3-R:5’-AGCATCGAGCAGGGCTCTAACC-3’; STAT3-F:5’-AAGAGGCGGCAACAGATT-3’; STAT3-R:5’-CGGTCTTGATGCCGAGGG-3;U6-F:5’-CTCGCTTCGGCAGCACA-3’; U6-R:5’-AACGCTTCACGAATTTGCGT-3’; GAPDH-F:5’-GAAAGCCTGCCGGTGACTAA-3’; GAPDH-R:5’-AGGAAAAGCATCACCCGGAG-3’。PCR扩增的反应条件为:95℃ 2 min,95℃ 15 s,72℃ 35 s共35个循环,记录循环阈值(Ct),采用2-ΔΔCt法计算miR-135a-5p、GATA3和STAT3 mRNA的相对表达量。每组实验重复3次。miR-135a-5p以U6为内参基因; GATA3和STAT3 mRNA以GAPDH为内参基因。
1.2.4 免疫组织化学SP法分析不同宫颈组织中GATA3和STAT3的表达水平用4%多聚甲醛固定四组宫颈组织24 h,常规石蜡包埋,4 μm厚切片,将切片放置在PCI系列正电荷处理过的黏附载玻片上。样本放置65℃恒温烤箱内干燥处理3 h。经二甲苯脱蜡、梯度乙醇洗涤水化,pH=6的枸橼酸盐高压修复之后,用3%、pH值为7.2~7.4的过氧化氢甲醇溶液灭活内源性过氧化物酶10 min,再分别用山羊血清和兔血清封闭非特异性抗原,加入其对应一抗(鼠抗人GATA3抗体,1:50稀释; 鼠抗人STAT3,1:100稀释),4℃孵育过夜后,再加入各自的二抗,经二氨基联苯胺(DAB)显色,苏木精对比染色,梯度乙醇及二甲苯脱水,中性树胶封片。正置尼康显微镜下观察、拍照(最大倍数×400)。结果判定标准:以细胞核出现棕色染色者为阳性细胞。高倍镜(×400)下随机选取5个不同视野,依照阳性细胞所占百分比及染色强度进行评分。阳性细胞所占百分比评分:< 5%为0分,5%~25%为1分,≥25%~50%为2分,≥50%~80%为3分,≥80%为4分; 染色强度评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分,以两种评分的5个视野平均分相乘作为该标本的最终得分; 最终得分0分为阴性(-),1~4分为弱阳性(+),5~8分为中等阳性(++),9~12分为强阳性(+++),以-~+为阴性表达,++~+++为阳性表达,计算阳性表达率。
1.2.5 Western blot检测宫颈细胞系中GATA3和STAT3蛋白的表达以鼠抗人GATA3单克隆抗体(稀释浓度1:500)、鼠抗人STAT3单克隆抗体(稀释浓度1:500)和辣根过氧化物酶(HRP)标记的兔抗鼠IgG抗体(稀释浓度1:1 000)分别室温温育2 h; 鼠抗人β-肌动蛋白抗体(稀释浓度1:1 000)和HRP标记的兔抗鼠IgG抗体(稀释浓度1:2 000)室温温育2 h,DAB显色。采用Image J凝胶图像处理系统分析计算光带的吸光度值,以目标蛋白条带灰度值/内参条带灰度值来表示目的基因相对蛋白表达水平。
1.2.6 细胞转染在HeLa细胞中转染miR-135a-5p mimic及阴性对照mimic Negative Control(miR-NC),转染使用Lipofectamine 2000试剂盒,步骤按照产品说明书进行。
1.2.7 双荧光素酶报告基因分析miR-135a-5p与GATA3 3’UTR的相互作用构建GATA3 3’UTR报告载体3’UTR-WT(序列:5’-ACCCCAUCUGUGAAUAAGCCAUU-3’),及突变型报告载体3’UTR-MT(突变序列:5’-ACCCCAUCUGUUGGUAAGCCAUU-3’),将miR-135a-5p mimic和miR-NC共转染入HEK-293A细胞,使用Dual-luciferase assay system检测转染后荧光素酶活性。
1.3 统计学方法应用SPSS17.0软件进行数据分析,计数资料组间比较采用χ2检验; 计量资料经正态性检验符合正态分布,以(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用q检验; 采用Pearson相关系数分析进行相关性分析。P < 0.05为差异有统计学意义。
2 结果 2.1 宫颈癌组织和细胞中miR-135a-5p的表达情况实时定量RT-PCR结果显示:miR-135a-5p在宫颈癌组中表达上调,两组比较差异有统计学意义(P=0.03),见图 1A。同时检测HcerEpic、HeLa、SiHa细胞系中miR-135a-5p的相对表达水平,结果显示:与HcerEpic组相比,HeLa和SiHa细胞中miR-135a-5p表达上调(P=0.02),见图 1B。
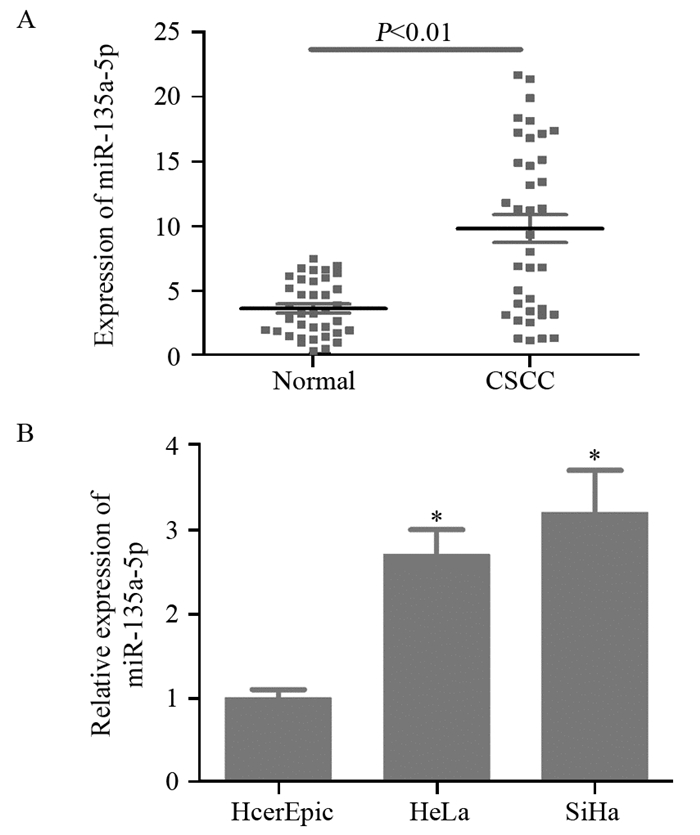
|
| Normal: normal cervical tissues; CSCC: cervical squamous cell carcinoma; *: P < 0.05, compared with HcerEpic group 图 1 实时定量RT-PCR法检测miR-135a-5p在宫颈癌组织(A)和不同宫颈细胞(B)中的表达 Figure 1 Expression of miR-135a-5p in cervical cancer tissues(A) and defferent cervical cell lines(B) detected by RT-PCR |
实时定量RT-PCR检测结果显示:GATA3 mRNA在正常对照组、CINⅠ组、CINⅡ~Ⅲ组、CSCC组的表达量分别为:5.53±1.18、6.42±1.26、1.21±0.54、0.63±0.26,正常对照组与CINⅠ组比较差异无统计学意义(P > 0.05),其余三组比较差异均有统计学意义(F=38.21, P < 0.05)。正常对照组、CINⅠ组、CINⅡ~Ⅲ组、CSCC组STAT3 mRNA表达量分别为:0.62±0.21、0.95±0.33、2.74±0.65、4.26±0.76,四组比较差异有统计学意义(F=42.06, P < 0.05),见图 2。
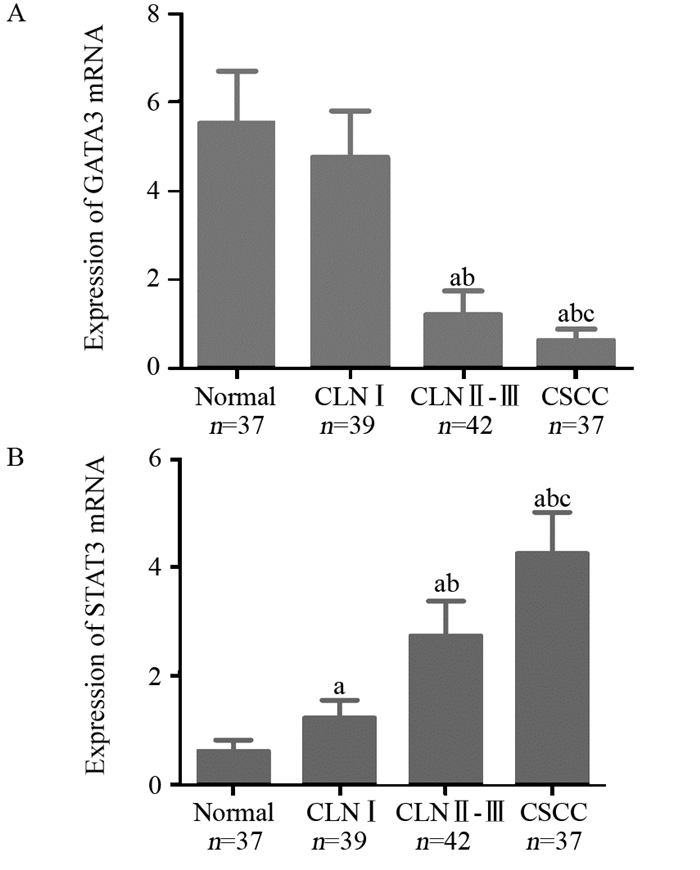
|
| a: P < 0.05, compared with normal group; b: P < 0.05, compared with CINⅠgroup; c: P < 0.05, compared with CINⅡ-Ⅲgroup 图 2 实时定量RT-PCR检测四组宫颈组织中GATA3(A)、STAT3(B) mRNA表达 Figure 2 Expression of GATA3(A) and STAT3(B) mRNA in different cervical tissues detected by RT-PCR |
进一步行免疫组织化学结果显示:GATA3蛋白的阳性表达主要定位于细胞核,阳性细胞多位于基底层及副基底层细胞中。在正常对照组及CINⅠ组中,GATA3阳性表达的细胞较多,随着宫颈病变进展,CINⅡ~Ⅲ组中GATA3阳性表达的细胞数明显减少,而在CSCC组中几乎未见GATA3表达,见图 3;GATA3阳性表达率分别为:正常对照组86.5%(32/37)、CINⅠ组89.7%(35/39)、CINⅡ~Ⅲ组9.5%(4/42)、CSCC组2.7%(1/37),四组间分别比较:正常对照组与CINⅠ组相比差异无统计学意义(P > 0.05),其余各组间两两比较,差异均有统计学意义(均P < 0.05)。STAT3蛋白阳性表达为细胞质中出现不同染色程度的棕黄色颗粒,少数位于细胞核,与GATA3表达情况相反,随着宫颈病变的进展,STAT3阳性表达的细胞数目增多,见图 4;STAT3阳性表达率分别为:正常对照组5.4%(2/37)、CINⅠ组12.8%(5/39)、CINⅡ~Ⅲ组71.4%(30/42)、CSCC组91.9%(34/37),四组间分别比较,差异均有统计学意义(均P < 0.05)。
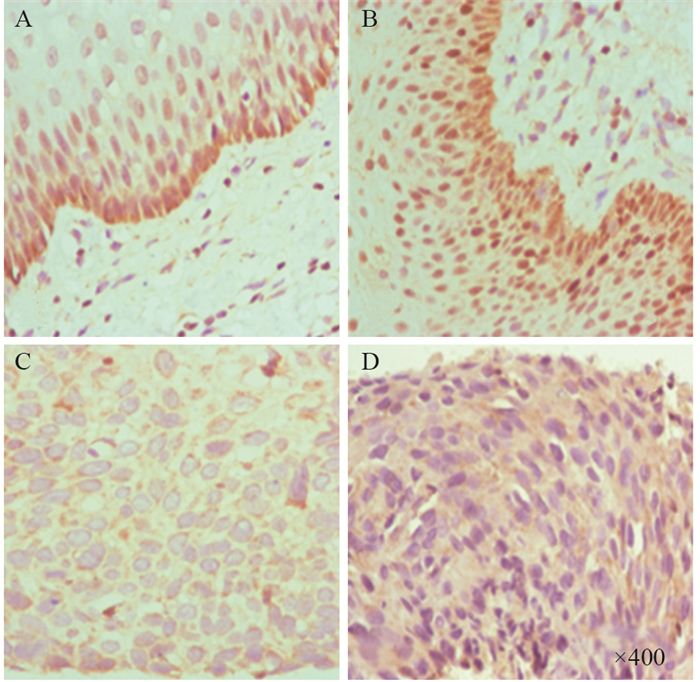
|
| A: normal cervical group; B: cervical intraepithelial neoplasia(CIN)Ⅰgroup; C: cervical intraepithelial neoplasia(CIN)Ⅱ-Ⅲ group; D:cervical squamous cell carcinoma(CSCC) group 图 3 免疫组织化学显示GATA3在不同病理类型宫颈组织中的表达 Figure 3 Expression of GATA3 protein in different pathological types of cervical tissues detected by immunohistochemistry method |

|
| A: normal cervical group; B: cervical intraepithelial neoplasia(CIN)Ⅰgroup; C: cervical intraepithelial neoplasia(CIN)Ⅱ-Ⅲ group; D:cervical squamous cell carcinoma(CSCC) group 图 4 免疫组织化学显示STAT3在不同病理类型宫颈组织中的表达 Figure 4 Expression of STAT3 protein in different pathological types of cervical tissues detected by immunohistochemistry method |
Western blot结果显示:与HcerEpic比较,GATA3条带灰度值在HeLa及SiHa细胞中降低,而STAT3条带灰度值在HeLa及SiHa细胞中升高,差异均有统计学意义(P < 0.05),见图 5A,而HeLa、SiHa细胞中GATA3及STAT3条带灰度值比较,差异无统计学意义(P > 0.05)。实时定量RT-PCR结果显示:与HcerEpic比较,GATA3蛋白在HeLa及SiHa细胞中表达减少,而STAT3蛋白在HeLa及SiHa细胞中表达增多,差异有统计学意义(F=52.49, P < 0.05),HeLa及SiHa细胞中GATA3、STAT3蛋白表达水平比较,差异无统计学意义(F=3.34, P > 0.05),见图 5B。mRNA检测结果与蛋白表达结果一致,见图 5C。
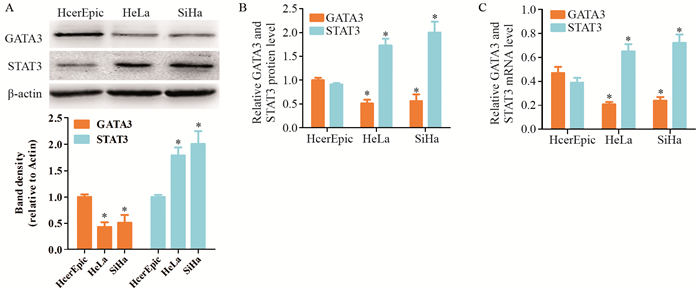
|
| *: P < 0.05, compared with HcerEpic group 图 5 GATA3、STAT3蛋白和mRNA在不同宫颈细胞系中的表达 Figure 5 Expression of GATA3, STAT3 protein and mRNA in different cervical cell lines |
采用TargetScan预测miR-135a-5p的靶基因,结果表明:miR-135a-5p与GATA3 3’UTR具有结合位点,见图 6A。进一步双荧光素酶报告基因结果显示:与miR-NC组比较,过表达miR-135a-5p后带有GATA3 3’UTR的荧光素酶活性明显降低,差异有统计学意义(P < 0.01); 在结合位点突变后,即在GATA3 3’UTR-MUT中miR-NC组与miR-135a-5p mimic组荧光素酶活性无明显变化,差异无统计学意义(P > 0.05),见图 6B,说明miR-135a-5p可靶向调控GATA3的转录活性。
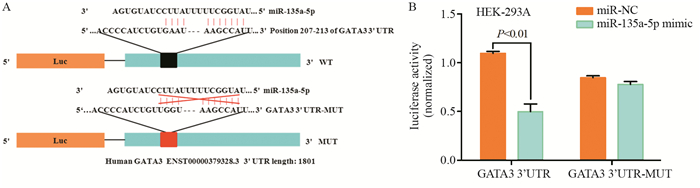
|
| 图 6 双荧光素酶报告基因验证miR-135a-5p与GATA3 3’UTR的靶向作用 Figure 6 Targeting effect between miR-135a-5p and GATA3 3'UTR verified by dual-luciferase reporter assay system |
Pearson相关性分析结果显示:在宫颈癌中miR-135a-5p与GATA3 mRNA的相对表达量呈负相关(r=-0.6656, P < 0.05),见图 7A;GATA3与STAT3 mRNA相对表达量呈负相关(r=-0.4534, P < 0.05),见图 7B。
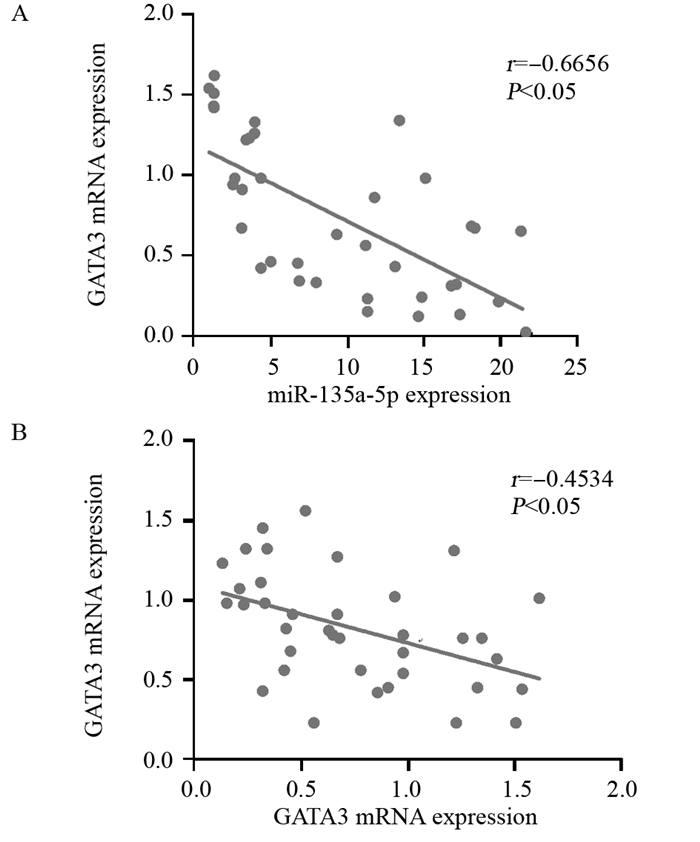
|
| 图 7 宫颈癌组织中miR-135a-5p、GATA3和STAT3 mRNA表达水平的相关性分析 Figure 7 Correlation of miR-135a-5p, GATA3 and STAT3 mRNA expression levels in cervical cancer tissues |
结果显示:miR-135a-5p的表达量与临床分期及淋巴结转移情况具有相关性,差异有统计学意义(P < 0.05); GATA3 mRNA的表达量与临床分期、间质浸润深度以及淋巴结转移情况具有相关性,差异均有统计学意义(P < 0.05),见表 1。
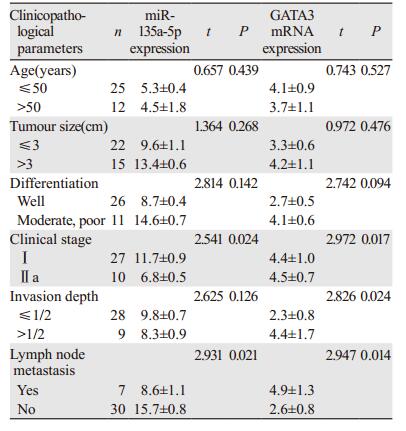
|
目前已证实高危型HPV持续感染是宫颈癌发病的初始步骤,但其发生发展是众多因素共同作用的结果,miRNA被认为是此过程中的重要因素[10]。已有研究表明miR-135a-5p在多种人类恶性肿瘤中起到原癌基因或抑癌基因的作用[5]。本研究结果显示:随着宫颈病变进展miR-135a-5p表达上调,且与宫颈癌临床分期及淋巴结转移情况相关,提示miR-135a-5p可能作为原癌基因参与宫颈癌的发生发展。
GATA3是一种在乳腺、尿路上皮和T细胞亚群分化过程中起重要作用的转录因子。在动物模型的研究中表明,GATA3在乳腺癌的发生过程中起关键作用[11],GATA3的表达缺失往往提示着乳腺肿瘤的进展甚至转移[12]。乳腺癌组织标本的免疫组织化学实验研究表明,低表达水平的GATA3提示较高的肿瘤分期及较差的预后,因此GATA3被认为是乳腺肿瘤的抑制因子[13-14]。另有研究表明,GATA3可通过调节参与肿瘤进展及转移的关键分子从而抑制膀胱癌细胞迁移及浸润,但不抑制细胞增殖[15]。相比之下,GATA3在宫颈癌中的研究较少。本研究结果显示,随着宫颈病变程度的进展,GATA3 mRNA表达水平下调,尤其在CSCC组中几乎未见GATA3的表达,对其表达水平与宫颈癌的临床病理参数的关联性进行分析,显示GATA3 mRNA的表达量与宫颈癌的临床分期、间质浸润深度以及淋巴结转移情况具有相关性,由此推测GATA3可能是作为宫颈癌的抑制因子参与疾病进展。GATA3是一种转录因子,其表达受上游信号如miRNA等的调节。采用生物信息学分析对GATA3的上游miRNA进行筛选,发现miR-135a-5p与GATA3相关性较大,并与GATA3 3’UTR有结合位点,进一步的双荧光素酶报告基因结果证实miR-135a-5p可与GATA3 3’UTR结合而调控其转录活性,推测在宫颈癌中miR-135a-5p可靶向抑制GATA3的表达而发挥功能,但其分子机制有待进一步的实验验证。
STAT3在人类多种恶性肿瘤如乳腺癌、胰腺癌、结直肠癌、急性淋巴细胞白血病中高表达,其过度表达与肿瘤的增殖、细胞凋亡抑制、侵袭和转移、新血管生成以及肿瘤干细胞(cancer stem cells, CSCs)的自我更新和分化等密切相关[16-17]。有研究发现,GATA3可抑制STAT3的表达活性,而在膀胱癌干细胞中GATA3活性受抑制,解除了其对STAT3的抑制作用,导致STAT3的高表达[6],本研究结果显示,随着宫颈病变的进展,STAT3表达上调,在CSCC组中表达最强,提示STAT3在宫颈癌中亦被过度激活,呈现高表达状态,对CSCC组中GATA3与STAT3 mRNA的表达水平进行相关性分析,结果显示两者呈负相关,符合已有研究结果的表达趋势,由此推测在宫颈癌中miR-135a-5p通过抑制GATA3的转录活性进而激活STAT3的表达,过度激活的STAT3作用于下游信号分子如CyclinD1、Survivin、IL-10等,而IL-10处于免疫调节的中心环节,IL-10的高表达可通过多种途径抑制机体免疫系统对肿瘤细胞的杀伤作用[18],如IFN-γ表达抑制[19],造成免疫逃逸,进而促进肿瘤的发生、发展及转移。本次研究的局限性在于仅从组织及细胞水平检测miR-135a-5p、GATA3及STAT3的表达情况及其相关性,课题组将在后续实验中进一步揭示miR-135a-5p/GATA3/STAT3在宫颈癌中的分子机制,以期为宫颈癌的病理诊断及靶向治疗提供新的分子靶点。
作者贡献
张梦:实验实施、样本收集、资料整理、撰写论文
马冬:实验设计、质量控制及审校
袁腾、樊少蓓、郭颖、刘佳:资料收集、数据处理
李鸥:实验设计、质量控制及审校
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5–29. DOI:10.3322/caac.21254 |
| [2] | González-Quintana V, Palma-Berré L, Campos-Parra AD, et al. MicroRNAs are involved in cervical cancer development, progression, clinical outcome and improvement treatment response (Review)[J]. Oncol Rep, 2016, 35(1): 3–12. |
| [3] | Zhou H, Guo W, Zhao Y, et al. MicroRNA-135a acts as a putative tumor suppressor by directly targeting very low density lipoprotein receptor in human gallbladder cancer[J]. Cancer Sci, 2014, 105(8): 956–65. DOI:10.1111/cas.2014.105.issue-8 |
| [4] | Müller S, Nowak K. Exploring the miRNA-mRNA Regulatory Network in Clear Cell Renal Cell Carcinomas by Next-Generation Sequencing Expression Profiles[J]. Biomed Res Int, 2014, 2014: 948408. |
| [5] | Guo LM, Ding GF, Xu WC, et al. MiR-135a-5p represses proliferation of HNSCC by targeting HOXA10[J]. Cancer Biol Ther, 2018: 1–28. |
| [6] | Yang Z, He L, Lin K, et al. The KMT1A-GATA3-STAT3 circuit is a novel self-renewal signaling of human bladder cancer stem cells[J]. Clin Cancer Res, 2017, 23(21): 6673–85. DOI:10.1158/1078-0432.CCR-17-0882 |
| [7] | Yao S, Tian C, Ding Y, et al. Down-regulation of Krüppel-like factor-4 by microRNA-135a-5p promotes proliferation and metastasis in hepatocellular carcinoma by transforming growth factor-β1[J]. Oncotarget, 2016, 7(27): 42566–78. |
| [8] | Pan YM, Wang CG, Zhu M, et al. STAT3 signaling drives EZH2 transcriptional activation and mediates poor prognosis in gastric cancer[J]. Mol Cancer, 2016, 15(1): 79. DOI:10.1186/s12943-016-0561-z |
| [9] | Yuan J, Zhang F, Niu R. Multiple regulation pathways and pivotal biological functions of STAT3 in cancer[J]. Sci Rep, 2015, 5: 17663. |
| [10] | Pedroza-Torres A, López-Urrutia E, García-Castillo V, et al. MicroRNAs in cervical cancer: evidences for a miRNA profile deregulated by HPV and its impact on radio-resistance[J]. Molecules, 2014, 19(5): 6263–81. DOI:10.3390/molecules19056263 |
| [11] | Kouros-Mehr H, Bechis SK, Slorach EM, et al. GATA-3 links tumor differentiation and dissemination in a luminal breast cancer model[J]. Cancer Cell, 2008, 13(2): 141–52. DOI:10.1016/j.ccr.2008.01.011 |
| [12] | Dydensborg AB, Rose AA, Wilson BJ, et al. GATA3 inhibits breast cancer growth and pulmonary breast cancer metastasis[J]. Oncogene, 2009, 28(29): 2634–42. DOI:10.1038/onc.2009.126 |
| [13] | Chou J, Provot S, Werb Z. GATA3 in Development and Cancer Differentiation: Cells GATA Have It![J]. J Cell Physiol, 2010, 222(1): 42–9. DOI:10.1002/jcp.v222:1 |
| [14] | Yoon NK, Maresh EL, Shen D, et al. Higher Levels of GATA3 Predict Better Survival in Women with Breast Cancer[J]. Hum Pathol, 2010, 41(12): 1794–801. DOI:10.1016/j.humpath.2010.06.010 |
| [15] | Li Y, Ishiguro H, Kawahara T, et al. Loss of GATA3 in bladder cancer promotes cell migration and invasion[J]. Cancer Biol Ther, 2014, 15(4): 428–35. DOI:10.4161/cbt.27631 |
| [16] | Yu H, Lee H, Herrmann A, et al. Revisiting STAT3 signalling in cancer: new and unexpected biological functions[J]. Nat Rev Cancer, 2014, 14(11): 736–46. DOI:10.1038/nrc3818 |
| [17] | Geiger JL, Grandis JR, Bauman JE. The STAT3 pathway as a therapeutic target in head and neck cancer: Barriers and innovations[J]. Oral Oncol, 2016, 56(28): 84–92. |
| [18] | Mumm JB, Emmerich J, Zhang X, et al. IL-10 elicits IFNγ-dependent tumor immune surveillance[J]. Cancer Cell, 2011, 20(6): 781–96. DOI:10.1016/j.ccr.2011.11.003 |
| [19] | Ma D, Jiang C, Hu X, et al. Methylation Patterns of the IFN-γ Gene in Cervical Cancer Tissues[J]. Sci Rep, 2014, 4(7545): 6331. |
 2019, Vol. 46
2019, Vol. 46


