文章信息
- 抑制LITAF基因对人脑胶质母细胞瘤U251细胞增殖、凋亡和放疗敏感度的影响
- Effect of Inhibiting LITAF Expression on Proliferation, Apoptosis and Radiosensitivity of Human Glioblastoma U251 Cell
- 肿瘤防治研究, 2019, 46(2): 105-109
- Cancer Research on Prevention and Treatment, 2019, 46(2): 105-109
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1031
- 收稿日期: 2018-07-26
- 修回日期: 2018-11-28
2. 400037 重庆,陆军军医大学新桥医院病理科;
3. 400030 重庆,重庆市肿瘤医院肿瘤内科
2. Department of Pathology, Xinqiao Hospital, Army Medical University, Chongqing 400037, China;
3. Department of Oncology, Cancer Hospital of Chongqing, Chongqing 400030, China
脑胶质瘤是最常见的中枢神经系统肿瘤,WHO分型将其分为Ⅰ~Ⅳ级,其中WHOⅣ级脑胶质瘤又称脑胶质母细胞瘤,恶性程度最高,预后最差,患者的中位生存时间仅14月左右[1-2]。目前手术联合放、化疗是人脑胶质母细胞瘤的主要治疗方法,但脑胶质母细胞瘤高度浸润性生长的生物学特性及对放化疗的抗拒性,使复发成为绝大多数脑胶质母细胞瘤患者最终难以避免的临床结局。随着近年对脑胶质母细胞瘤基因层面的深入探索,为脑胶质母细胞瘤的分子靶向、基因及免疫治疗等带来了新的策略[3]。
LITAF基因作为一个多功能的转录因子,广泛分布于人体的不同组织[4]。近年来有报道指出,LITAF可能是一个潜在的抑癌基因,其表达水平的降低可能与前列腺癌[5]、胰腺癌[6]、B细胞淋巴瘤[7]、急性白血病[8]等肿瘤的发生、发展和放化疗敏感度相关。关于脑胶质母细胞瘤中LITAF基因的表达水平及其功能尚不清楚。本文通过分析LITAF基因在人脑胶质母细胞瘤组织中的表达,抑制人脑胶质母细胞瘤U251细胞(以下简称U251细胞)中LITAF基因表达,观察其对U251细胞增殖、凋亡以及放疗敏感度的影响。
1 材料与方法 1.1 主要试剂及仪器反转录试剂盒和实时荧光定量聚合酶链式反应(qPCR)试剂盒(日本,TaKaRa公司);荧光定量PCR仪(美国,贝克曼库尔特有限公司);LITAF基因PCR上游引物:5′-ATGTCGGTTCCAGGACCTTAC-3′, 下游引物:5′-TACGAAGGAGGATTCATGCCC-3′(美国,赛默飞世尔科技有限公司);β肌动蛋白(β-actin)基因PCR上游引物:5′-GAGCTACGAGCTGC CTGACG-3′,下游引物:5′-GTAGTTTCGTGGATGCCACAG-3′(美国,赛默飞世尔科技有限公司);LITAF基因干扰病毒Target序列:5′-CCAUUUUCUGUAAUCAAAUGA-3′(中国上海,吉凯基因科技有限公司);Western blot凝胶试剂盒(中国上海,碧云天生物技术有限公司);LITAF-单抗(中国武汉,三鹰生物技术有限公司);鼠和兔二抗(中国武汉,博士德生物工程有限公司);聚偏二氟乙烯膜(PVDF膜)(瑞士,罗氏公司);湿转仪(美国,BioRad公司);5-乙炔基-2脱氧尿嘧啶核苷(EDU)试剂盒(美国,GeneCopoeia公司);PE-7AAD凋亡试剂盒(美国,BD公司)。
1.2 方法 1.2.1 TCGA数据库分析利用UALCAN(http://ualcan.path.uab.edu/)网站分析TCGA数据库中脑胶质瘤组织的LITAF mRNA表达情况。
1.2.2 细胞培养U251细胞由本实验室保存,加入含1%双抗和10%胎牛血清的Gibco DMEM培养液,在37℃、5%CO2的细胞培养箱中常规培养。
1.2.3 LITAF基因干扰载体反转录病毒感染U251细取对数生长期U251细胞制备成单细胞悬液,计数,接种至25 cm2培养瓶中。按病毒感染比率值10:1取对照病毒和LITAF基因干扰病毒分别感染靶细胞,观察细胞绿色荧光产生。感染72 h后,去除含病毒载体的培养液,洗涤后加入含6 μg/ml嘌呤毒素的新鲜培养液进行细胞筛选,2~3天更换一次培养液,筛选7~10天获得稳定转染细胞后,更换正常培养基培养。稳定转染细胞分别用qPCR和Western blot检测干扰结果。
1.2.4 qPCR测定U251细胞LITAF mRNA表达按照TRIzol试剂盒说明书提取细胞总RNA,反转录,重复2次;将3次实验获得的各组cDNA进行qPCR检测;PCR引物见前述,采用SYBR Premix PCR试剂盒,于荧光实时定量PCR仪测定LITAF基因的mRNA水平。
1.2.5 Western blot检测U251细胞LITAF蛋白表达蛋白提取试剂盒提取细胞总蛋白,测定浓度后按常规方法进行凝胶电泳,转印至PVDF膜,小兔抗LITAF单抗标记,加入辣根过氧化物酶标记的相应二抗,增强化学发光显影,以β-actin为参照。
1.2.6 干扰组、阴性对照组和空白组U251细胞增殖测定干扰组为LITAF抑制病毒感染后的U251细胞,阴性对照组为转染阴性对照病毒的U251细胞,空白组为未转染病毒的U251细胞。每组按照3个孔重复。EDU检测:各组细胞制备成单细胞悬液,计数后调整细胞浓度,按照1.5×105个/孔接种于6孔板内,加培养液,37℃孵育过夜后,每孔分别加入2 ml混合培养液,37℃孵育6 h,按照EDU检测试剂盒说明处理细胞,流式细胞仪分析各组细胞增殖比例。
1.2.7 细胞照射分别取对数生长期细胞制备成单细胞悬液,计数后按2×105个/瓶接种至25 cm2培养瓶中,加入10 ml含1%双抗和10%胎牛血清的DMEM培养液,细胞贴壁,封口膜封住培养瓶瓶盖及透气孔,75%酒精擦拭培养瓶,6 MeV-电子线照射细胞后,75%酒精再次擦拭培养瓶消毒并撕去封口膜,放入37℃含5%CO2培养箱孵育。每组细胞设置3个重复。照射设备:美国Varian直线加速器;照射条件:28℃室温,照射前治疗室紫外线空气消毒30 min,6 MeV-电子线照射细胞,剂量率为300 Mu/min,源皮距100 cm,照射野限光筒为25 cm×25 cm。培养液深度5 mm,培养瓶下方垫1 cm厚组织等效补偿块,照射剂量计划由物理师在Eclipse放疗计划系统计算得出。
1.2.8 流式细胞凋亡分析放疗前细胞凋亡检测:分别取对数生长期干扰组、阴性对照组和空白组U251细胞制备成单细胞悬液,计数后按2×105个/瓶接种至25 cm2培养瓶中,加入4 ml含1%双抗和10%胎牛血清的DMEM培养液,37℃培养箱孵育24 h,收集培养瓶内所有细胞,PE-7AAD凋亡试剂盒染色,流式细胞分析仪检测凋亡细胞比例。放疗后细胞凋亡检测:干扰组和阴性对照组U251细胞给予单次13 Gy(6MeV-电子线)照射后,37℃含5%CO2培养箱孵育72 h,收集培养瓶内悬浮和贴壁的所有细胞,PE-7AAD凋亡试剂盒染色,流式细胞分析仪检测凋亡细胞比例。
1.2.9 克隆形成实验干扰组和阴性对照组U251细胞给予单次7 Gy(6MeV-电子线)照射后,37℃含5% CO2培养箱孵育24 h,制备成单细胞悬液,计数后按2×103个/孔接种至6孔板中,每孔加入2 ml含1%双抗和10%胎牛血清的DMEM培养液,十字形轻轻晃动6孔板,使细胞分散均匀。每组细胞设3个重复。放入37℃培养箱中孵育,3~4天更换一次培养液,培养10~14天,进行苏木精染色并计数大于50个细胞的克隆数。最后计算克隆形成率,克隆形成率=(克隆数/接种细胞数)×100%。
1.3 统计学方法所有实验图表及数据使用GraphPad Prism 5软件进行制作及统计学分析,P < 0.05为差异有统计学意义。
2 结果 2.1 LITAF基因高表达于人脑胶质母细胞瘤组织对TCGA数据库156例人脑胶质母细胞瘤组织和5例正常脑组织中LITAF mRNA表达情况分析,结果显示,与正常脑组织相比,LITAF mRNA显著高表达于人脑胶质母细胞瘤组织中(P < 0.0001),见图 1。
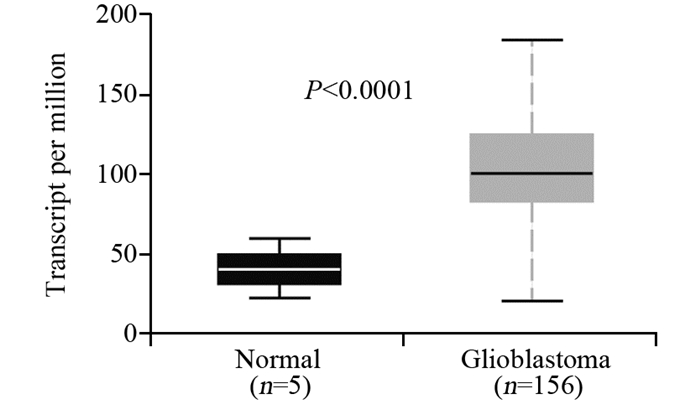
|
| 图 1 分析TCGA数据库人脑胶质母细胞瘤组织及正常脑组织中LITAF mRNA的表达 Figure 1 Expression of LITAF mRNA in human glioblastoma and normal brain tissues from TCGA |
用RNAi抑制U251细胞LITAF表达,建立稳定转染细胞株。采用qPCR、Western blot方法检测干扰效果,结果显示干扰组与阴性对照组细胞相比,LITAF mRNA和蛋白表达显著降低(P=0.0013),见图 2。该结果提示LITAF RNAi显著抑制了干扰组U251细胞内LITAF基因的表达。EDU标记、流式细胞术分析空白组、阴性对照组、干扰组细胞增殖情况。结果显示空白染组、阴性对照组和干扰组增殖比例分别为57.03%、56.26%和57.69%,三组细胞增殖比例差异无统计学意义(P=0.4665),见图 3,提示U251细胞内LITAF基因表达抑制后,U251细胞的增殖未受到明显影响,在缺乏其他因素作用下,LITAF基因未参与细胞的增殖调控。
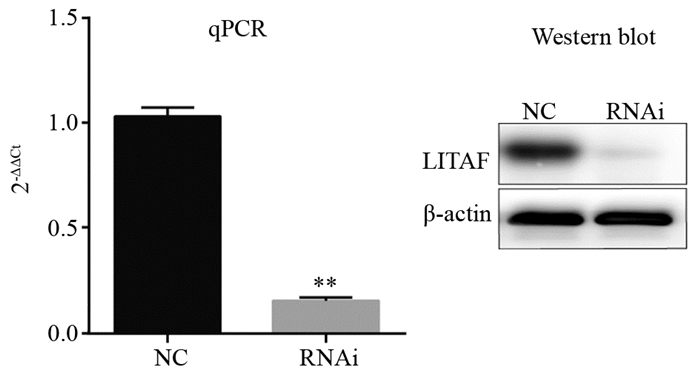
|
| **: P=0.0013, RNAi group vs. NC group; NC: negative control; RNAi: LITAF RNAi-transfected cells 图 2 qPCR和Western blot检测U251细胞LITAF RNAi的表达 Figure 2 Expression of LITAF RNAi in U251 cells measured by qPCR and Western blot |
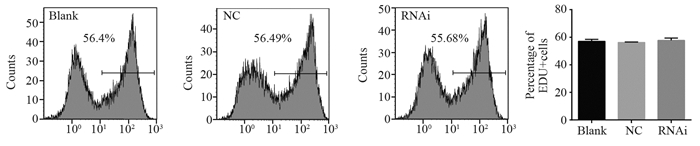
|
| P=0.4665, RNAi group vs. the other two groups 图 3 EDU检测抑制LITAF后U251细胞的増殖情况 Figure 3 Effect of LITAF on proliferation of glioblastoma U251 cells detected by EDU |
流式细胞术检测三组细胞凋亡,结果显示凋亡率发生比例为空白组4.64%、阴性对照组5.37%、干扰组细胞4.85%,三组细胞凋亡比例差异无统计学意义(P=0.4619),见图 4。该结果显示仅抑制LITAF基因表达,不会影响U251细胞的凋亡调控机制。
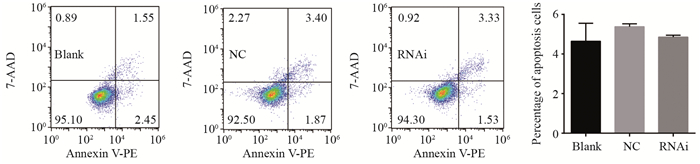
|
| P=0.4619, RNAi group vs. the other two groups 图 4 流式细胞术检测干扰LITAF对U251细胞凋亡的影响 Figure 4 Apoptosis of glioblastoma U251 cells measured by flow cytometry |
阴性对照组与干扰组细胞在单次13 Gy 6MeV-电子线照射后72 h,流式细胞分析,结果显示阴性对照组凋亡比例为22.24%、干扰组细胞为13.20%,干扰组细胞凋亡比例显著低于阴性对照组(P=0.0016),见图 5。说明抑制U251细胞LITAF基因表达后,细胞在接受电离辐射后凋亡显著减少,提示LITAF基因参与了U251细胞电离辐射后细胞损伤修复或凋亡机制的调控,抑制LITAF基因表达可导致U251细胞放疗敏感度减弱。
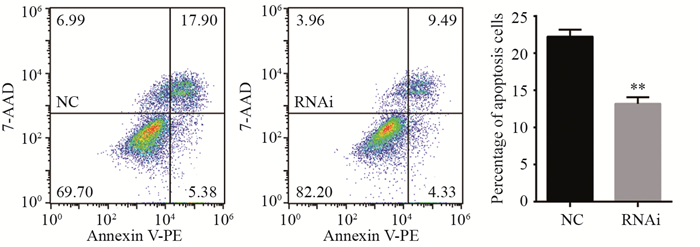
|
| **: P=0.0016, RNAi group vs. NC group 图 5 流式细胞术检测抑制LITAF基因对放疗后U251细胞凋亡的影响 Figure 5 Apoptosis of glioblastoma U251 cells treated with 13 Gray irradiation measured by flow cytometry |
阴性对照组与干扰组细胞经单次7 Gy 6MeV-电子线照射后,细胞克隆形成实验结果显示干扰组细胞克隆大小、形态与对照组相似,但克隆形成率显著高于阴性对照组细胞(P=0.0142),见图 6。结果提示抑制LITAF基因可显著增加电离辐射后U251细胞的存活和增殖能力,进一步证实了抑制LITAF基因表达可明显减弱U251细胞的放疗敏感度。
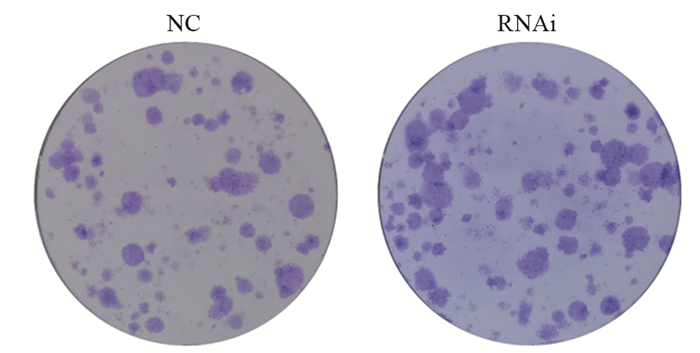
|
| P=0.0142, RNAi group vs. NC group 图 6 克隆形成实验检测抑制LITAF对放疗后U251细胞克隆形成率的影响 Figure 6 Clone formation rate of glioblastoma U251 cells treated with 7 Gray irradiation measured with Clonogenic assay |
人LITAF基因(LPS-induced TNF-α factor)被称作p53诱导的基因7(PIG7),位于16号染色体上,其mRNA大小为1.8 kb,编码蛋白质大小为23.9 kDa,包含228个氨基酸。LITAF广泛表达于人体各组织细胞中,其中脾脏、淋巴结和外周血白细胞表达最高,其次为骨髓、胸腺、阑尾、肾脏和胎盘,表达最低的是心脏、大脑和胎儿肝脏[4]。LITAF可在脂多糖(LPS)的刺激下,与STAT6B形成复合物,共同调控TNF-α、IL-6和CCL-18等炎性因子的表达,在正常的炎性反应过程中起着重要的作用[9]。异常表达的LITAF与炎性反应性肠病[10]和骨关节炎[11]的发生发展相关。除此之外,LITAF的突变还与乳腺佩吉特病[12]和腓骨肌萎缩症[13]有关。
近年来多篇报道指出,LITAF基因可能是一个潜在的抑癌基因,抑制肿瘤细胞的增殖,并促进其凋亡。Zhou等[5]指出LITAF通过调控TNFSF15来抑制前列腺癌细胞的增殖。Wang等[8]分析了138例急性白血病患者和21例健康者骨髓标本中LITAF mRNA表达情况,发现在急性白血病患者骨髓中LITAF的表达跟健康者相比显著下降;且难治复发白血病患者跟初治白血病患者相比,LITAF的表达更低,同时对化疗也表现出更明显的抗拒性。王金洁等[14]检测了105例B细胞淋巴瘤石蜡标本中LITAF基因启动子区CpG岛的甲基化情况,发现89.5%的标本中存在LITAF基因启动子CpG岛的甲基化,由其所致的LITAF表达沉默或降低可能会引起B细胞淋巴瘤的发生发展。Zhou等[6]发现在胰腺癌组织中也存在LITAF启动子的甲基化并使其表达降低,LITAF基因的去甲基化恢复表达会抑制胰腺癌细胞的增殖和凋亡。
我们分别对TCGA数据库中156例人脑胶质母细胞瘤组织和5例正常脑组织进行了分析。与其他肿瘤组织相反的是,人脑胶质母细胞瘤组织中LITAF的mRNA表达高于正常脑组织。该结果提示LITAF基因在人脑胶质母细胞瘤中的作用可能异于前列腺癌、急性白血病等恶性肿瘤。为此,我们通过RNAi技术抑制了人脑胶质母细胞瘤细胞系U251中LITAF的表达,观察抑制LITAF基因后是否会影响U251细胞的增殖和凋亡。EDU和流式细胞分析结果显示抑制LITAF表达后细胞的增殖比率和凋亡发生无显著性差异,说明单纯抑制LITAF表达并未对U251细胞的增殖和凋亡产生显著影响。该结果提示LITAF可能不直接参与U251细胞的增殖和凋亡信号通路调节,脑胶质母细胞瘤较正常脑组织细胞高表达LITAF可能在于其上游基因突变或过表达,例如TP53[4]、AMPK[5]等,导致LITAF基因表达上调。
尽管抑制U251细胞LITAF表达不影响细胞增殖和凋亡,但其与正常脑组织表达的差异仍提示其可能在脑胶质母细胞瘤中承担某种调节功能。放射治疗作为脑胶质母细胞瘤的主要治疗手段,LITAF基因是否在U251细胞放疗后的细胞生物学功能改变中发挥作用?由此我们继续观察到通过给予单次电离辐射后,流式细胞分析显示,LITAF抑制组U251细胞在接受放射治疗后的凋亡显著低于对照组,而细胞克隆形成试验结果显示LITAF抑制组细胞克隆数显著高于对照组。通过抑制LITAF基因U251细胞在电离辐射后细胞凋亡减少和克隆形成增强结果,提示高表达LITAF基因会增强U251细胞的放疗敏感度。Hoey等[15]在前列腺癌细胞中也发现低表达LITAF的前列腺癌细胞表现出对放疗的抵抗。从LITAF抑制组U251细胞在电离辐射后细胞凋亡较少、克隆数增加,但细胞克隆的大小形态与对照组无明显差异,说明LITAF基因可能影响了细胞放疗后的凋亡发生。该结果结合单纯抑制LITAF表达对U251细胞凋亡无明显影响结果,提示LITAF基因可能主要参与了放疗后细胞的DNA损伤修复调节,抑制LITAF基因后,细胞在放疗后DNA损伤修复能力增强,导致细胞凋亡减少。其具体机制还有待进一步研究。
通过本研究,我们发现LITAF mRNA高表达于人脑胶质母细胞瘤组织中,抑制人脑胶质母细胞瘤U251细胞LITAF表达虽未对细胞的增殖和凋亡产生影响,但可使U251细胞的放疗敏感度降低,其具体机制尚待深入研究。
作者贡献
黄昌林:实验及结果分析、论文撰写及修改 陈典刚:实验设计、实验及结果分析 朱虹帆:实验及结果分析 汤金梁、王东林:论文撰写及修改 李光辉:实验设计、论文撰写及修改
| [1] | Wesseling P, Capper D. WHO 2016 Classification of gliomas[J]. Neuropathol Appl Neurobiol, 2018, 44(2): 139–50. DOI:10.1111/nan.2018.44.issue-2 |
| [2] | Mann J, Ramakrishna R, Magge R, et al. Advances in Radiotherapy for Glioblastoma[J]. Front Neurol, 2017, 8: 748. |
| [3] | Hanif F, Muzaffar K, Perveen K, et al. Glioblastoma Multiforme:A Review of its Epidemiology and Pathogenesis through Clinical Presentation and Treatment[J]. Asian Pac J Cancer Prev, 2017, 18(1): 3–9. |
| [4] | Zou J, Guo P, Lv N, et al. Lipopolysaccharide-induced tumor necrosis factor-alpha factor enhances inflammation and is associated with cancer (Review)[J]. Mol Med Rep, 2015, 12(5): 6399–404. DOI:10.3892/mmr.2015.4243 |
| [5] | Zhou J, Yang Z, Tsuji T, et al. LITAF and TNFSF15, two downstream targets of AMPK, exert inhibitory effects on tumor growth[J]. Oncogene, 2011, 30(16): 1892–900. DOI:10.1038/onc.2010.575 |
| [6] | Zhou Y, Huang J, Yu X, et al. LITAF is a potential tumor suppressor in pancreatic cancer[J]. Oncotarget, 2017, 9(3): 3131–42. |
| [7] | Bertolo C, Roa S, Sagardoy A, et al. LITAF, a BCL6 target gene, regulates autophagy in mature B-cell lymphomas[J]. Br J Haematol, 2013, 162(5): 621–30. DOI:10.1111/bjh.2013.162.issue-5 |
| [8] | Wang D, Liu J, Tang K, et al. Expression of pig7 gene in acute leukemia and its potential to modulate the chemosensitivity of leukemic cells[J]. Leuk Res, 2009, 33(1): 28–38. |
| [9] | Tang X, Amar S. Kavain Involvement in LPS-Induced Signaling Pathways[J]. J Cell Biochem, 2016, 117(10): 2272–80. DOI:10.1002/jcb.25525 |
| [10] | Berends SE, Strik AS, Löwenberg M, et al. Clinical Pharmacokinetic and Pharmacodynamic Considerations in the Treatment of Ulcerative Colitis[J]. Clin Pharmacokinet, 2018. |
| [11] | Brenner M, Laragione T, Gulko PS. Arthritis severity locus Cia4 is an early regulator of IL-6, IL-1beta, and NF-kappaB activators'expression in pristane-induced arthritis[J]. Physiol Genomics, 2013, 45(13): 552–64. DOI:10.1152/physiolgenomics.00029.2013 |
| [12] | Liu J, Peng L, Niu T, et al. PIG7 promotes leukemia cell chemosensitivity via lysosomal membrane permeabilization[J]. Oncotarget, 2016, 7(4): 4841–59. |
| [13] | Ho AK, Wagstaff JL, Manna PT, et al. The topology, structure and PE interaction of LITAF underpin a Charcot-Marie-Tooth disease type 1C[J]. BMC Biol, 2016, 14(1): 109. DOI:10.1186/s12915-016-0332-8 |
| [14] | 王金洁, 施瑶瑶, 王玲芳, 等. B细胞淋巴瘤LITAF基因甲基化状态及其临床意义[J]. 中华病理学杂志, 2014, 43(8): 516–21. [ Wang JJ, Shi YY, Wang LF, et al. Significance of expression and promoter methylation of LITAF gene in B-cell lymphoma[J]. Zhonghua Bing Li Xue Za Zhi, 2014, 43(8): 516–21. DOI:10.3760/cma.j.issn.0529-5807.2014.08.004 ] |
| [15] | Hoey C, Ray J, Jeon J, et al. miRNA-106a and prostate cancer radioresistance:a novel role for LITAF in ATM regulation[J]. Mol Oncol, 2018, 12(8): 1324–41. DOI:10.1002/mol2.2018.12.issue-8 |
 2019, Vol. 46
2019, Vol. 46


