文章信息
- 沉默STAT3增强SNX-2112诱导食管癌干细胞凋亡的研究
- Silence of STAT3 Enhances SNX-2112-induced Apoptosis of Esophageal Cancer Stem Cells
- 肿瘤防治研究, 2019, 46(3): 197-204
- Cancer Research on Prevention and Treatment, 2019, 46(3): 197-204
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1004
- 收稿日期: 2018-07-23
- 修回日期: 2018-11-08
2. 510632 广州,暨南大学生命科学技术学院;
3. 510225 广州,仲恺农业工程学院食品学院
2. College of Life Science and Technology, Ji'nan University, Guangzhou 510632, China;
3. Food College, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China
食管癌是世界第六大致死性肿瘤疾病[1]。食管癌的治疗主要采用手术治疗与化疗的方式,但效果仍不理想。
肿瘤干细胞是一小部分具有自我更新能力的细胞,它具有启动形成肿瘤组织的特性[2],受到胞内外多种因素调控。信号转导子与转录激活子3(STAT3)在调控肿瘤细胞、肿瘤干细胞的增殖、存活、凋亡、耐药中发挥至关重要的作用[3]。已有研究表明STAT3对肿瘤干细胞这些性质与功能是不可或缺的[4]。STAT3属于STATs家族中的重要一员,STAT3调控细胞的生理过程,包括发育、生化、免疫以及代谢等重要生命活动[5]。STAT3发生激活(Y705与S727磷酸化),就会开启控制抗凋亡、促增殖以及免疫反应的基因表达[6-7]。
热休克蛋白Hsp90是分子伴侣蛋白,在细胞中普遍表达。参与细胞生理以及病理过程的大多数蛋白发挥功能都离不开Hsp90的协助[8]。同正常组织相比,Hsp90表达量在肿瘤细胞有所提高。Hsp90的客户蛋白,如Akt、Her2、MAPK等,在驱动肿瘤细胞存活、增殖以及耐药等方面发挥重要作用[9]。正因为这样,Hsp90是一个十分有效的抗肿瘤靶标。前期研究中,我们已经通过悬浮培养的方法得到食管癌干细胞样细胞[10],本研究主要通过沉默STAT3的表达水平研究Hsp90抑制剂SNX-2112诱导食管癌干细胞凋亡的效果。
1 材料与方法 1.1 材料Eca109细胞购于中山大学细胞库(广东广州),CCK8试剂盒购于碧云天生物技术公司(江苏海门)。IGF2、EGF、bFGF购于PeproTech公司(江苏苏州),B27购于Invitrogen公司(上海),DMEM/F12培养基购于Stem cells公司(上海),澳洲胎牛血清购自Sigma公司(上海),抗生素购于广州天骏生物公司(广东广州)。AnnexinV-FITC/PI细胞凋亡试剂盒购于南京凯基公司(江苏南京)。Bcl2抗体(#2872)以及Bax抗体(#14796)STAT3抗体(#9139)以及pSTAT3抗体(#4113)购自美国Cell Signaling Technology公司(美国Carlsbad)。STAT3引物及shRNA-STAT3、shSTAT3-1慢病毒由上海吉凯公司合成,促转染试剂polybrene(#3614)购自上海吉凯公司。SNX-2112由暨南大学王一飞教授馈赠。ECL细胞Western blot发光液购自美国Millipore公司。细胞培养箱(美国Thermo公司,上海),流式细胞仪(美国BD公司,上海),PCR仪器(BIO-RAD公司,上海)。
1.2 细胞培养本课题组前期研究通过悬浮成球的培养方法获得食管癌干细胞[10],具体方法为使用IMDM无血清培养基(20 ng/ml EGF、20 ng/ml bFGF、B27和1%双抗)培养食管癌细胞Eca109,用超低黏附培养皿。每3~5天半定量更换培养基,周期21天,部分细胞悬浮成球,鉴定并分析成球细胞的性质。获得的食管癌干细胞培养在DMEM/F12培养基,并添加20 ng/ml bFGF、20 ng/ml EGF以及B27,培养基中含有终浓度为1%的青霉素与链霉素。将细胞置于5%CO2培养箱中,37℃培养。
1.3 细胞增殖活性分析分别收集对数生长期的食管癌干细胞,用培养液稀释成细胞悬液,接种于96孔板,每孔接种5 000个细胞,设3个复孔、药物处理组(shSTAT3沉默后再加SNX-2112药物作用)、DMSO溶剂对照组以及空白对照组。然后置于CO2培养箱孵育24、48和72 h后,加入CCK-8溶液,继续培养1~4 h,酶标仪测定各孔570 nm处的OD值(光密度值),测得吸光度A值。生长抑制率的计算公式为:生长抑制率(%)=(1-OD实验组/OD对照组)×100%。根据各浓度的抑制率可作图得到剂量反应曲线。
1.4 细胞凋亡和细胞周期分析收集shSTAT3沉默后再加SNX-2112药物作用后的细胞,弃去上清液,并用PBS轻轻重悬并计数; PBS洗涤细胞3次,收集5×105个细胞; 每个样品加入500 µl结合液重悬细胞,锡箔纸包好静置5 min; 然后每个样品再加入5 µl的Annexin-APC凋亡试剂,轻轻混匀,静置5 min后,再加5 µl 7-AAD凋亡试剂,混匀; 室温下避光孵育15~20 min,流式细胞仪分析细胞凋亡情况。离心收集药物作用后的细胞,使细胞数量在1×106个/毫升,PBS洗涤细胞; 加入500 µl PI孵育液,重悬细胞,室温避光孵育10 min; 流式细胞仪检测细胞周期阻滞。FlowJo分析细胞凋亡与阻滞情况。
1.5 Western blot分析凋亡蛋白变化1 000 r/min离心5 min收集细胞(先shSTAT3沉默后再加SNX-2112药物作用),将药物作用后的细胞用含苯甲基磺酰氟的RIPA(50 μmol/L Tris-HCl, 150 μmol/L NaCl, 1%NP-40, pH7.4)裂解液裂解,置于金属浴加热裂解细胞,100℃裂解10 min。使用BCA法得到蛋白浓度,并使用SDS loading buffer溶解细胞,涡旋混匀。蛋白样品通过12%的SDS-PAGE胶电泳分离开,转膜到PVDF膜上。5%的脱脂奶粉(1%吐温20的TBS溶液溶解)室温封闭1 h,TBST缓冲液洗涤膜3次后,将稀释好的一抗与PVDF膜4℃杂交孵育过夜。次日,TBST洗涤膜三次,加入相应的二抗,室温1 h,利用化学发光法显影检测。内参蛋白使用β-actin作对比进行归一化处理。
1.6 RNA提取以及qPCR分析1 000 r/min离心收集药物作用后的细胞,弃废液,加1 ml TRIzol裂解液裂解细胞,室温下静置5 min; 加入0.2 ml氯仿,涡旋振荡使细胞充分裂解,12 000 r/min、4℃离心15 min,用移液枪轻轻吸取上层液相400 μl,避免扰动下层杂蛋白; 加入400 μl异丙醇,混匀,室温放置10 min,4℃、12 000 r/min,离心5 min,EP管底部有白色沉淀,即为总RNA; 弃去上层液,加入1 ml的75%无水乙醇洗涤总RNA沉淀; 12 000 r/min,4℃离心5 min,移液枪弃去液体,留下白色沉淀RNA; 室温打开EP管盖子,待乙醇挥发,晾干总RNA。反转录反应:37℃,15 min; 85℃,5 s; 4℃保存。反转录获得cDNA用于下一步的qPCR反应过程:STAT3,F: 5’-GGGCCCGTTAAGCGGGTTTCCCGG-3’,R: 5’-TTGGGCCAAGGGCCC TTAACCTTAACC-3’。反应体积为10 μl,反应步骤为二步法,反应条件为:1个循环,95℃ 5 s,60℃ 5 s; 42个循环,95℃ 15 s,60℃ 1 min,使用2-ΔΔCt法处理qPCR数据。
1.7 软琼脂平板实验去离子水配制1.0%与0.5%的低熔点琼脂糖,高温高压灭菌,置于40℃水浴保温使之不凝固; 用含20%胎牛血清的DMEM/F12培养基(2%青霉素与链霉素,40 ng/ml EGF,40 ng/ml bFGF,2倍B27)把分离获取的食管癌干细胞调整至密度300个/毫升; 用20%胎牛血清的DMEM/F12培养基把1.0%的低熔点琼脂糖液稀释成0.5%的底层琼脂; 取0.5%的低熔点琼脂糖,用此琼脂糖与等体积的含有食管癌干细胞的DMEM/F12混合配成0.25%的上层琼脂; 把上述混匀后含食管癌干细胞的0.25%琼脂糖液加入6孔板底层琼脂上,使其形成双琼脂层; 将6孔板继续培养15天; 6孔板加入0.25毫升/孔的0.05%结晶紫溶液,37℃孵育30 min后观察细胞克隆数,并计算克隆形成率。计数大于 > 15个细胞的克隆数,计算克隆形成率。克隆形成率(%)=克隆数/接种细胞数×100%。
1.8 shRNA-STAT3慢病毒转染设计shSTAT3慢病毒载体,靶点为5’-GGGTTAAGCTGTAACATACTT-3’,shSTAT3-1的靶点为5’-GTGCTGGCC TTCGGCCAATG-3’,同时设计靶向GFP为阴性对照,靶点为5'-GGCCGGAATTCCCGGTT-3’,病毒滴度为1.0×108。转染方法为:收集分离后的食管癌干细胞约1.0×106个,加入病毒,并加入促转染试剂polybrene(终浓度为8 µg/ml)辅助病毒转染,转染步骤按照说明书进行。
1.9 统计学方法采用SPSS19.0统计软件对数据进行统计分析,计量数据以(x±s)表示,组间采用t检验分析,采用Graphpad 5作图,P < 0.05为差异具有统计学意义。
2 结果 2.1 SNX-2112抑制食管癌干细胞增殖根据之前课题组的研究结果,本课题组已经得到食管癌细胞Eca109来源的食管癌干细胞[10](以下全部称为食管癌干细胞)。不同浓度(0.015625、0.03125、0.0625、0.125、0.25、0.5、1.0 μmol/L)SNX-2112作用食管癌干细胞Eca109,24 h后,随着药物浓度提高,细胞存活率逐渐降低。48 h后,出现同样的结果,细胞增殖受到抑制,见图 1。使用Graphpad 5计算出SNX-2112作用Eca-109细胞24 h与48 h的IC50,分别为(0.28±0.01)μmol/L、(0.05±0.01)μmol/L。Eca109经过SNX-2112作用48 h后,细胞的生长较24 h时受到的抑制程度更加明显,如细胞出现碎片,不利于收集细胞做后续研究,所以选择药物作用时间为24 h,选择SNX-2112药物浓度为0.28 μmol/L。
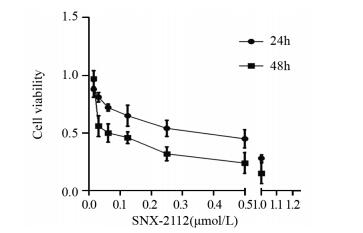
|
| 图 1 CCK8实验分析SNX-2112作用食管癌干细胞24h与48h的活性曲线 Figure 1 Effect of SNX-2112 on viability of esophageal cancer stem cells after 24 and 48h detected by CCK8 |
为了得到更加有效的沉默效果,课题组设计了2个沉默STAT3的慢病毒载体,分别为shSTAT3与shSTAT3-1。qPCR结果显示,慢病毒载体沉默组(shSTAT3)沉默STAT3 mRNA水平较shSTAT3-1及空白对照组(shGFPctrl)差异有统计学意义(P=0.0062, P=0.0031),shSTAT3-1相对于空白对照组则差异无统计学意义(P=0.365),见图 2A。Western blot结果进一步确认shSTAT3的沉默效率,相较于空白对照组,shSTAT3蛋白表达明显下调(81.21%, P=0.0053),而shSTAT3-1组STAT3蛋白表达量基本无变化(2.13%, P=1.23),见图 2B。Western blot结果显示,相较于shGFPctrl组沉默STAT3的同时,STAT3的活化形式pSTAT3亦受到影响(72.12%, P=0.0005),见图 2B。qPCR及Western blot结果显示,shSTAT3可有效抑制食管癌干细胞中STAT3 mRNA及蛋白的表达水平,同时选择shSTAT3组用于后续沉默实验。后续的实验处理步骤是,细胞先受到shSTAT3作用,再加药物SNX-2112作用。
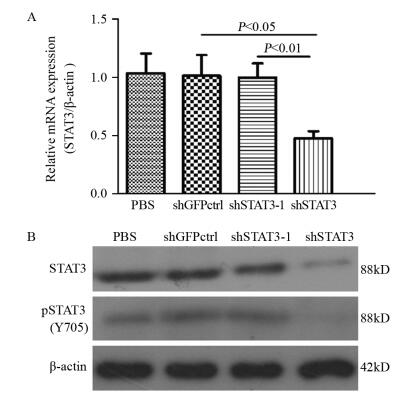
|
| 图 2 qPCR(A)和Western blot(B)法分析shSTAT3-1与shSTAT3的沉默效 Figure 2 Silence efficiency of shSTAT3-1 and shSTAT3 lentiviral vectors demonstrated by qPCR(A) and Western blot(B) |
CCK8实验显示:相较于shGFPctrl组,shSTAT3组细胞的生长受到明显抑制,细胞增殖的曲线趋于平缓(P=0.00062)。相较于PBS组,SNX-2112组细胞的增殖受到明显抑制(P=0.0048),PBS组与shGFPctrl组间差异无统计学意义(P > 0.05)。当食管癌干细胞沉默STAT3的同时使用SNX-2112,食管癌干细胞的增殖受到更显著的抑制(P=0.0001, P=0.00016),见图 3。
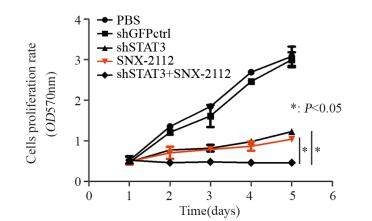
|
| 图 3 shSTAT3与SNX-2112联合应用对食管癌干细胞活性的影响 Figure 3 Effect of shSTAT3 combined with SNX-2112 on viability of esophageal cancer stem cells |
软琼脂平板实验显示,当食管癌干细胞受到shSTAT3与SNX-2112联合作用后,细胞克隆效率比例是(1.89±0.14)%,相较于当细胞受到shSTAT3作用后细胞克隆效率比例为(18.56±2.31)%以及细胞受到SNX-2112作用后细胞克隆效率比例为(8.71±1.65)%,存在显著性差异(P=0.0043, P=0.0072),见图 4。
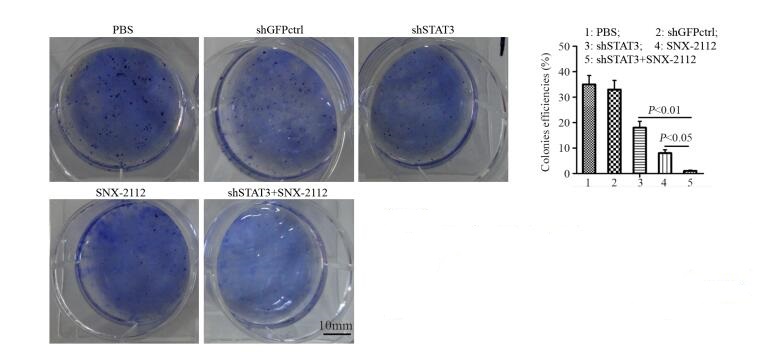
|
| 图 4 软琼脂平板克隆实验分析shSTAT3与SNX-2112联用对克隆形成效率的影响 Figure 4 Effect of shSTAT3 combined with SNX-2112 on colony efficiency of esophageal cancer stem cells analyzed by soft agar colony formation assay |
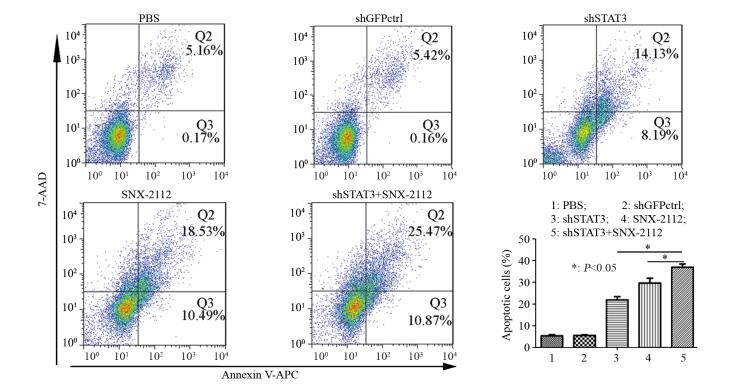
流式细胞仪实验显示,当食管癌干细胞受到shSTAT3与SNX-2112联合作用后,细胞的早期凋亡与晚期凋亡的总和(36.34±2.12)%明显高于单独作用组shSTAT3(22.32±2.59)%与SNX-2112(29.02±3.22)%,差异有统计学意义(P=0.002, P=0.003)。PBS组与shGFPctrl组间不存在统计学差异(P=0.125),见图 5。
|
| 图 5 流式细胞仪分析药物联用对食管癌干细胞凋亡效果的影响 Figure 5 Effect of shSTAT3 combined with SNX-2112 on apoptosis of esophageal cancer stem cells analyzed by flow cytometry |
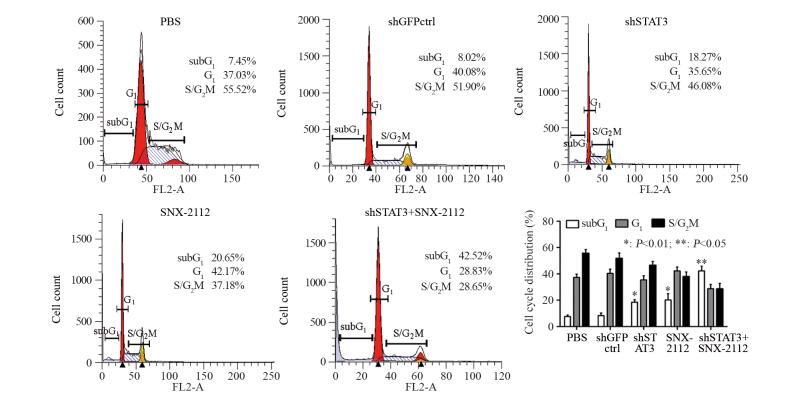
流式细胞仪分析显示,当食管癌干细胞被shSTAT3作用后,subG1比例为(18.27±3.42)%,当被SNX-2112作用后,subG1比例为(20.65±2.89)%,当被shSTAT3与SNX-2112联合作用后,细胞的subG1比例为(42.52±4.51)%,联合用药组与shSTAT3单独用药组、SNX-2112单独用药组差异有统计学意义(P=0.0001, P=0.0004),见图 6。结果表明,沉默STAT3显著增强SNX-2112诱导食管癌干细胞的subG1比例,凋亡细胞率显著增加。
|
| 图 6 流式细胞仪分析药物联用对食管癌干细胞亚G1期的影响 Figure 6 Effect of shSTAT3 combined with SNX-2112 on subG1 phase of esophageal cancer stem cells analyzed by flow cytometry |
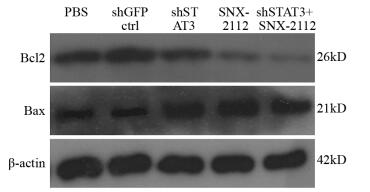
相较于PBS组,SNX-2112作用组Bcl2蛋白表达水平显著降低((0.25±0.03)vs.(0.85±0.08), P=0.00025),Bax水平提高((0.98±0.09)vs.(0.25±0.04), P=0.0032); 同样相较于shGFPctrl组,沉默STAT3降低Bcl2蛋白水平((0.33±0.08)vs.(0.96±0.07), P=0.0018),Bax表达水平提高((0.93±0.06)vs.(0.26±0.04), P=0.00093)。当食管癌干细胞受到两者联合作用时,Bcl2表达水平显著降低(0.11±0.03)(P=0.0046),Bax水平提高(0.98±0.07)(P=0.0058),见图 7。
|
| 图 7 Western blot分析药物联用对凋亡蛋白Bcl2与Bax水平的影响 Figure 7 Effect of shSTAT3 combined with SNX-2112 on Bcl2 and Bax expression in esophageal cancer stem cells detected by Western blot |
越来越多的证据表明,肿瘤干细胞是肿瘤发生、发展、转移、耐药等恶性行为的种子。肿瘤干细胞是具有启动肿瘤发生性质的一小部分细胞。美国科学家最早发现白血病干细胞的存在,提出了“白血病干细胞等级学说”模型[11]。后来,逐渐在其他类型肿瘤组织中发现有肿瘤干细胞的存在,如胶质瘤[12]、乳腺癌[13]、结肠癌[14]、胰腺癌[15]等。根据这些研究,肿瘤疾病的治疗在于是否能够消除肿瘤干细胞的存在。
3.1 肿瘤干细胞与食管癌干细胞肿瘤干细胞的获取通常有三种方法:(1)通过细胞表面标志物,如胶质瘤干细胞CD133[12]、胃癌干细胞CD90[16];(2)通过流式细胞仪分选侧群细胞(side population)[17];(3)通过无血清悬浮培养[18]。肿瘤干细胞学说认为临床肿瘤疾病治疗的失败主要归因于肿瘤干细胞的存在。肿瘤干细胞受到多种因素的调控,如肿瘤微环境、干性因子Nanog、Oct4、Sox2、Bmi-1及STAT3。如Bmi-1通过Nanog调控乳腺癌细胞的自我更新、上皮间质转化[19]。再如Nanog对于胶质瘤干细胞的性质也是重要的,沉默Nanog能够有效抑制胶质瘤干细胞的克隆形成能力、体内成瘤能力等[20]。除此之外,通过联合抑制Nanog以及Oct4能够有效抑制口腔癌干细胞的耐药、转移等性质[21]。Lu等的研究显示,敲除Nanog与Oct4降低胰腺癌干性性质,如转移能力与成瘤能力[22]。STAT3对于胚胎干细胞以及造血干细胞自我更新的信号通路是至关重要的[23-24]。在肿瘤细胞、肿瘤干细胞中STAT3同样也起到重要的生物学作用,如有作者直接把STAT3看作癌基因[25]。STAT3与肿瘤干细胞的EMT能力有重要关系[26]。以上研究结果表明,STAT3等干性因子对肿瘤干细胞的增殖、成瘤等性质是不可或缺的。
3.2 STAT3与肿瘤细胞、肿瘤干细胞的关系STATs家族包含七个成员,分别是:STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6。不论是对正常细胞还是肿瘤细胞,STAT3都起到重要的生长调控作用。STAT3的异常活化不仅在食管癌干细胞被发现,在其他肿瘤细胞如胶质瘤、白血病、乳腺癌、肝癌、前列腺癌也存在异常活化的情况。有研究表明,在肿瘤细胞异常活化的STAT3不仅提高了抗凋亡蛋白(Bcl-xL、Mcl-1)的水平,还提高了细胞周期调控蛋白(cyclin D1、c-Myc)的表达水平[27]。因此,组成性活化STAT3的肿瘤细胞对凋亡信号以及其他能够引起凋亡信号的化疗药物有一定的抵抗性。尽管如此,还是有很多针对STAT3异常活化的化合物被设计及开发出来。这些药物在临床前期显示出一定的抗肿瘤效果[5]。
STAT3对于调控肿瘤干细胞的表型基因以及标志物基因有重要作用[27],常见的肿瘤干细胞标志物如CD24、CD34、CD38、CD44、CD90、CD133以及乙醛脱氢酶[28]。Zhang等研究显示,STAT3更倾向于表达在肿瘤干细胞[29]。在三阴性乳腺癌中STAT3与Her2的表达呈正相关的关系,并且发现STAT3的激活与乳腺癌干细胞的干性性质具有相关性[30]。在我们以往的研究中发现STAT3在食管癌干细胞也是异常活化表达[10]。STAT3的Y705与S721发生磷酸化会导致STAT3转变为pSTAT3,pSTAT3入核介导基因的表达与调控,如mRNA转录[7]。本研究中发现沉默STAT3后降低了其磷酸化活化蛋白的表达量,增强了SNX-2112诱导食管癌干细胞凋亡。
3.3 Hsp90与肿瘤细胞、肿瘤干细胞的关系Hsp90是高度保守的分子伴侣蛋白,主要调控其客户蛋白达到正确的构象,参与肿瘤细胞的增殖、耐药、转移、侵袭等。Hsp90的客户蛋白主要包括激酶以及转录因子[31]。与传统的肿瘤单一靶点药物相比,Hsp90抑制剂能够抑制多条信号通路从而阻断肿瘤细胞以及肿瘤干细胞的增殖、存活等细胞生物学行为[32]。肿瘤干细胞的众多信号通路需要Hsp90的参与,这意味着将Hsp90抑制剂开发成抗肿瘤干细胞药物具有很大的可行性。Subramanian等研究指出,Hsp90抑制剂KU711能够有效抑制头颈癌干细胞增殖,细胞标志物蛋白CD44、乙醛脱氢酶、干性因子Bmi-1表达量显著降低[33]。本研究发现Hsp90抑制剂能够有效诱导食管癌干细胞凋亡,在沉默STAT3的情况下这一效果更加明显。
综上所述,本实验主要研究了沉默STAT3增强了Hsp90抑制剂SNX-2112诱导食管癌干细胞凋亡的效果。研究结果提示,STAT3与SNX-2112联用可能为食管癌的临床治疗提供新的思路。
作者贡献
徐单单:实验研究的设计,细胞周期与Western blot实验,文章撰写及后续修改
陈素红:凋亡实验、克隆形成实验
王 颖:细胞增殖活性分析以及文章的修改
| [1] | Kono K, Mimura K, Yamada R, et al. Current status of cancer immunotherapy for esophageal squamous cell carcinoma[J]. Esophagus, 2018, 15(1): 1–9. DOI:10.1007/s10388-017-0596-2 |
| [2] | Yang MH, Imrali A, Heeschen C. Circulating cancer stem cells: the importance to select[J]. Chinese J Cancer Res, 2015, 27(5): 437–49. |
| [3] | Uthaya Kumar DB, Chen CL, Liu JC, et al. TLR4 signaling via NANOG cooperates with STAT3 to activate twist1 and promote formation of tumor-initiating stem-like cells in livers of mice[J]. Gastroenterology, 2016, 150(3): 707–19. DOI:10.1053/j.gastro.2015.11.002 |
| [4] | Kaneko S, Nakatani Y, Takezaki T, et al. Ceacam1L modulates STAT3 signaling to control the proliferation of glioblastoma-initiating cells[J]. Cancer Res, 2015, 75(19): 4224–34. DOI:10.1158/0008-5472.CAN-15-0412 |
| [5] | Page BD, Ball DP, Gunning PT. Signal transducer and activator of transcription 3 inhibitors: a patent review[J]. Expert Opin Ther Pat, 2011, 21(1): 65–83. DOI:10.1517/13543776.2011.539205 |
| [6] | Zong CS, Chan J, Levy DE, et al. Mechanism of STAT3 activation by insulin-like growth factor I receptor[J]. J Biol Chem, 2000, 275(20): 15099–105. DOI:10.1074/jbc.M000089200 |
| [7] | Galoczova M, Coates P, Vojtesek B. STAT3, stem cells, cancer stem cells and p63[J]. Cell Mol Biol Lett, 2018, 23: 12. DOI:10.1186/s11658-018-0078-0 |
| [8] | Zhang G, Liu Z, Ding H, et al. Tumor induces muscle wasting in mice through releasing extracellular Hsp70 and Hsp90[J]. Nat Commun, 2017, 8(1): 589. DOI:10.1038/s41467-017-00726-x |
| [9] | Osada T, Kaneko K, Gwin WR, et al. In vivo detection of HSP90 identifies breast cancers with aggressive behavior[J]. Clin Cancer Res, 2017, 23(24): 7531–42. DOI:10.1158/1078-0432.CCR-17-1453 |
| [10] | Xu DD, Zhou PJ, Wang Y, et al. Reciprocal activation between STAT3 and miR-181b regulates the proliferation of esophageal cancer stem-like cells via the CYLD pathway[J]. Moll Cancer, 2016, 15(1): 40. |
| [11] | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J]. Nat Med, 1997, 3(7): 730–7. DOI:10.1038/nm0797-730 |
| [12] | Singh SK, Clarke ID, Terasaki M, et al. Identification of a cancer stem cell in human brain tumors[J]. Cancer Res, 2003, 63(18): 5821–8. |
| [13] | Ponti D, Costa A, Zaffaroni N, et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties[J]. Cancer Res, 2005, 65(13): 5506–11. DOI:10.1158/0008-5472.CAN-05-0626 |
| [14] | Ricci-Vitiani L, Lombardi DG, Pilozzi E, et al. Identification and expansion of human colon-cancer-initiating cells[J]. Nature, 2007, 445(7123): 111–5. DOI:10.1038/nature05384 |
| [15] | Li C, Heidt DG, Dalerba P, et al. Identification of pancreatic cancer stem cells[J]. Cancer Res, 2007, 67(3): 1030–7. DOI:10.1158/0008-5472.CAN-06-2030 |
| [16] | Tang KH, Dai YD, Tong M, et al. A CD90(+) tumor-initiating cell population with an aggressive signature and metastatic capacity in esophageal cancer[J]. Cancer Res, 2013, 73(7): 2322–32. DOI:10.1158/0008-5472.CAN-12-2991 |
| [17] | Prince ME, Sivanandan R, Kaczorowski A, et al. Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma[J]. Proc Natl Acad Sci U S A, 2007, 104(3): 973–8. DOI:10.1073/pnas.0610117104 |
| [18] | Zhang G, Ma L, Xie YK, et al. Esophageal cancer tumorspheres involve cancer stem-like populations with elevated aldehyde dehydrogenase enzymatic activity[J]. Mol Med Rep, 2012, 6(3): 519–24. DOI:10.3892/mmr.2012.939 |
| [19] | Paranjape AN, Balaji SA, Mandal T, et al. Bmi1 regulates self-renewal and epithelial to mesenchymal transition in breast cancer cells through Nanog[J]. BMC Cancer, 2014, 14: 785. DOI:10.1186/1471-2407-14-785 |
| [20] | Zbinden M, Duquet A, Lorente-Trigos A, et al. NANOG regulates glioma stem cells and is essential in vivo acting in a cross-functional network with GLI1 and p53[J]. EMBO J, 2010, 29(15): 2659–74. DOI:10.1038/emboj.2010.137 |
| [21] | Chiou SH, Yu CC, Huang CY, et al. Positive correlations of Oct-4 and Nanog in oral cancer stem-like cells and high-grade oral squamous cell carcinoma[J]. Clin Cancer Res, 2008, 14(13): 4085–95. DOI:10.1158/1078-0432.CCR-07-4404 |
| [22] | Lu Y, Zhu H, Shan H, et al. Knockdown of Oct4 and Nanog expression inhibits the stemness of pancreatic cancer cells[J]. Cancer Lett, 2013, 340(1): 113–23. DOI:10.1016/j.canlet.2013.07.009 |
| [23] | Raz R, Lee CK, Cannizzaro LA, et al. Essential role of STAT3 for embryonic stem cell pluripotency[J]. Proc Natl Acad Sci U S A, 1999, 96(6): 2846–51. DOI:10.1073/pnas.96.6.2846 |
| [24] | Chung YJ, Park BB, Kang YJ, et al. Unique effects of Stat3 on the early phase of hematopoietic stem cell regeneration[J]. Blood, 2006, 108(4): 1208–15. DOI:10.1182/blood-2006-01-010199 |
| [25] | Bromberg JF, Wrzeszczynska MH, Devgan G, et al. Stat3 as an oncogene[J]. Cell, 1999, 98(3): 295–303. DOI:10.1016/S0092-8674(00)81959-5 |
| [26] | Mani SA, Guo W, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133(4): 704–15. DOI:10.1016/j.cell.2008.03.027 |
| [27] | Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer: Role of synthetic and natural inhibitors[J]. Biochim Biophys Acta, 2014, 1845(2): 136–54. |
| [28] | Pattabiraman DR, Weinberg RA. Tackling the cancer stem cells- what challenges do they pose?[J]. Nat Rev Drug Discov, 2014, 13(7): 497–512. DOI:10.1038/nrd4253 |
| [29] | Zhang HF, Chen Y, Wu C, et al. The Opposing Function of STAT3 as an Oncoprotein and Tumor Suppressor Is Dictated by the Expression Status of STAT3beta in Esophageal Squamous Cell Carcinoma[J]. Clin Cancer Res, 2016, 22(3): 691–703. DOI:10.1158/1078-0432.CCR-15-1253 |
| [30] | Zhou J, Wulfkuhle J, Zhang H, et al. Activation of the PTEN/mTOR/STAT3 pathway in breast cancer stem-like cells is required for viability and maintenance[J]. Proc Natl Acad Sci U S A, 2007, 104(41): 16158–63. DOI:10.1073/pnas.0702596104 |
| [31] | Soudry E, Stern Shavit S, Hardy B, et al. Heat shock proteins HSP90, HSP70 and GRP78 expression in medullary thyroid carcinoma[J]. Ann Diagn Patho, 2017, 26: 52–6. DOI:10.1016/j.anndiagpath.2016.11.003 |
| [32] | Nahleh Z, Tfayli A, Najm A, et al. Heat shock proteins in cancer: targeting the 'chaperones'[J]. Future Med Chem, 2012, 4(7): 927–35. DOI:10.4155/fmc.12.50 |
| [33] | Subramanian C, Kovatch KJ, Sim MW, et al. Novel C-terminal heat shock protein 90 inhibitors (KU711 and Ku757) are effective in targeting head and neck squamous cell carcinoma cancer stem cells[J]. Neoplasia, 2017, 19(12): 1003–11. DOI:10.1016/j.neo.2017.09.003 |
 2019, Vol. 46
2019, Vol. 46


