文章信息
- 新辅助化疗与辅助化疗治疗肌层浸润性膀胱癌的疗效比较
- Clinical Outcomes of Neoadjuvant Versus Adjuvant Chemotherapy on Muscle-invasive Bladder Cancer
- 肿瘤防治研究, 2019, 46(4): 363-366
- Cancer Research on Prevention and Treatment, 2019, 46(4): 363-366
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1002
- 收稿日期: 2018-10-22
- 修回日期: 2018-11-21
辅助化疗的疗效已经得到肯定并且被广泛使用。全膀胱术后进行辅助化疗的目的是减少局部或远处复发[1]。但是其缺点在于可能延误对微转移灶的清除以及碍于全膀胱手术的并发症而无法给予全量化疗[2]。目前,多个回顾性研究证实了辅助化疗可以显著提高无复发生存率和总生存期[3-6]。但是由于证据级别较低,辅助化疗还不能作为全膀胱术后的标准治疗方案[7]。此外,在乳腺癌等疾病中,有研究已经证实了新辅助和辅助化疗具有相同的疗效[8]。然而,在肌层浸润性膀胱癌中还没有相关报道。仅有的几项回顾性研究比较了新辅助和辅助化疗的疗效,但是使用的化疗方案并不是常见的GC方案[4-6]。
因此我们提出假设,对于肌层浸润性膀胱癌患者接受全膀胱手术及新辅助或辅助化疗后具有相同的临床疗效。
1 资料与方法 1.1 病例收集收集湖北省肿瘤医院泌尿外科2009年1月—2016年9月诊断为T2-4N0-2M0的38例接受了全膀胱切除+新辅助/辅助化疗(GC方案)的肌层浸润性膀胱癌患者。所有患者在术前进行诊断性电切治疗后均有病理结果证实肌层浸润。非肌层浸润性膀胱癌、有远处转移或合并上尿路肿瘤的患者是主要的排除标准。手术方案为膀胱全切除+盆腔淋巴结清扫,其范围包括髂内、髂外淋巴结、闭孔及髂总淋巴结。
无论是新辅助或辅助方案均为四个周期的GC方案。患者接受吉西他滨(1 000 mg/m2, d1、8、15)+顺铂(70 mg/m2, d1)静脉输液治疗。化疗间隔为4周。每次化疗前所有患者均进行实验室检测,顺铂剂量的调整需要根据血肌酐清除率的数值。当患者白细胞低于2 000/mm3或血小板低于5×104/mm3或3级及以上的非血液性毒性反应时,将调整吉西他滨的使用剂量(第8和15天停用)。
在新辅助化疗组中,患者在接受化疗前需要进行彻底的经尿道膀胱肿瘤电切治疗(TURBT)。所有患者在接受两个周期的化疗后会进行影像学评估,包括腹部和盆腔CT扫描或磁共振扫描。如果没有出现肿瘤缩小,则立即停止新辅助化疗并接受挽救性全膀胱切除术。新辅助化疗后的疗效反应使用RECIST(response evaluation criteria in solid tumor)评分量表完成。
1.2 围手术期评价指标收集分析患者的年龄、性别、既往史、随访时间、病理结果(肿瘤大小、部位、细胞学类型和Fuhrman分级)。此外,主要研究终点为患者的无复发生存率(recurrence-free survival, RFS),次要研究终点为病理完全反应率(pathological complete response, pCR)。患者化疗期间的不良反应也进行了分析。
1.3 统计学方法RFS和qCR使用Kaplan-Meier方法进行比较。两组患者RFS的比较使用Log rank测验方程。组间比较使用χ2检验。两组患者间化疗方案的比较使用Mann-Whitney U检验。P < 0.05表示差异有统计学意义,所有检验均为双侧。统计软件使用SigmaPlot 12.5版本。
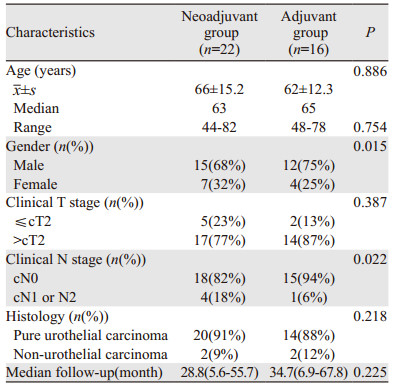
2 结果 2.1 患者临床资料统计新辅助化疗组平均年龄(66±15.2)岁,辅助化疗组(62±12.3)岁。两组患者的性别(P=0.015)和临床淋巴结分期(P=0.022)差异有统计学意义。新辅助化疗组较辅助化疗组患者平均年龄更大、临床分期更低,但是差异无统计学意义。患者的其他临床资料见表 1。
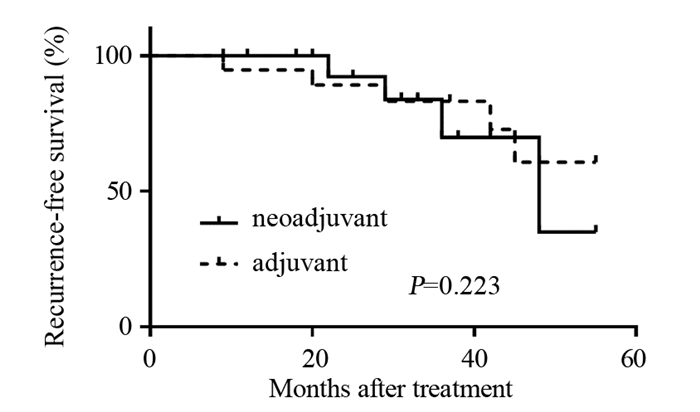
所有患者的平均随访时间为30.6月,两组间平均随访时间(新辅助28.8月vs.辅助34.7月)相比差异无统计学意义(P=0.225)。在随访时间内,有13例患者(新辅助8例,辅助5例)出现复发或远处转移。患者术后的生存情况见图 1,新辅助化疗和辅助化疗组在中位随访时间的RFS分别是69.6%和75.4%,组间比较差异无统计学意义(P=0.223)。
|
| 图 1 肌层浸润性膀胱癌患者接受新辅助或辅助化疗后的生存曲线图 Figure 1 Kaplan-Meier survival curves of muscle-invasive bladder cancer patients who received neoadjuvant and adjuvant chemotherapy |
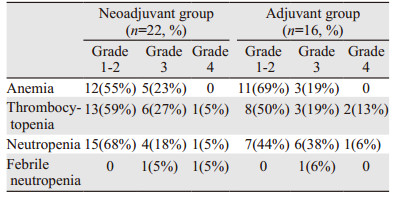
GC方案化疗后血液学不良反应较常见,在辅助化疗组中,有3例患者出现严重的贫血症状、5例出现严重的血小板减少症、7例出现严重的中性粒细胞减少症。相对应地,在新辅助化疗组中的患者分别是5例、7例和5例。组间比较差异均无统计学意义(P=0.36),见表 2。
|
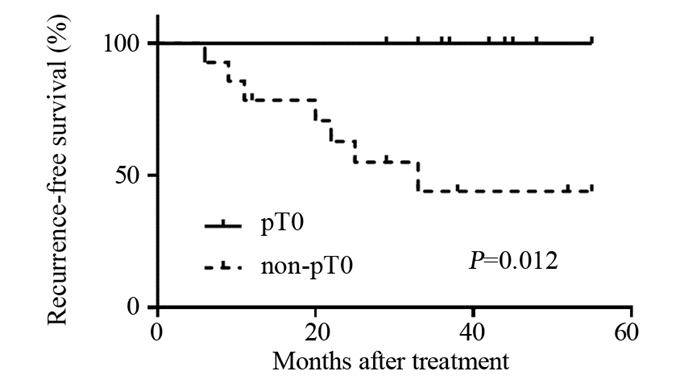
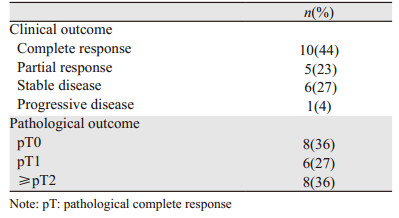
接受新辅助化疗患者的临床缓解率及病理缓解率见表 3。其中临床完全缓解率(complete response, CR)+部分缓解率(partial response, PR)为68%(15/22),临床完全缓解率CR为45%(10/22)。有1例患者在接受两周期新辅助化疗后疾病进展而判定为疾病进展(progression disease, PD),随后终止化疗并立即接受了挽救性全膀胱切除手术。患者接受新辅助化疗后的病理完全缓解率(pT0)和降期率(< pT2)分别为36%(8/22)和64%(14/22)。所有达到病理完全缓解pT0的患者中均没有出现疾病复发,见图 2。其中在中位随访时间上,pT0和non-pT0组的RFS分别为100%和50%(P=0.012),差异有统计学意义。此外,接受辅助化疗的患者中没有1例达到pT0。
|
| 图 2 肌层浸润性膀胱癌患者接受新辅助化疗治疗后病理完全缓解组(pT0)与非完全缓解组(non-pT0)生存曲线图 Figure 2 Kaplan-Meier survival curves of muscle-invasive bladder cancer patients who achieved pathological complete response (pT0) and non-pT0 in neoadjuvant group |
|
术后病理标本分析,在新辅助化疗和辅助化疗组中分别发现了6例和5例盆腔淋巴结阳性的患者,差异无统计学意义(27% vs. 31%, P=0.46)。
3 讨论围手术期化疗,尤其是新辅助化疗可以显著提高肌层浸润性膀胱癌患者的生存期[8]。基于已有的高级别循证医学证据,新辅助化疗已经越来越多地得到认可并在各医学中心广泛开展[9-12]。几乎所有的临床研究均使用了以铂类为基础的化疗方案,如MAVC(甲氨蝶呤、长春碱、多柔比星和顺铂)方案,我们使用了同样是指南一线推荐的GC(吉西他滨,顺铂)方案[2, 6, 13-14]。遗憾的是,目前尚缺乏大规模的GC方案在肌层浸润性膀胱癌中的随机对照临床研究治疗效果[15]。尽管如此,在国内各大医学中心均已常规应用GC方案治疗肌层浸润性膀胱癌[11]。
本研究的目的是比较GC方案新辅助和辅助化疗的疗效差别。结果显示两组患者在接受围手术期化疗及手术治疗后的RFS差异无统计学意义。我们推测首先两组患者使用的化疗药物疗效相同,其次GC方案是指南认可的一线化疗方案。同样,与以往的回顾性研究结果类似,新辅助和辅助化疗的疗效没有差别[9, 12, 15]。当然,这些研究中使用的化疗方案各不相同,GC方案只占35%[9]。
GC方案和MVAC方案均被指南推荐为一线化疗方案,本研究采用GC方案是因为该方案的不良反应更小、耐受性好而且疗效相同[6, 16]。患者接受度高是保证围手术期化疗顺利完成的重要因素。本研究中,仅有一例患者因为疾病进展而终止了新辅助化疗,同时所有患者的血液学不良反应与以往的报道[17]基本相同。表现出了GC方案良好的耐受性及较小的不良反应。
pCR概念的引入是为了更好的评价新辅助化疗的疗效,与主要研究终点RFS一样,用来分析两组间的生存差异。根据西南肿瘤学组8710研究的结论,达到pT0患者的平均总生存期为13.6年[11]。本研究中,患者在接受新辅助化疗后的病理完全缓解率(pT0)和降期率(< pT2)分别为36%(8/22)和64%(14/22),所有达到pT0的患者均没有出现肿瘤复发。这说明pCR是一个理想的研究终点,尤其是当研究对象为评价新辅助化疗药物疗效时。
本研究的局限性表现在回顾性研究的内在缺陷,样本量相对较少、单中心研究、随访时间相对较短。此外,由于回顾性研究的本质决定了患者没有被随机分组,由此导致了化疗时机选择上的偏倚。因此,在随后的研究中,我们将设计前瞻性、随机、对照临床研究,并延长随访时间以填补本研究中存在的缺陷。
作者贡献
邓康俐: 论文撰写
崔殿生: 论文设计
贾全安: 论文修订
刘三河: 统计分析
黄雷: 数据收集
魏少忠: 论文指导
| [1] | Stein JP, Lieskovsky G, Cote R, et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1, 054 patients[J]. J Clin Oncol, 2001, 19(3): 666–75. |
| [2] | Millikan R, Dinney C, Swanson D, et al. Integrated therapy for locally advanced bladder cancer: final report of a randomized trial of cystectomy plus adjuvant M-VAC versus cystectomy with both preoperative and postoperative M-VAC[J]. J Clin Oncol, 2001, 19(20): 4005–13. DOI:10.1200/JCO.2001.19.20.4005 |
| [3] | Scosyrev E, Messing EM, van Wijngaarden E, et al. Neoadjuvant gemcitabine and cisplatin chemotherapy for locally advanced urothelial cancer of the bladder[J]. Cancer, 2012, 118(1): 72–81. DOI:10.1002/cncr.26238 |
| [4] | Sherif A, Holmberg L, Rintala E, et al. Neoadjuvant cisplatinum based combination chemotherapy in patients with invasive bladder cancer: a combined analysis of two Nordic studies[J]. Eur Urol, 2004, 45(3): 297–303. DOI:10.1016/j.eururo.2003.09.019 |
| [5] | Sherif A, Rintala E, Mestad O, et al. Neoadjuvant cisplatin-methotrexate chemotherapy for invasive bladder cancer-Nordic cystectomy trial 2[J]. Scand J Urol Nephrol, 2002, 36(6): 419–25. DOI:10.1080/003655902762467567 |
| [6] | von der Maase H, Hansen SW, Roberts JT, et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase Ⅲ study[J]. J Clin Oncol, 2000, 18(17): 3068–77. DOI:10.1200/JCO.2000.18.17.3068 |
| [7] | Montie JE, Bahnson RR, Cohen SM, et al. Bladder cancer. Clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2005, 3(1): 4–34. |
| [8] | Mauri D, Pavlidis N, Ioannidis JP. Neoadjuvant versus adjuvant systemic treatment in breast cancer: a meta-analysis[J]. J Natl Cancer Inst, 2005, 97(3): 188–94. DOI:10.1093/jnci/dji021 |
| [9] | Advanced Bladder Cancer Meta-analysis C. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration[J]. Eur Urol, 2005, 48(2): 202-5; discussion 205-6. https://www.onacademic.com/detail/journal_1000035044538010_921e.html |
| [10] | Dash A, Pettus JAt, Herr HW, et al. A role for neoadjuvant gemcitabine plus cisplatin in muscle-invasive urothelial carcinoma of the bladder: a retrospective experience[J]. Cancer, 2008, 113(9): 2471–7. DOI:10.1002/cncr.v113:9 |
| [11] | Grossman HB, Natale RB, Tangen CM, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer[J]. N Engl J Med, 2003, 349(9): 859–66. |
| [12] | Kaneko G, Kikuchi E, Matsumoto K, et al. Neoadjuvant gemcitabine plus cisplatin for muscle-invasive bladder cancer[J]. Jpn J Clin Oncol, 2011, 41(7): 908–14. DOI:10.1093/jjco/hyr068 |
| [13] | Lin HY, Ye H, Kernen KM, et al. National Cancer Database Comparison of Radical Cystectomy vs. Chemoradiotherapy for Muscle-Invasive Bladder Cancer: Implications of Using Clinical vs. Pathologic Staging[J]. Cancer Med, 2018, 7(11): 5370–81. DOI:10.1002/cam4.2018.7.issue-11 |
| [14] | Rudzinski JK, Basappa NS, North S. Perioperative chemotherapy for muscle invasive bladder cancer[J]. Curr Opin Support Palliat Care, 2015, 9(3): 249–54. |
| [15] | Advanced Bladder Cancer Meta-analysis C. Neoadjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis[J]. Lancet, 2003, 361(9373): 1927–34. |
| [16] | Wosnitzer MS, Hruby GW, Murphy AM, et al. A comparison of the outcomes of neoadjuvant and adjuvant chemotherapy for clinical T2-T4aN0-N2M0 bladder cancer[J]. Cancer, 2012, 118(2): 358–64. DOI:10.1002/cncr.26278 |
| [17] | Okabe K, Shindo T, Maehana T, et al. Neoadjuvant chemotherapy with gemcitabine and cisplatin for muscle-invasive bladder cancer: multicenter retrospective study[J]. Jpn J Clin Oncol, 2018, 48(10): 934–41. |
 2019, Vol. 46
2019, Vol. 46