文章信息
- siRNA干扰VRK1表达对食管癌细胞BANF1蛋白表达及增殖迁移能力的抑制作用
- Down-regulation of VRK1 Expression by siRNA Suppresses BANF1 Expression and Proliferation and Migration Abilities of Esophageal Squamous Cell Carcinoma Cells
- 肿瘤防治研究, 2019, 46(1): 14-19
- Cancer Research on Prevention and Treatment, 2019, 46(1): 14-19
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0941
- 收稿日期: 2018-07-10
- 修回日期: 2018-10-15
2. 450052 郑州,河南中医药大学第二附属医院检验科;
3. 450052 郑州,郑州大学医学检验系
2. Department of Clinical Laboratory, The Second Affiliated Hospital of He'nan University of Traditional Chinese Medicine, Zhengzhou 450002, China;
3. Department of Medical Examination, Zhengzhou University, Zhengzhou 450052, China
食管癌是一种常见的消化系统恶性肿瘤,发病率居世界恶性肿瘤第六位,主要以食管鳞癌为主[1-3]。治疗方法为以手术为主的综合治疗,但患者五年生存率较低。抑制肿瘤的复发和转移是提高食管癌生存率的关键[4-7]。牛痘病毒相关性激酶1(vaccinia virus associated kinase 1, VRK1)是哺乳动物体内有丝分裂相关激酶家族成员之一,可以通过磷酸化修饰的形式参与多种细胞生理活动[8]。研究表明,VRK1表达对正常组织或恶性组织中细胞系的增殖和存活具有显著调控作用[9-11]。BAF蛋白由屏障自整合因子1(barrier integration factor1, BANF1)基因编码,是有丝分裂核重组、调节反转录病毒的整合前复合体稳定性、调节转录功能的必需蛋白质[12-13]。已有研究表明BANF1是VRK1蛋白激酶的一种具有高度亲和力的底物,VRK1可以介导BAF蛋白的磷酸化[14]。基于这些研究,我们认为VRK1和BANF1二者可在癌细胞的生理学过程中发挥重要的协同作用。
我们前期研究发现,VRK1及BANF1在食管鳞癌组织中表达升高,其高表达在食管鳞状细胞癌的病程进展中具有正相关作用,并且与不良预后相关[15-16]。为验证该作用,我们进一步通过体外培养食管癌细胞株EC109和EC1,利用小干扰RNA下调VRK1的表达,探究干扰后食管癌细胞BANF1表达及食管鳞癌细胞的增殖及迁移能力的改变,为食管癌靶向治疗提供新的思路和依据。
1 材料与方法 1.1 材料 1.1.1 细胞系食管癌EC109、EC1细胞系购自上海生工生物工程有限公司。细胞在含有10%胎牛血清(不含抗生素)RPMI1640培养基(上海生工生物工程有限公司)中,置于5%CO2、37℃的细胞培养箱中培养,当细胞密度达到80%~90%时,用0.25%胰酶-EDTA(上海生工生物工程有限公司)进行消化并传代。
1.1.2 主要试剂及仪器RPMI1640培养基、标准胎牛血清(FBS)、Lipofectamine2000均购自上海生工生物工程有限公司;设计合成的siRNA176、siRNA571、siRNA862及对照siRNA购自上海Gene Pharma公司;兔抗人牛痘病毒相关激酶1抗体(一抗)、兔抗人障碍自整合蛋白BAF抗体(一抗)、羊抗兔辣根酶标记IgG(二抗)和流式相关抗体均购自北京博奥森生物技术有限公司;CCK-8试剂盒购自日本同仁化学研究所。多功能酶标仪购自美国MD公司,UVP凝胶电泳拍摄及分析系统购自美国GENE公司,流式细胞仪购自美国Beckman公司;荧光倒置显微镜购自日本Nikon公司。
1.2 方法 1.2.1 细胞转染分别取对数生长期的食管鳞癌EC109、EC1细胞,按4×105个每孔接种于六孔板,5%CO2、37℃的细胞培养箱中培养过夜,细胞融合度约70%时,按产品使用手册进行转染。其中实验组滴加siRNA-Lipofectamine2000混合液500 μl(siRNA浓度为20 μmol/L,siRNA571合成序列为正义链5’-GCAGCUAAGCUUAAGAAUUTT-3’;反义链5’-AAUUCUUAAGCUUAGCUGCTT-3’),阴性对照组则使用无义siRNA(正义链5’-UUCUCCGAACGUGUCACGUTT-3’,反义链5’-ACGUGACACGUUCGGAGAATT-3’)进行转染,单纯脂质体转染作为空白对照组,8字法混匀后放回培养箱。转染5 h后,更换为带血清培养基,转染完成。
1.2.2 Western blot实验检测siRNA干扰后食管癌细胞VRK1和BANF1的表达水平转染完成24 h后,收集各组EC109和EC1细胞系,用冷却的PBS缓冲液冲洗3次,各孔加含有PMSF的RIPA细胞裂解液200 μl,再收集细胞匀浆粉碎,4℃ 13 000 r/min离心15 min,提取细胞内总蛋白,BCA法测定蛋白浓度。制胶后每孔上样30 ng进行免疫电泳,转膜封闭后,与一抗孵育(1:1 000稀释4℃孵育过夜),洗涤(TBST洗涤3次,每次10 min)后,与二抗孵育(1:4 000稀释,室温孵育1 h),洗涤后进行显影,经UVP凝胶成像扫描分析仪成像拍照,用Image J软件对图像进行灰度分析计算蛋白相对表达量(目的蛋白的表达量与内参照GAPDH表达量的比值)。
1.2.3 CCK-8实验检测siRNA干扰后食管癌细胞增殖能力的改变转染12 h后,分别对实验组和阴性对照组进行细胞计数,稀释后,每孔取500个细胞,铺至96孔板中,每组设三个平行孔,周围空白孔,加入PBS防止蒸发。检测时间点间隔12 h,测试三天,CCK-8检测前,加入混合好的110 μl CCK-8混合液(100 μl新鲜培养基+10 μl CCK-8原液)。孵育2 h后,用酶标仪检测450 nm处的吸光度值(OD450)。增殖抑制率(%)=(OD空白对照组-OD实验组)/ OD空白组×100%。
1.2.4 流式细胞仪检测siRNA干扰对食管癌细胞周期的影响转染12 h后,取对数期细胞,计数,取1 ml细胞悬液(细胞数1×106/ml),2 000 r/min离心5 min后,使用PBS冲洗细胞两次,除去上清液后,加入500 μl 70%的冰乙醇,4℃固定细胞过夜。染色前,1 000 r/min离心5 min去除上清注液后,加入PBS冲洗细胞一次,加入100 μl RNaseA(1 mg/ml)和400 μl PI(500 μg/ml)37℃水浴30 min。上机检测,激发波长为488 nm处的红色荧光。
1.2.5 Transwell细胞体外侵袭实验检测siRNA干扰后食管癌细胞迁移能力的改变待转染完成后,当EC109和EC1细胞系实验组与阴性对照组细胞密度达到90%左右,铺至24孔板中。细胞计数,使用无血清培养基Opti-MEM冲悬细胞,使细胞密度达到1×104个每毫升,每室加入300 μl DMEM培养基(即3 000个细胞)。下室加入含血清的DMEM培养基600 μl。置培养箱内,12 h后检测细胞迁移。使用棉棒将上室细胞擦除,将小室泡在结晶紫染液中,待细胞染色即可观察。显微镜下随机选取3个视野,统计小室的细胞迁移数,取其平均值进行统计分析。
1.3 统计学方法所有实验数据均采用SPSS21.0软件包对数据进行统计学分析,采用单因素方差分析进行多组间比较,P < 0.05为差异有统计学意义。
2 结果 2.1 蛋白免疫印迹筛选siRNA-VRK1干扰效果及检测干扰前后BANF1蛋白表达实验通过不同siRNA干扰食管癌细胞VRK1表达,结果发现siRNA571干扰效果最佳,故后续实验均使用siRNA571。转染siRNA-VRK1后,EC109和EC1两种细胞系的空白对照组及阴性对照组VRK1蛋白的表达差异无统计学意义。siRNA干扰组VRK1蛋白的表达显著低于空白组及阴性对照组,分别下降62.40%和52.14%,差异有统计学意义(F=14.23, P < 0.05),见图 1。干扰VRK1表达后进一步分析BANF1的表达情况,结果显示EC109和EC1两种细胞系的空白对照组及阴性对照组BANF1蛋白的表达差异无统计学意义。siRNA干扰组的BANF1蛋白表达较空白组及阴性对照组减低,分别下降24.51%和52.87%,差异有统计学意义(F=6.13, P < 0.05),见图 2。
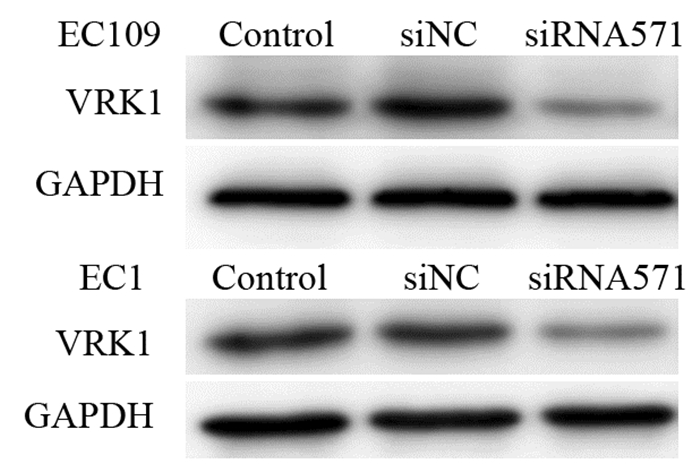
|
| Control: blank control group; siNC: negative control group; siRNA: experimental group 图 1 Western blot法检测两种食管癌细胞株VRK1的表达 Figure 1 VRK1 expression in esophageal cancer EC109 and EC1 cell lines measured by Western blot |
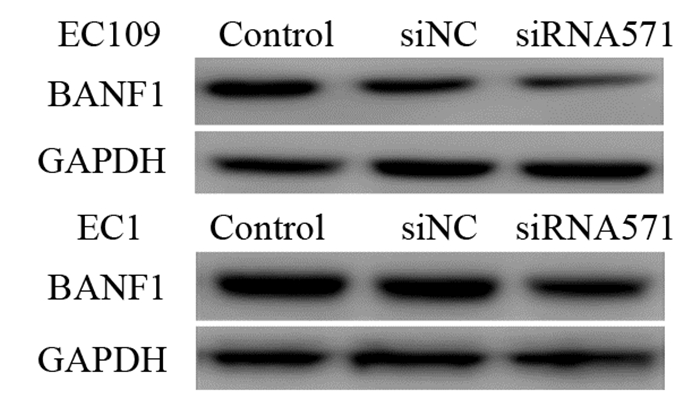
|
| 图 2 Western blot法检测两种食管癌细胞株BANF1的表达 Figure 2 BANF1 expression in esophageal cancer EC109 and EC1 cell lines measured by Western blot |
结果显示,siRNA571干扰食管癌EC109和EC1细胞后,细胞增殖较阴性对照组低,均为转染12 h后细胞增殖开始受到抑制,36 h抑制率最高,分别为19.41%(t=4.231, P < 0.05)和20.10%(t=5.131, P < 0.05),见图 3。
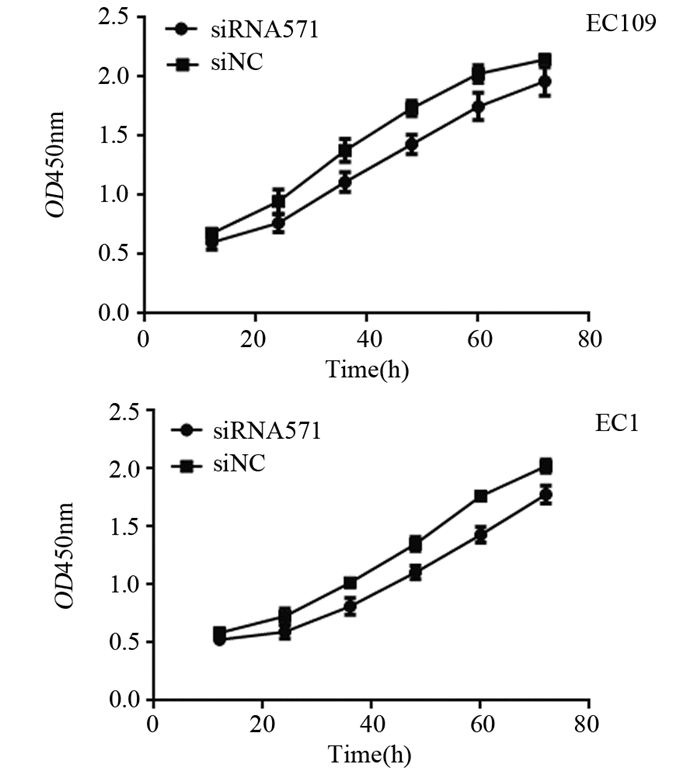
|
| 图 3 EC109和EC1细胞siRNA571和siNC组细胞增殖曲线 Figure 3 Growth curves of EC109 and EC1 cells in siNC and siRNA571 groups |
EC109细胞系siRNA571干扰组G0/G1期、G2/M期细胞峰值均较阴性对照组降低,差异有统计学意义(P=0.005、P=0.001),siRNA571干扰组S期细胞峰相对于阴性对照组升高,差异有统计学意义(P=0.003)。EC1细胞系也出现相似的结果,siRNA571干扰组G2/M期细胞峰值相比于阴性对照组减低,差异有统计学意义(P=0.022),siRNA571干扰组S期细胞峰值相对于阴性对照组升高,差异有统计学意义(P=0.023),见图 4。
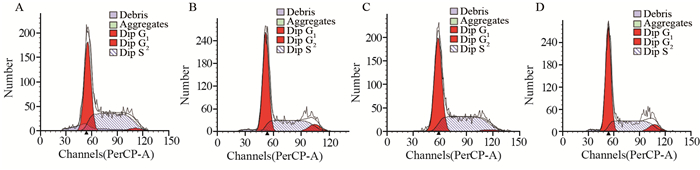
|
| A: VRK1 siRNA interference experimental group of EC109 cells; B: negative control group of EC109 cells; C: VRK1 siRNA interference experimental group of EC1 cells; D: negative control group of EC1 cells 图 4 流式细胞仪检测EC109和EC1细胞实验组与阴性对照组细胞周期分布情况 Figure 4 Cell cycle distribution of EC109 and EC1 cells in experimental group and negative control group detected by flow cytometry |
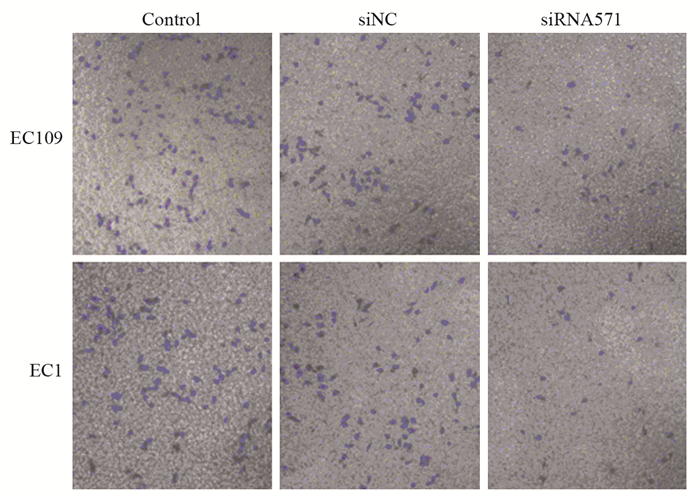
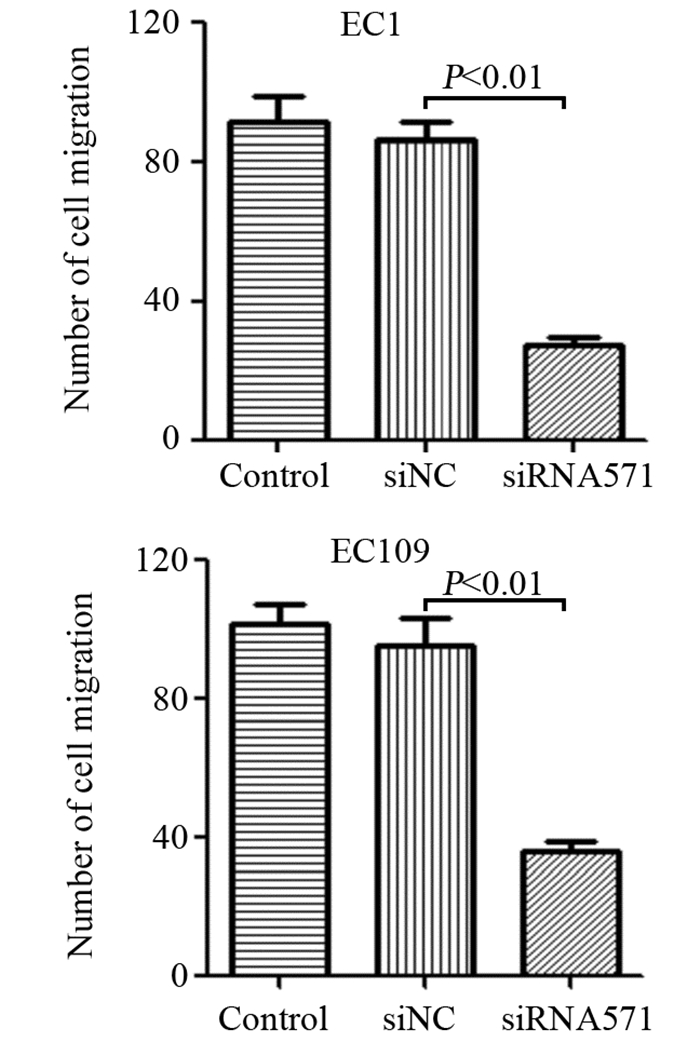
Transwell小室实验结果显示,敲低VRK1后,BANF1表达下调,两种食管鳞癌细胞系迁移细胞个数均下降,见图 5,EC1细胞系中siRNA干扰组细胞迁移数目(36.30±8.08)明显低于阴性对照组及空白对照组(F=122.451, P < 0.01)。EC109细胞系中siRNA干扰组细胞迁移数(38.20±1.43)亦明显低于阴性对照组及空白对照组(F=114.430, P < 0.01),见图 6。
|
| 图 5 EC109和EC1细胞转染12h后迁移能力的改变(×100) Figure 5 Migration abilities of EC109 and EC1 cells after transfection for 12 h (×100) |
|
| 图 6 EC109和EC1各组细胞迁移能力的比较 Figure 6 Comparison of migration abilities of EC109 and EC1 cells among different groups |
近年来,周期蛋白依赖性激酶家族(cyclin-dependent kinases, CDK)和其他相关有丝分裂激酶已经成为肿瘤学分子诊断水平上新兴的热点研究领域,牛痘病毒相关性激酶家族在肿瘤相关疾病研究中开始被逐渐提及[17]。VRK1是细胞周期蛋白D1的一个早期应答基因,其编码的牛痘病毒相关激酶-1是牛痘病毒相关性激酶家族的一员[18],在人体组织中广泛表达,主要定位于细胞核,并在活跃性强的分裂期细胞,如睾丸细胞、胸腺细胞、胎肝细胞和癌细胞[9, 19]中表达水平升高,主要通过磷酸化修饰的方式参与多种细胞生理活动,如染色体凝聚、核膜的分解和重组以及DNA损伤反应等[20],并可以促进具有转录活性的p53蛋白分子的稳定性及核内积累,在体外条件下也可通过磷酸化作用减少p53分子泛素化[10]。因此,该基因具有调节细胞增殖的功能。
目前研究发现,VRK1有可能在多种肿瘤如乳腺癌[21]、肝细胞癌[22]和结直肠癌[23]中发挥着促癌作用,Lee等[11]和Huang等[22]研究发现VRK1在原发性肝细胞癌组织和细胞系中均高表达,并与美国肿瘤研究联合委员会(AJCC)肝癌分级和不良预后密切相关。前期研究发现,VRK1在食管鳞状细胞癌组织中过表达,其高表达在食管鳞状细胞癌的病程进展中可能具有正相关作用,并且与不良预后相关[15-16, 24]。本研究进一步通过体外培养食管癌细胞EC109和EC1,利用siRNA干扰VRK1表达,Western blot检测结果证实下调VRK1表达,CCK-8细胞增殖实验发现VRK1表达下调后细胞增殖能力降低,在VRK1 siRNA转染12 h后,细胞增殖能力开始降低,转染36 h增殖抑制率最高,达20%左右。流式细胞仪检测结果进一步显示,EC109和EC1细胞增殖受到抑制,细胞阻滞在S期即DNA合成期。VRK1不仅可以影响细胞增殖周期,其还可对细胞迁移进行调控,Transwell迁移实验显示干扰VRK1表达后细胞的迁移能力降低,这些细胞功能的改变可能与VRK1参与细胞生理过程有关。细胞异常增殖与迁移是恶性肿瘤发生发展的标志,VRK1下调能够降低癌细胞增殖及迁移能力证实了其在食管癌病程进展中具有一定的促进作用,降低VRK1表达可以抑制食管癌细胞的增殖迁移,有望为食管癌的靶向治疗提供新的靶点。
有研究证明,屏障自身整合因子(BAF蛋白)是VRK1蛋白激酶的高亲和力底物[14],BAF蛋白是由BANF1基因编码,主要定位于细胞核和细胞质,可以在有丝分裂期间与染色体产生特异性结合作用,具有浓缩DNA和组装高级核蛋白复合物的能力,是有丝分裂核重组、调节有丝分裂纺锤体的组装和定位、调节反转录病毒的整合前复合体稳定性、转录调节功能的必需细胞蛋白质。我们前期研究[15-16]发现BANF1在食管鳞癌组织中的表达也明显高于癌旁组织,本研究提出干扰VRK1表达后,食管癌细胞增殖减低可能是由于BANF1蛋白表达下调造成的。Western blot检测干扰VRK1蛋白表达后BANF1蛋白表达降低,同时流式细胞周期检测结果发现,细胞周期在S期即DNA合成期受到较多的阻滞作用,M期分裂期细胞比例下降,以上结果证实,BAF蛋白可能通过调节DNA与核周蛋白的结合以及纺锤丝的组装和定位,使细胞有丝分裂过程异常进行,从而促进肿瘤细胞的发生与发展。同时发现敲低VRK1的表达可以降低细胞BANF1蛋白的表达,初步证实了两者在食管癌细胞生理过程中的协同作用。
我们前期实验发现VRK1和BANF1均在食管鳞癌组织中过表达,并与分化程度和TNM分期有关,本实验进一步在细胞水平证实了VRK1和BANF1通路参与促进ESCC细胞的增殖和迁移的进程,敲低VRK1的表达可以降低细胞BANF1蛋白的表达,抑制细胞增殖,使细胞较多阻滞在S期,同时影响细胞的迁移能力。基于以上结论我们可以将VRK1可以作为癌症治疗的一个合适靶点。但由于VRK1是有丝分裂相关激酶家族的一员,是正常细胞增殖分化过程所必须的,以VRK1作为临床试验的药物靶标是否会破坏体细胞的有丝分裂活动,从而阻碍正常细胞的增殖周期,这些问题仍需进一步研究。另外敲低VRK1表达后,BANF1表达降低也初步表明VRK1作为BANF1的上游基因,在食管癌的病理生理过程中,参与调控了BANF1的表达合成,两者之间的通路在食管癌的发病和进展过程中起促进作用,但两者的相互作用机制仍不清楚,有待进一步研究。
作者贡献
耿杰:论文撰写、修改、数据分析;李雨晴、王婷婷、裴露:实验、查阅相关文献,数据整理;李晋:提出研究思路、设计研究方案;刘红春:设计实验方案、数据分析、实验方案修整,论文修订
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [3] | Fagundes RB, de Carli D, Xaubet RV, et al. Unchanging pattern of prevalence of esophageal cancer, overall and by histological subtype, in the endoscopy service of the main referral hospital in the central region of Rio Grande do Sul State, in Southern Brazil[J]. Dis Esophagus, 2016, 29(6): 603–6. DOI:10.1111/dote.2016.29.issue-6 |
| [4] | Straatman J, Joosten PJ, Terwee CB, et al. Systematic review of patient-reported outcome measures in the surgical treatment of patients with esophageal cancer[J]. Dis Esophagus, 2016, 29(7): 760–72. DOI:10.1111/dote.2016.29.issue-7 |
| [5] | Blank S, Nienhüser H, Dreikhausen L, et al. Inflammatory cytokines are associated with response and prognosis in patients with esophageal cancer[J]. Oncotarget, 2017, 8(29): 47518–32. |
| [6] | Lin Y, Totsuka Y, Shan B, et al. Esophageal cancer in high-risk areas of China: research progress and challenges[J]. Ann Epidemiol, 2017, 27(3): 215–21. DOI:10.1016/j.annepidem.2016.11.004 |
| [7] | 崔纪丽, 侯志超, 刘玉, 等. 食管癌患者肿瘤最长径与浸润深度和淋巴结转移的关系及其对生存期的影响[J]. 肿瘤防治研究, 2014, 41(3): 214–20. [ Cui JL, Hou ZC, Liu Y, et al. Relationship of tumor length and invasion and lymph node metastasis and relevant risk factors on survival of esophageal squamous cell carcinoma patients[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(3): 214–20. DOI:10.3971/j.issn.1000-8578.2014.03.005 ] |
| [8] | Couñago RM, Allerston CK, Savitsky P, et al. Structural characterization of human Vaccinia-Related Kinases (VRK) bound to small-molecule inhibitors identifies different P-loop conformations[J]. Sci Rep, 2017, 7(1): 7501. DOI:10.1038/s41598-017-07755-y |
| [9] | Ben Z, Gong L, Qiu Y. High expression of VRK1 is related to poor prognosis in glioma[J]. Pathol Res Pract, 2018, 214(1): 112–8. |
| [10] | Vega FM, Sevilla A, Lazo PA. p53 Stabilization and accumulation induced by human vaccinia-related kinase 1[J]. Mol Cell Biol, 2004, 24(23): 10366–80. DOI:10.1128/MCB.24.23.10366-10380.2004 |
| [11] | Lee N, Kwon JH, Kim YB, et al. Vaccinia-related kinase 1 promotes hepatocellular carcinoma by controlling the levels of cell cycle regulators associated with G1/S transition[J]. Oncotarget, 2015, 6(30): 30130–48. |
| [12] | Loi M, Cenni V, Duchi S, et al. Barrier-to-Autointegration Factor (BAF) involvement in prelamin A-related chromatin organization changes[J]. Oncotarget, 2016, 7(13): 15662–77. |
| [13] | Boulay G, Sandoval GJ, Riggi N, et al. Cancer-Specific Retargeting of BAF Complexes by a Prion-like Domain[J]. Cell, 2017, 171(1): 163–78. |
| [14] | Molitor TP, Traktman P. Depletion of the protein kinase VRK1 disrupts nuclear envelope morphology and leads to BAF retention on mitotic chromosomes[J]. Mol Biol Cell, 2014, 25(6): 891–903. DOI:10.1091/mbc.e13-10-0603 |
| [15] | Li J, Wang T, Pei L, et al. Expression of VRK1 and the downstream gene BANF1 in esophageal cancer[J]. Biomed Pharmacother, 2017, 89: 1086–91. DOI:10.1016/j.biopha.2017.02.095 |
| [16] | 王婷婷, 裴露, 李晋, 等. 食管鳞状细胞癌组织中VRK1及BANF1的表达及其意义[J]. 临床检验杂志, 2017, 35(11): 862–5. [ Wang TT, Pei L, Li J, et al. The Expression and significance of VRK1 and BANF1 in esophageal squamous cell carcinoma[J]. Lin Chuang Jian Yan Za Zhi, 2017, 35(11): 862–5. ] |
| [17] | Molitor TP, Traktman P. Molecular genetic analysis of VRK1 in mammary epithelial cells: depletion slows proliferation in vitro and tumor growth and metastasis in vivo[J]. Oncogenesis, 2013, 2(6): e48. DOI:10.1038/oncsis.2013.11 |
| [18] | Valbuena A, Sanz-García M, López-Sánchez I, et al. Roles of VRK1 as a new player in the control of biological processes required for cell division[J]. Cell Signal, 2011, 23(8): 1267–72. DOI:10.1016/j.cellsig.2011.04.002 |
| [19] | Santos CR, Rodríguez-Pinilla M, Vega FM, et al. VRK1 signaling pathway in the context of the proliferation phenotype in head and neck squamous cell carcinoma[J]. Mol Cancer Res, 2006, 4(3): 177–85. DOI:10.1158/1541-7786.MCR-05-0212 |
| [20] | Campillo-Marcos I, Lazo PA. Implication of the VRK1 chromatin kinase in the signaling responses to DNA damage: a therapeutic target?[J]. Cell Mol Life Sci, 2018, 75(13): 2375–88. DOI:10.1007/s00018-018-2811-2 |
| [21] | Salzano M, Vázquez-Cedeira M, Sanz-García M, et al. Vaccinia-related kinase 1 (VRK1) confers resistance to DNA-damaging agents in human breast cancer by affecting DNA damage response[J]. Oncotarget, 2014, 5(7): 1770–8. |
| [22] | Huang W, Cui X, Chen Y, et al. High VRK1 expression contributes to cell proliferation and survival in hepatocellular carcinoma[J]. Pathol Res Pract, 2016, 212(3): 171–8. DOI:10.1016/j.prp.2015.11.015 |
| [23] | Del Puerto-Nevado L, Marin-Arango JP, Fernandez-Aceñero MJ, et al. Predictive value of vrk 1 and 2 for rectal adenocarcinoma response to neoadjuvant chemoradiation therapy: a retrospective observational cohort study[J]. BMC Cancer, 2016, 16: 519. DOI:10.1186/s12885-016-2574-9 |
| [24] | Liu ZC, Cao K, Xiao ZH, et al. VRK1 promotes cisplatin resistance by up-regulating c-MYC via c-Jun activation and serves as a therapeutic target in esophageal squamous cell carcinoma[J]. Oncotarget, 2017, 8(39): 65642–58. |
 2019, Vol. 46
2019, Vol. 46


