文章信息
- 2017鼻咽癌国际临床靶区勾画指南解读
- An Interpretation of International Guideline for Delineation of Clinical Target Volumes for Nasopharyngeal Carcinoma in 2017
- 肿瘤防治研究, 2019, 46(1): 85-92
- Cancer Research on Prevention and Treatment, 2019, 46(1): 85-92
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0929
- 收稿日期: 2018-07-29
- 修回日期: 2018-11-08
2. 430079 武汉,湖北省肿瘤医院放疗科
2. Department of Radiation Oncology, Hubei Cancer Hospital, Wuhan 430079, China
放射治疗是目前公认的鼻咽癌(nasopharyngeal carcinoma, NPC)根治性治疗方式。然而由于鼻咽腔较狭小,周围邻近组织结构复杂,且鼻咽癌又具有易扩散的肿瘤生物学特性,导致鼻咽癌放疗靶区的勾画一直存在争议。Ng等[1]的研究发现,原发肿瘤中照射剂量低于66.5 Gy的体积超过3 cm3时,五年局部控制率就会从90%下降至54%。由此可见放疗剂量不足是影响鼻咽癌治疗效果的重要因素之一。因此,为确保原发肿瘤、亚临床病灶以及可疑病灶获得各自所需剂量,准确勾画肿瘤区(goss tumor volume, GTV)和临床靶区(clinical target volume, CTV)就显得极为重要。
现有的靶区勾画指南对于部分解剖结构轮廓的定义意见不一,且往往没有完全针对鼻咽腔周围重要危及组织和非目标组织结构的勾画提出完整的建议,因此有必要进行新的一轮回顾、比较与探讨,以细化鼻腔、口腔、口咽、喉、下咽等解剖结构,在充分考虑鼻咽癌扩散模式的基础上,制定一份国际靶区勾画共识以供临床参考。基于此目的,来自亚洲(中国、中国香港、韩国、新加坡、中国台湾)、澳大利亚、北美洲(加拿大、美国)、沙特阿拉伯和欧洲(比利时、丹麦、法国、荷兰、土耳其、英国)等的鼻咽癌专家对现有的鼻咽癌临床和病理方面的证据进行回顾分析,对已公布的靶区勾画指南进行比较,并进行了充分的思考和深入的探讨。最终汇总意见,制定出《鼻咽癌国际临床靶区勾画指南》,于2017年11月在线发布,并发表于2018年第126卷的Radiotherapy and Oncology杂志上。本文就该项鼻咽癌国际靶区指南进行初步解读,以便国内临床机构根据各自临床实践,尽量统一和细化靶区命名和勾画原则,最大限度地减少差异,使鼻咽癌患者获得最为合理的放射治疗。
1 新版鼻咽癌靶区勾画指南制定基础鼻咽癌通常起源于咽隐窝,由于其极强的浸润性,鼻咽癌细胞可以轻易地突破屏障作用较弱的咽颅底筋膜,从而侵犯神经通道。早期的研究已经揭示了鼻咽癌的扩散途径[2]:向前,肿瘤易侵犯鼻前区,随后经过蝶腭孔扩散到翼腭窝,接着沿上颌神经(maxillary nerve, V2)进入圆孔,或者通过眶下裂、眶尖、眶上裂,侵犯颅内; 向上,肿瘤可以通过破裂孔,侵犯海绵窦和颅脑; 向侧面,肿瘤可通过咽颅底筋膜或喉腔直接或间接地侵犯咽旁间隙,再蔓延到颞下窝,或者沿着下颌神经(mandibular nerve, V3)进入卵圆孔并向上侵犯海绵窦; 肿瘤亦可向后外侧侵犯颈静脉孔、舌下神经管以及通过这两个孔道的神经。
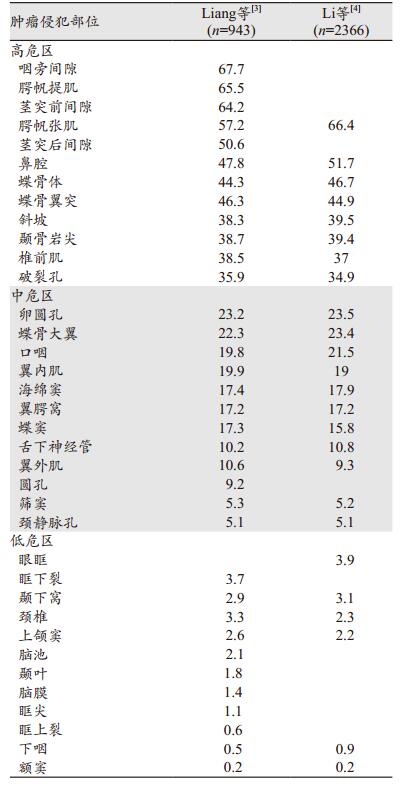
Liang等[3]观察并总结了鼻咽癌易侵犯的结构,将各部位分为高危、中危和低危区域,见表 1,并发现当高危区受侵后,邻近中危区的受侵可能性会上升至55.2%,而如果高危区未受侵,则大部分邻近中危区的受侵可能性 < 10%,即鼻咽癌具有由近及远侵袭的特点。另外,Li等[4]发现,鼻咽癌肿瘤细胞易通过神经孔道蔓延。以上两点是该鼻咽癌国际靶区勾画共识的基础。
鼻咽癌原发肿瘤靶区(primary tumor GTV, GTVp)和淋巴结靶区(nodal GTV, GTVn)勾画主要依据增强MRI与计划CT融合,同时需要结合对鼻前区、鼻咽部和口腔的细致临床检查,以及纤维鼻咽镜对肿瘤原发病灶和浸润范围的观测所得,必要时还需行PET/CT来发现CT或MRI遗漏的转移小淋巴结,由于各个机构的GTV勾画一致性较强,因此不是本次靶区勾画指南主要讨论的重点。本次勾画指南重点在于CTV靶区的确定。CTV靶区勾画的推荐指南,包括高危原发肿瘤(根治剂量)CTV(CTVp1)、中危(预防剂量)CTV(CTVp2),以及高危淋巴引流区(根治剂量)(CTVn1)和中危淋巴引流区(预防剂量)(CTVn2)。为了确保能客观地反映整个专家组的意见,该指南的各个建议均以百分比的形式注明通过率。通过比例定义为:高(≥85%)、中(75%~84%)和低(< 75%)。
2.1 高危原发肿瘤CTV(CTVp1)的勾画建议90%专家建议CTVp1=GTVp+5 mm(如果斜坡未受累,则不需要覆盖斜坡)。该推荐范围基于Chan等[5]对于复发NPC显微浸润程度的外科研究,该研究发现组织病理学测得的肿瘤横轴和长轴平均直径均比MRI测得的数据大3~4 mm。因此,CTVp1的范围有必要在GTV的基础上外扩5 mm,以保证显微浸润病灶得到应有的治疗。
仅有55%专家认为CTVp1应该在满足GTV+5 mm的基础上包括整个鼻咽腔。该推荐的理论依据是Sham等[6]的研究,该研究分析了72例来自鼻咽的顶部、后壁和侧壁的活检组织,发现51.4%的患者都有内镜未发现的显微浸润病灶,另外有13.8%的患者有黏膜下浸润。然而Sham的研究中并没有使用MRI影像技术,如果使用MRI,很有可能发现更多病灶。同时由于这种靶区范围会使鼻咽腔中部分不需要高剂量的区域受到高剂量辐射,从而增加毒性风险,因此该指南并不推荐。
该指南最终推荐CTVp1=GTVp+5 mm,然而在实际临床实践中往往有这样一种倾向,在大多数鼻咽癌高发的亚洲国家里(包括中国),更习惯将整个鼻咽腔包括进CTVp1中,而绝大多数非亚洲中心则习惯将整个鼻咽腔包括在CTVp2中,因此鼻咽腔最终被勾画入哪个区域值得我们思考。另外,该指南亦对鼻咽腔下界的解剖标志进行投票定义。86%的专家同意参考Gray’s Anatomy中口咽起始于C2椎体上缘的解剖定义[7],推荐C1下缘作为鼻咽腔最下界。同时建议在勾画鼻咽腔靶区时,当软腭无受侵时,可以不作为鼻咽腔靶区被勾画进来。
2.2 中危CTV(CTVp2)的勾画建议76%专家认为CTVp2=GTVp+10 mm+整个鼻咽腔。该共识通过率未达到85%以上,同样是因为Chan等[5]对50例复发性鼻咽癌的研究,该研究显示肿瘤细胞浸润黏膜下层的深度为7.4~13.8 mm不等,据此应推荐CTVp2的靶区为GTVp外扩15 mm; 但事实上,复发的鼻咽癌由于先前的治疗,肿瘤细胞的浸润模式可能已经发生了改变,不能作为首次治疗时的依据; 同时将GTV边界扩大15 mm后,不可避免地会增大邻近组织的放射性损伤。因此,该指南采取了折中的方式,推荐CTVp2为CTVp1外扩5 mm,即GTVp+10 mm+整个鼻咽腔。
为获得更好的远期疗效,CTVp2中需要包括部分邻近组织的解剖结构,该指南依据鼻咽癌侵犯模式和特点,针对不同的T分期提出对应的勾画指南:
上界:
(1)犁骨和周围的筛窦
犁骨是鼻咽的上界,90%专家建议CTVp2靶区应该包括犁骨和周围的筛窦。后组筛窦的覆盖程度往往根据邻近组织的受累情况决定。例如,如果蝶窦受累,那么CTVp2就应该包括后组筛窦的上部,而前组和中组筛窦没有必要选择性覆盖。
(2)蝶窦
90%专家建议:T1和T2期:覆盖蝶窦下部; T3和T4期:覆盖整个蝶窦。该推荐是从三维放疗技术中总结出来的,但同样适用于IMRT[5, 8]。如果T4期肿瘤仅向下浸润(未突破鼻咽腔上部),则不需要覆盖整个蝶窦,但这种情况较少见。
(3)海绵窦
86%专家建议:T1和T2期:无需覆盖海绵窦; T3和T4期:仅覆盖同侧整个海绵窦。由上述鼻咽癌侵犯模式可见,海绵窦属于中危区,仅当岩尖和破裂孔受侵时海绵窦才处于高危状况,且肿瘤同时侵犯两侧解剖结构的发生率低于10%,因此,T1和T2期患者CTVp2不覆盖海绵窦是安全的。同样,如果T4期肿瘤仅向下浸润(未突破鼻咽腔上部),则不需要覆盖整个海绵窦,但这种情况较少见。
(4)颅底小孔
86%专家建议:无论T分期如何CTVp2靶区均覆盖双侧卵圆孔、圆孔和破裂孔。如果原发肿瘤向后外侧浸润或有高位颈部淋巴结肿大,CTVp2靶区还需要包括颈静脉孔和舌下神经管。
前界:
(5)鼻后孔
仅71%专家建议:无论T分期如何,都要覆盖鼻后孔前5 mm的鼻腔后部分。关于选择性覆盖鼻腔的程度,专家之间有争议,临床医生需要利用内镜来观察肿瘤在鼻腔的浸润程度最终指导治疗靶区的勾画范围。
(6)上颌窦(翼上颌裂和翼腭窝)
仅72%专家建议:无论T分期如何,选择性地覆盖上颌窦后5 mm部分来确保充分覆盖翼上颌裂和翼腭窝。翼上颌裂和翼腭窝是另外两个易受NPC侵犯的优势通道[3]。这个部位的复发往往很难治疗,而且发现时往往已经是晚期。因此该国际指南中推荐覆盖上颌窦后5 mm部分来确保CTVp2覆盖了这两个结构。
侧界:
(7)咀嚼肌
95%专家建议:GTVp外扩10 mm足以覆盖靶区,不需要包括整个翼状肌(翼内肌、翼外肌)肌肉边界。仅当翼状肌的深筋膜或肌外膜受侵时需覆盖整个翼状肌,否则不需要特地覆盖翼外肌。
(8)咽旁间隙
86%专家建议:咽旁间隙是NPC受侵的高风险区,所有T分期患者累及浸润发生率为67.7%[3],因此建议无论T分期如何都覆盖整个咽旁间隙。
后界:
(9)斜坡
86%专家建议:斜坡未受侵:覆盖斜坡前1/3;斜坡受侵:覆盖整个斜坡。对于斜坡没有受累者,建议覆盖斜坡前1/3,以确保覆盖可能的镜下病灶[3];斜坡明显受累者,应覆盖整个斜坡,以防止骨髓浸润。
2.3 淋巴结(lymph nodes, LNs)区(CTVn)的勾画建议淋巴结受侵的诊断标准为:(1)最大短径:咽后LNs > 5 mm或颈部LNs > 10 mm(颈内静脉二腹肌下淋巴结 > 11 mm)[9];(2)3个及以上连续融合的LNs,每个淋巴结的短径至少为8~10 mm[9];(3)任何大小中心坏死或边缘强化的LNs[9];(4)任何大小结外浸润的LNs[9];(5)PET/CT检查到的任何大小FDG值明显升高的LNs[10]。(肿大的LNs如果未达到上述标准,则认为是可疑LNs。)
鼻咽癌淋巴结分区采用由2003年制定并于2013年更新的专家共识指南中规定的颈部淋巴结区域定义[11-12]。高危淋巴结区CTV(CTVn1)源自受侵淋巴结(GTVn)的外扩,给予根治剂量(70 Gy),中危淋巴结区CTV(CTVn2)给予预防剂量(50~60 Gy)。
2.3.1 高危淋巴结区CTV(CTVn1)的勾画建议仅64%专家认为:没有结外浸润时,CTVn1=GTVn+5 mm; 有结外受侵时,CTVn1=GTVn+10 mm。大多数专家建议GTVn外扩5 mm+5 mm形成CTVn1可作为常规方法。当淋巴结较小且明确没有结外浸润时可考虑GTVn小范围外扩3 mm作为CTVn1。另一方面,当出现淋巴结结外浸润时CTVn1/2在GTVn+5 mm+5 mm的基础上要考虑再外扩。当受累淋巴结毗邻肌肉和(或)受累淋巴结表现出明显肌肉受侵的放射学征象时,应该将该淋巴结毗邻的肌肉包括在CTV中; 当CTV1/2达到胸锁乳突肌边界时需要进行靶区勾画修饰,将正常肌肉组织勾画到靶区之外,而不是直接的简单外扩。由于缺少鼻咽癌转移淋巴结镜下浸润程度的数据,上述淋巴结区CTV的勾画建议主要来源于各中心的临床实践和现有指南的推荐,以及非鼻咽癌头颈部肿瘤的经验[13]。因此虽然上述建议通过率仅64%,但仍推荐作为常规方法。
2.3.2 中危淋巴结区CTV(CTVn2)的勾画建议仅64%专家认为:CTVn2=CTVn1+5 mm(即GTVn+5 mm+5 mm)。针对中危颈淋巴结区(CTVn2),该指南还对特定淋巴结和颈部淋巴结区部分组织的勾画提出以下推荐建议:
(1)77%专家认为:咽后淋巴结(retropharyn-geal lymph nodes, RPLN)区域上下界范围定义为从颅底到舌骨下缘(C2椎体下缘)或者C3下缘,CTVn2只需覆盖外侧咽后淋巴结。咽后淋巴结轮廓的勾画需要避免过多的咽缩肌接受不必要的辐射,故而一般选择舌骨下缘(或C2椎体下缘)作为下界; 如有广泛浸润,可考虑扩大到C3下缘。复旦大学对3 100例经MRI检查的新诊断NPC病例的研究显示,75%(2 012例)咽后淋巴结受累的患者中仅6例(0.2%)有中组咽后淋巴结受侵[14],由此可见中组咽后淋巴结极少受侵,因而咽后淋巴结照射只需预防性覆盖外侧组即可。
(2)如果有以下情况,CTVn2需要包括同侧Ⅰb区淋巴结:
ⅰ肿瘤累及同侧颌下腺; ⅱ以Ⅰb区淋巴结为首站引流的结构(即口腔、鼻腔前半部分)受侵; ⅲ 91%专家认为:同侧Ⅱa区LNs包膜外受侵; ⅳ 68%专家认为:同侧Ⅱ区LNs受累,且淋巴结最大直径 > 2 cm(但没有包膜外浸润)。
(3)对于任何T和N分期的患者,CTVn2均需要包括双侧RPLN和Ⅱ、Ⅲ、Ⅴa区颈部淋巴结。当有明显的淋巴受累时,CTVn2的范围需扩大到下一个淋巴结区。
(4)64%专家认为:CTVn2覆盖区的上界需要到颅底,以确保茎突后淋巴结包含在内。2003年[11]和2013年[12]出版的颈部淋巴区共识指南都把颈部Ⅱ区淋巴结区的上界定义为C1横突下缘,将Ⅶa区(主要包括咽后LN)上界定义为C1椎体上缘。但是有研究[15-17]指出,25%Ⅱ区淋巴结受累的NPC患者实际上肿块所在部位会高于C1横突的下缘。因此,支持者建议,不管淋巴结受侵情况如何,Ⅱ区的上界都应该扩展到包括茎突后间隙甚至达到颅底,以确保覆盖茎突后淋巴结。上述包括茎突后淋巴结的区域在2013年的指南[12]中被定义为的Ⅶb区。
(5)81%的专家建议CTVn可分成3个照射剂量水平,即CTVn1给予根治性剂量(70 Gy),CTVn2给予中等预防剂量(50~60 Gy),CTVn3给予可选低剂量(50 Gy)。
(6)95%的专家认为如果一侧颈部有淋巴结受累(咽后淋巴结除外),那么同侧Ⅳ和Ⅴb区淋巴结需要接受照射。当仅有Ⅱ区淋巴结受侵时,大多数中心都会将Ⅳ和Ⅴb区包含于CTVn3中,并给予低等预防剂量(大约50 Gy),而其他中心会把Ⅳ和Ⅴb区包括在CTVn2中,给予中等预防剂量(大约60 Gy); Ⅳ和Ⅴb区LN有明显受累的患者,这些Ⅳ和Ⅴb区的受累淋巴结应该被勾画到CTVn1靶区中并给予高剂量。同时当低位颈部淋巴结受累时,推荐CTVn2覆盖上纵隔淋巴结。
3 新版鼻咽癌靶区勾画指南中的争议项 3.1 肿瘤临床靶区(CTVp)中的争议项该指南列出了以下问题的讨论情况,以及专家组的共识,但未在指南中给出具体的推荐。
(1)CTVp1/2中靶区内的空腔是否需要纳入靶区内
这一问题具有较大争议,该指南阐述了各方的看法,但未给出推荐意见。支持将空腔从靶区内剔除的一方认为:空腔不属于治疗目标,镜下病灶也不可能通过空腔传播,且覆盖空腔会使靶区增大从而增加放射毒性,因此需要裁去空腔。65%反对者却认为:空腔不需要特意剔除,且剔除空腔可能会导致空气-组织界面电子不均衡,从而导致该区域治疗剂量不足。刘志萍等[18]研究表明,靶区内空腔的存在会引起肿瘤和危急器官(organs-at-risk, OARs)剂量增加但可忽略不计,不过在空腔后的肿瘤区域可观察到剂量累及效应。在Fried等[19]研究中,比较三种不同方式把空腔包含在靶区中进行螺旋断层放疗的方案,并未发现剂量测定质量和治疗效果有差异,却发现当剔除空腔时,靶区更易受到患者摆位不确定性的影响。尽管该问题未达成共识,但听取各方的观点有利于临床医生了解利弊,根据患者实际情况来指导临床实践。
(2)当肿瘤毗邻OARs时,CTVp1/2勾画的范围
由于该问题涉及权衡边缘遗漏带来肿瘤复发风险和放疗引起正常组织损伤之间的关系,不同临床医生的理念有显著的差异。该指南专家组中68%的专家建议CTVp1=GTV+1 mm,CTVp2=GTV+2 mm,14%的专家建议两者均不外扩,即GTV=CTVp1=CTVp2。在实践中,需要临床医生和患者共同讨论利弊以确定靶区范围。
3.2 淋巴结靶区(CTVn)中的争议项颌下腺是否需要勾画入靶区?颌下腺是否属于淋巴系统一直存在争议。该指南的专家组对此亦有分歧。59%的专家认为颌下腺不应该属于淋巴系统,勾画CTVn2的Ⅰb区时应避开颌下腺,这样可减少口腔干燥症状。但2003年[11]和2013年[12]出版的颈部淋巴区共识指南都把颌下腺归于Ⅰb区,因此该问题还需进一步研究来解决。
4 诱导化疗后的靶区勾画针对诱导化疗后的靶区推荐,该勾画指南也进行了简单的阐述。诱导化疗对于NPC来说是一种有效的治疗方式,特别是对于肿瘤毗邻重要OARs的患者。越来越多的随机对照试验和Meta分析表明,诱导后再行同步化疗可以延长无进展生存期[20-23]。但是,关于诱导化疗后的最佳靶区勾画方式还存在大量争议。
Salama等[24]关于非NPC头颈部肿瘤的指南推荐:诱导化疗前所有受肿瘤侵犯的组织,即使在诱导化疗后不再有明显受累,仍应该被包括在放疗靶区内,而且放疗剂量也不应该根据肿瘤的疗效反应进行调整。本指南参考上述原则推荐:当诱导化疗前的肿瘤体积在接受根治性剂量,且肿瘤周围重要OARs不超过最高耐受剂量时,无论肿瘤在诱导化疗后是否退缩,都应该按接受诱导化疗前的肿瘤体积来勾画靶区,并且给予足量的照射。
然而,对于由于周围重要OARs的剂量限制,而在技术上无法给予根治性剂量的肿瘤,一部分专家仍然会采用上述原则,给予诱导化疗前肿瘤体积根治性剂量; 而另一部分专家则会按照诱导化疗后肿瘤体积来勾画靶区,以避免和减低周围正常组织过度损害的风险。
如果按照诱导化疗后肿瘤体积来勾画靶区,则需要注意以下几点:(1)确保接受诱导化疗前的整个肿瘤区域都至少包含在CTVp2之中; (2)对于诱导化疗前就有颅底受侵的肿瘤,诱导后颅底受侵区域仍需包括入靶区并给予根治性剂量; (3)诱导化疗前软组织已受累通常会导致OARs移位,而诱导化疗后如果肿瘤退缩,肿瘤周围OARs会移回到原来的位置,因此需在诱导治疗后重新进行CT定位扫描,重新定位OARs。
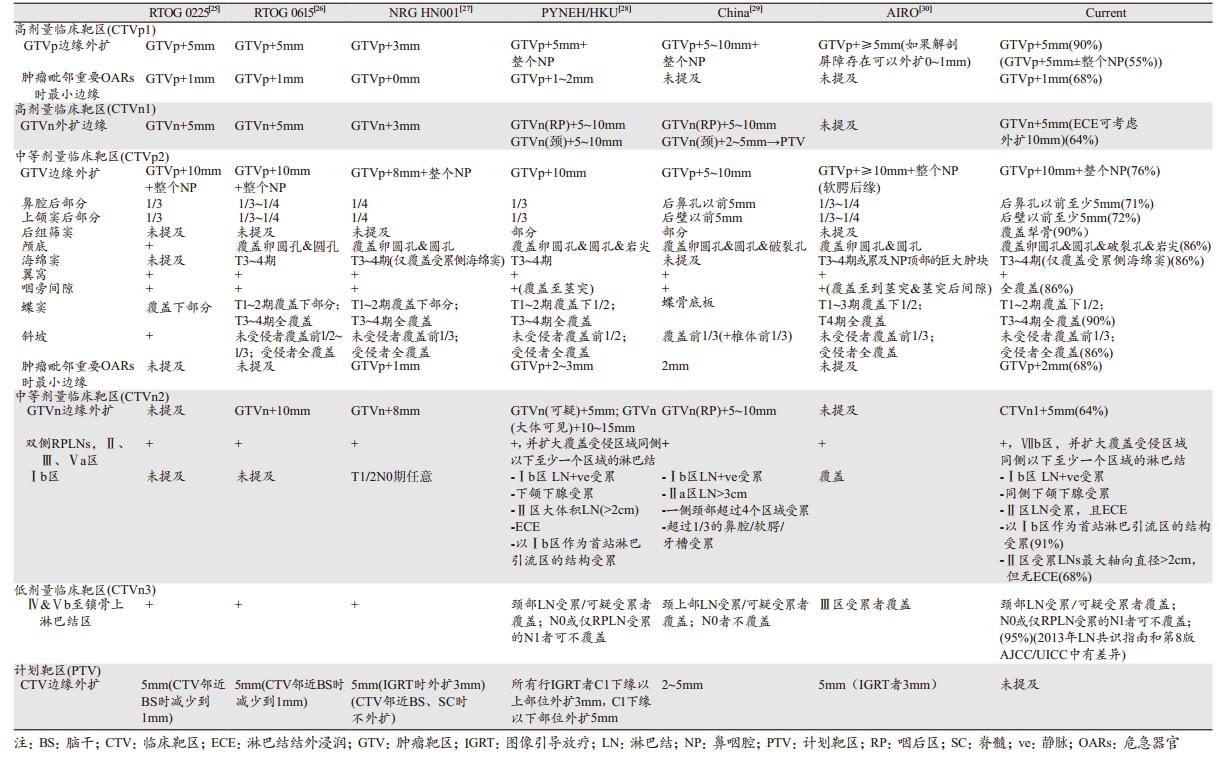
5 小结该指南通过对现有证据和勾画指南的全面回顾,见表 2,以及国际鼻咽癌放疗专家的广泛讨论,较全面地对鼻咽癌各个靶区勾画提出了详细的意见和建议,克服了以往指南对某些组织结构以及靶区定义和勾画的忽略或描述不细致的问题。该指南应该作为一种实用参考工具来指导临床医生对NPC的靶区进行合理的勾画,缩小因靶区勾画不同而带来的治疗差异。
但是,该指南仍有不少不足之处:(1)对于鼻咽癌的原发肿瘤GTV勾画主要依据查体、CT/MRI和纤维鼻咽镜检查(必要时行PET/CT),实际工作中有时也可以采用超声检查以辅助明确颈部淋巴结转移情况。(2)鼻咽癌的病理分型有角化型分化型、非角化型及未分化型,欧美人种以角化型分化型为主,亚洲尤其中国人以非角化型和未分化型为主; 尽管指南说明该靶区勾画建议适用于所有组织学亚型的NPC,但并未给出明确的证据证实。(3)该指南建议CTVp1=GTVp+5mm的依据是Chan等[5]对于复发NPC的组织学浸润研究; 但事实上,参考复发鼻咽癌患者的组织学浸润数据来设置靶区勾画原则可能是不合适的,且该研究并未根据病理类型对鼻咽癌的组织学浸润程度进行亚组分析,因为不同病理类型的肿瘤浸润程度可能存在差异。(4)由于缺乏鼻咽癌临床-病理数据,以及部分设计理念与现实的差异,指南中仍存在一些争议项未能达成共识。(5)该指南并未对计划靶区(PTV)的范围进行阐述。以上问题以及指南中的争议部分都还需要在今后临床和科研工作中进一步研究。
我国临床医生在学习和应用该国际指南的同时,还必须参考李晔雄教授主编的《肿瘤放射治疗学(第五版)》,融合自己的临床知识和经验,并结合患者的实际情况,对靶区勾画进行调整,最终明确鼻咽癌放射治疗的靶区范围。
作者贡献
虞鲁诗:参与指南的学习与解读、负责资料收集与文章撰写; 宋启斌、韩光:参与指南的学习与解读、负责文章修改与补充
| [1] | Ng WT, Lee MC, Chang AT, et al. The impact of dosimetric inadequacy on treatment outcome of nasopharyngeal carcinoma with IMRT[J]. Oral Oncol, 2014, 50(5): 506–12. DOI:10.1016/j.oraloncology.2014.01.017 |
| [2] | Dubrulle F, Souillard R, Hermans R. Extension patterns of nasopharyngeal carcinoma[J]. Eur Radiol, 2007, 17(10): 2622–30. DOI:10.1007/s00330-007-0616-z |
| [3] | Liang SB, Sun Y, Liu LZ, et al. Extension of local disease in nasopharyngeal carcinoma detected by magnetic resonance imaging: improvement of clinical target volume delineation[J]. Int J Radiat Oncol Biol Phys, 2009, 75(3): 742–50. DOI:10.1016/j.ijrobp.2008.11.053 |
| [4] | Li WF, Sun Y, Chen M, et al. Locoregional extension patterns of nasopharyngeal carcinoma and suggestions for clinical target volume delineation[J]. Chin J Cancer, 2012, 31(12): 579–87. DOI:10.5732/cjc.012.10095 |
| [5] | Chan JY, Wong ST, Wei WI. Whole-organ histopathological study of recurrent nasopharyngeal carcinoma[J]. Laryngoscope, 2014, 124(2): 446–50. DOI:10.1002/lary.v124.2 |
| [6] | Sham JS, Wei WI, Kwan WH, et al. Fiberoptic endoscopic examination and biopsy in determining the extent of nasopharyngeal carcinoma[J]. Cancer, 1989, 64(9): 1838–42. DOI:10.1002/(ISSN)1097-0142 |
| [7] | McHanwell S. Pharynx[M]. //Standring S, Gleeson M. Gray's anatomy. New York: Elsevier, 2016: 572-5. |
| [8] | Lai SZ, Li WF, Chen L, et al. How does intensity-modulated radiotherapy versus conventional two-dimensional radiotherapy influence the treatment results in nasopharyngeal carcinoma patients?[J]. Int J Radiat Oncol Biol Phys, 2011, 80(3): 661–8. DOI:10.1016/j.ijrobp.2010.03.024 |
| [9] | van den Brekel MW, Stel HV, Castelijns JA, et al. Cervical lymph node metastasis: assessment of radiologic criteria[J]. Radiology, 1990, 177(2): 379–84. DOI:10.1148/radiology.177.2.2217772 |
| [10] | Vellayappan BA, Soon YY, Earnest A, et al. Accuracy of 18F-flurodeoxyglucosepositron emission tomography/computed tomography in the staging of newly diagnosed nasopharyngeal carcinoma: a systematic review and meta-analysis[J]. Radiol Oncol, 2014, 48(4): 331–8. |
| [11] | Gregoire V, Levendag P, Ang KK, et al. CT-based delineation of lymph node levels and related CTVs in the node-negative neck: DAHANCA, EORTC, GORTEC, NCIC, RTOG consensus guidelines[J]. Radiother Oncol, 2003, 69(3): 227–36. DOI:10.1016/j.radonc.2003.09.011 |
| [12] | Grégoire V, Ang K, Budach W, et al. Delineation of the neck node levels for head and neck tumors: a 2013 update. DAHANCA, EORTC, HKNPCSG, NCIC CTG, NCRI, RTOG, TROG consensus guidelines[J]. Radiother Oncol, 2014, 110(1): 172–81. DOI:10.1016/j.radonc.2013.10.010 |
| [13] | Apisarnthanarax S, Elliott DD, El-Naggar AK, et al. Determining optimal clinical target volume margins in head-and-neck cancer based on microscopic extracapsular extension of metastatic neck nodes[J]. Int J Radiat Oncol Biol Phys, 2006, 64(3): 678–83. DOI:10.1016/j.ijrobp.2005.08.020 |
| [14] | Wang XS, Yan C, Hu CS, et al. Study of the medial group retropharyngeal node metastasis from nasopharyngeal carcinoma based on 3100 newly diagnosed cases[J]. Oral Oncol, 2014, 50(11): 1109–13. DOI:10.1016/j.oraloncology.2014.08.007 |
| [15] | Zhang F, Cheng YK, Li WF, et al. Investigation of the feasibility of elective irradiation to neck levelⅠb using intensity-modulated radiotherapy for patients with nasopharyngeal carcinoma: a retrospective analysis[J]. BMC Cancer, 2015, 15: 709. DOI:10.1186/s12885-015-1669-z |
| [16] | Wang X, Hu C, Ying H, et al. Patterns of lymph node metastasis from nasopharyngeal carcinoma based on the 2013 updated consensus guidelines for neck node levels[J]. Radiother Oncol, 2015, 115(1): 41–5. |
| [17] | Wang X, Li L, Hu C, et al. Patterns of level Ⅱ node metastasis in nasopharyngeal carcinoma[J]. Radiother Oncol, 2008, 89(1): 28–32. |
| [18] | 刘志萍, 田源, 王洪智, 等. 鼻咽癌IMRT中气腔对靶区及OAR剂量影响[J]. 中华放射肿瘤学杂志, 2017, 26(8): 862–6. [ Liu ZP, Tian Y, Wang HZ, et al. Dosimetric effects of air cavity on target volume and organs at risk during intensity-modulated radiation therapy for nasopharyngeal carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2017, 26(8): 862–6. DOI:10.3760/cma.j.issn.1004-4221.2017.08.004 ] |
| [19] | Fried D, Chera B, Lehman-Davis M, et al. SU-E-T-603: Influence of PTV Delineation at Air Cavity Interface on Tomotherapy Plan Quality[J]. Med Phys, 2012, 39(6Part19): 3844–5. |
| [20] | Ribassin-Majed L, Marguet S, Lee AWM, et al. What is the best treatment of locally advanced nasopharyngeal carcinoma? An individual patient data network meta-analysis[J]. J Clin Oncol, 2017, 35(5): 498–505. DOI:10.1200/JCO.2016.67.4119 |
| [21] | Hui EP, Ma BB, Leung SF, et al. Randomized phase Ⅱ trial of concurrent cisplatin-radiotherapy with or without neoadjuvant docetaxel and cisplatin in advanced nasopharyngeal carcinoma[J]. J Clin Oncol, 2009, 27(2): 242–9. DOI:10.1200/JCO.2008.18.1545 |
| [22] | Cao SM, Yang Q, Guo L, et al. Neoadjuvant chemotherapy followed by concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: a phase Ⅲ multicentre randomised controlled trial[J]. Eur J Cancer, 2017, 75: 14–23. DOI:10.1016/j.ejca.2016.12.039 |
| [23] | Sun Y, Li WF, Chen NY, et al. Induction chemotherapy plus concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: a phase 3, multicentre, randomised controlled trial[J]. Lancet Oncol, 2016, 17(11): 1509–20. DOI:10.1016/S1470-2045(16)30410-7 |
| [24] | Salama JK, Haddad RI, Kies MS, et al. Clinical practice guidance for radiotherapy planning after induction chemotherapy in locoregionally advanced head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 75(3): 725–33. DOI:10.1016/j.ijrobp.2008.11.059 |
| [25] | Lee N, Harris J, Garden AS, et al. Intensity-modulated radiation therapy with or without chemotherapy for nasopharyngeal carcinoma: Radiation Therapy Oncology Group Phase Ⅱ trial 0225[J]. J Clin Oncol, 2009, 27(22): 3684–90. DOI:10.1200/JCO.2008.19.9109 |
| [26] | Lee NY, Zhang Q, Pfister DG, et al. Addition of bevacizumab to standard chemoradiation for locoregionally advanced nasopharyngeal carcinoma (RTOG 0615): a phase 2 multi-institutional trial[J]. Lancet Oncol, 2012, 13(2): 172–80. DOI:10.1016/S1470-2045(11)70303-5 |
| [27] | Nancy Lee. NRG-HN001: Randomized Phase Ⅱ and Phase Ⅲ Studies of Individualized Treatment for Nasopharyngeal Carcinoma Based on Biomarker Epstein Barr Virus (EBV) Deoxyribonucleic Acid (DNA)[EB/OL]. [2014-04-21] https://www.nrgoncology.org/Clinical-Trials/Protocol-Table. |
| [28] | Ng WT, Lee MC, Hung WM, et al. Clinical outcomes and patterns of failure after intensity-modulated radiotherapy for nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2): 420–8. DOI:10.1016/j.ijrobp.2009.11.024 |
| [29] | 中国鼻咽癌临床分期工作委员会. 2010鼻咽癌调强放疗靶区及剂量设计指引专家共识[J]. 中华放射肿瘤学杂志, 2011, 20(4): 267–9. [ China working committee on clinical staging of nasopharyngeal carcinoma. Intensity modulated radiotherapy (IMRT) target volume and dose design guideline for nasopharyngeal carcinoma: a consensus of experts, in 2010[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2011, 20(4): 267–9. DOI:10.3760/cma.j.issn.1004-4221.2011.04.001 ] |
| [30] | Merlotti A, Alterio D, Vigna-Taglianti R, et al. Technical guidelines for head and neck cancer IMRT on behalf of the Italian association of radiation oncology–head and neck working group[J]. Radiat Oncol, 2014, 9: 264. DOI:10.1186/s13014-014-0264-9 |
 2019, Vol. 46
2019, Vol. 46