文章信息
- Wnt信号通路与慢性粒细胞白血病
- Wnt Signaling Pathway and Chronic Myelogenous Leukemia
- 肿瘤防治研究, 2019, 46(2): 174-177
- Cancer Research on Prevention and Treatment, 2019, 46(2): 174-177
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0899
- 收稿日期: 2018-07-06
- 修回日期: 2018-09-20
2. 810007 西宁,青海省人民医院血液风湿科
2. Department of Blood Rheumatology, Qinghai Provincial People's Hospital, Xi'ning 810007, China
慢性粒细胞白血病(Chronic myelogenous leukemia, CML)是一种起源于造血干细胞的恶性增殖性肿瘤,其发病率目前在我国为0.36/10万,在各类白血病中占第3位[1]。早在1973年Rowley JD通过奎纳克林荧光和吉姆萨染色首次发现了t(9;22)(q34;q11)染色体易位是导致CML发病的最主要因素[2]。该染色体易位导致CML形成活化的可以产生酪氨酸激酶的BCR-ABL1融合基因,并将造血干细胞转化为自我更新、增殖和分化的白血病干细胞(LSC)[3]。故目前认为BCR-ABL1融合基因是CML发生及发展的主要原因。在2001年,第一代小分子酪氨酸激酶抑制剂(TKI)甲磺酸伊马替尼被批准用于治疗CML,从此改变了CML的传统治疗方式,并标志着血液系统肿瘤基因靶向治疗时代的开始[4]。伴随着第一代TKI伊马替尼及第二代TKI达沙替尼和尼洛替尼取得的巨大成功,第三代TKI普纳替尼也于2012年被美国FDA批准用于对其他TKIs耐药的CML与Ph+急性淋巴细胞白血病患者的治疗[5]。但是多数患者需长期甚至终生服药,部分患者甚至在达到无治疗缓解后也会出现复发,相关研究表明这可能与TKI药物无法清除患者体内白血病干细胞(LSCs)有关[6]。近年来,相关研究报道认为Wnt信号通路有助于正常细胞的生长和分化,其控制着造血细胞的增殖、分化,Wnt信号通路的过度刺激可引起造血干细胞的肿瘤性增殖[7]。因此由于TKI药物的上述缺点及Wnt信号通路的作用机制,许多研究人员将目标放在了Wnt信号通路上面。
1 Wnt信号通路的应用1982年Nusse和Varmus在研究小鼠乳腺肿瘤的致癌机制时首次发现Wnt信号通路在肿瘤发生中的作用[8]。其是由广泛存在于多种组织中的至少有19种分泌糖蛋白(长度为350~400个氨基酸)组成的富含半胱氨酸糖蛋白的一个大家族。其可通过保持进化上的高度保守调节关键细胞的功能,包括增殖、分化、迁移、遗传稳定性、细胞凋亡和干细胞更新[9]。
1.1 Wnt信号通路的转导Wnt信号通路分为经典的依赖β-连环蛋白(β-catenin)的途径和非经典的不依赖β-catenin的途径,见图 1。β-catenin是一种多功能蛋白质存在于不同的亚细胞组分中,它的主要膜结合形式与E-钙黏蛋白相互作用,并通过α-catenin连接肌动蛋白丝以形成细胞骨架,通过酪氨酸磷酸化将膜结合的β-catenin释放到细胞溶质中。细胞溶质中的β-catenin作为经典Wnt信号转导途径的下游蛋白,在缺乏Wnt蛋白的情况下,APC、Axin、GSK-3β和GK1形成“β-catenin降解复合体”,β-catenin降解复合体使β-catenin磷酸化,并被E3连接酶β-TrCP多聚泛素化,最后以被蛋白酶体形式快速降解,从而减少细胞中游离的β-catenin[11]。因细胞核内无Wnt信号的转入,转录因子家族的T-cell transcription factor/lymphoid enhancer binding factor(TCF/LEF)通过募集Groucho和(或)Ct BP共同抑制DNA的转录。当Wnt信号转导被激活时,其与卷曲蛋白家族(Fzd)及其受体LRP5和LRP6结合,使存在于胞质中的效应蛋白(DVL)转到质膜,导致GSK3β从Axin1上脱落,从而扰乱β-catenin破坏复合物。因此,β-catenin不再被磷酸化并降解,而是稳定在细胞质中并能够转位至细胞核中[12]。β-catenin本身并无法和DNA结合,但它与LEF/TCF家族转录因子的结合成复合体,从而激活Wnt下游靶基因的转录。而不典型的Wnt信号通路与Fzd受体或RYK和ROR受体酪氨酸激酶的结合启动,并以DVL依赖性方式调节小GTP酶,激活钙通量、蛋白激酶C(PKC),钙/钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)和JUN N末端激酶(JNK),导致AP1和NFAT调节的基因表达[13]。在血液系统疾病中主要以经典的Wnt信号通路发挥作用为主,但在个别情况下非经典途径也起到了重大的作用。
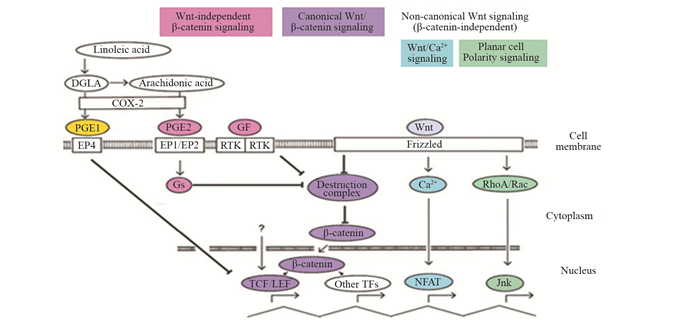
|
| CML: chronic myeloid leukemia; LSCs: leukemia stem cells; COX: cyclooxygenase; DGLA: dihomo-γ-linolenic acid; EP: prostaglandin E receptor; GF: growth factor; Gs: G protein Gs alpha subunit; PG: prostaglandin; RTK: receptor tyrosine kinase; TF: transcription factor. 图 1 Wnt /β-连环蛋白及相关信号传导与CML中PGE1活性关系的简易模型[10] Figure 1 Simplified model of Wnt/β-catenin and related signal transduction and proposed model of PGE1 activity in CML[10] |
自从Wnt信号通路被发现以后,许多针对Wnt信号通路及其抑制剂在恶性肿瘤治疗方面的研究也快速崛起,并取得了令人兴奋的成果。2009年Ashihara等[14]通过研究β-catenin小干扰RNA对移植到小鼠皮下的多发性骨髓瘤细胞的抑制作用,证实了β-catenin可以成为治疗多发性骨髓瘤的新型靶点。2017年Savvidou等[15]也通过研究β-Catenin抑制剂BC2059作为单一疗法或与硼替佐米联合用于多发性骨髓瘤的治疗证实BC2059可以延迟肿瘤细胞生长并减少靶向药物带来的不良反应。2015年Fiskus等[16]通过研究β-catenin抑制剂BC2059和组蛋白去乙酰化酶抑制剂联合治疗AML的相关研究证实BC2059可以诱导AML干细胞的凋亡,从而成为可以消除AML干细胞的治疗手段之一。在淋巴瘤[17]、急性淋巴细胞白血病[18]的治疗中Wnt/β-catenin信号通路及其抑制剂均达到了可喜的治疗效果。
1.3 Wnt信号通路在CML中的作用近年来对于CML无治疗缓解一直是研究热点,但多数患者在停药后容易出现复发,因此许多学者将注意力放在了Wnt信号通路上面,并且为CML达到无治疗缓解及减少复发带来了希望。
1.3.1 白血病干细胞许多研究表明CML是由极少数的LSCs维持,并且由于LSCs细胞不依赖BCR-ABL1信号转导,TKI药物对于LSCs细胞的消除是无效的,因此TKI药物治疗后容易出现复发归因于LSCs的持续存在[19]。
正常造血干细胞(HSC)及LSCs存在于骨髓造血微环境中,骨髓可通过各种机制调节造血干细胞的增殖和分化。在这些机制中,骨髓间充质细胞中典型的Wnt/β-catenin信号转导对于造血功能是必不可少的。许多研究表明Wnt/β-catenin信号在正常HSC的自我更新中发挥了重要作用,但LSCs的增殖分化更依赖于Wnt/β-catenin信号[20]。由于骨髓处于缺氧状态,Wnt/β-catenin信号通路可以较正常含氧条件下更高水平的促进LSCs的增殖[11]。Wang等[21]通过在小鼠模型中的研究发现,Wnt/β-catenin信号通路有助于LSCs的发育,在缺少激活的Wnt信号的情况下,在移植HSC的小鼠中发生白血病的概率较小。然而,在存在活化的β-catenin的情况下,转化的粒细胞-巨噬细胞诱导白血病的发生并降低移植小鼠的存活。Yu等[22]通过在小鼠中的研究发现正常HSC和转化LSCs对Tcf1和Lef1转录因子有不同的要求,HSC对Tcf1和Lef1有一个适度的要求,这两种转录因子的缺失对HSC存活无明显影响,而自我更新的CML LSCs严重依赖于Tcf1和Lef1的存活。这些研究均表明Wnt信号通路在LSCs的增殖中起着重要的作用。
1.3.2 CML急变在CML急变期中,Wnt/β-catenin信号的激活伴随着GSK-3β的失活,导致β-catenin避免被降解而在胞质内积累起来,并与细胞核中的LEF-1/TCF-4转录因子结合起来,激活下游靶基因,从而引起CML急变期CD34+细胞的增殖。刘毅等[23]研究表明β-catenin的mRNA和蛋白水平在慢粒急变期骨髓单个核细胞中明显高于慢性期患者及健康者,并且其表达量与BCR-ABL1表达量呈正相关。邹外一等[24]通过检测β-catenin在99例CML患者骨髓单个核细胞中的mRNA和蛋白质水平表达,显示在CML急变期、加速期的患者中表达明显增高,而在慢性期与健康者中无明显差异。同时通过对94例CML患者服用伊马替尼前及后一年内每3月检测BCR-ABL1融合基因及蛋白质水平的表达,提示β-catenin持续阴性患者的细胞遗传学缓解率明显高于β-catenin持续阳性或转为阳性的患者。同时,Sengupta等[25]相关研究认为,CML从慢性期进展到急变期的过程中,Wnt信号通路活性明显上调。根据上述相关人员研究,我们可以发现Wnt/β-catenin信号通路在CML急变期水平是升高的,且或许与BCR-ABL1融合基因水平相关,并在慢粒急变中起到至关重要的作用。
1.3.3 耐药目前部分CML的患者在长期应用第一代TKI药物伊马替尼时出现了耐药的情况,TKI药物产生耐药主要与激酶突变、融合基因的扩增和过表达、多耐药基因等的产生有关[26]。但目前相关研究认为TKI药物耐药与治疗期间LSCs的选择性存活有关[27]。Zhang等[28]通过对CML慢性期骨髓细胞及健康人骨髓细胞行伊马替尼处理后进行对比研究发现β-catenin蛋白抑制剂可以降低伊马替尼时LSCs的存活和增殖,从而保护伊马替尼诱导凋亡的CML LSCs。这项研究或许表明Wnt/β-catenin信号通路可能存在导致伊马替尼治疗耐药的可能。另外Gregory等[29]在研究CML对TKI耐药性时,发现Wnt/Ca2+/NFAT通路(非经典Wnt信号通路)在耐药CML细胞中的重要性,特别是Fzd8(Wnt受体)的作用,耐药的CML细胞更加依赖于Fzd8的表达存活。因此通过上述学者研究我们可以发现Wnt信号通路在TKI药物耐药方面也起着相关的作用。
2 Wnt信号通路与CML治疗Wnt信号通路在白血病干细胞增殖中是必不可少的,但其对造血干细胞的影响较小,故许多研究人员开始将CML的治疗放在了Wnt信号通路抑制剂的研究当中。Suknuntha等[30]通过研究Wnt信号通路抑制剂FH535在CML细胞系K562细胞中的研究证实FH535可以增强伊马替尼诱导的人白血病细胞系的凋亡。此项研究表明FH535与伊马替尼联合使用可能有较好的治疗效果。Nagao等[31]通过研究新型Wnt信号通路抑制剂AV65对体外伊马替尼敏感的CML细胞影响发现AV65可以抑制各种CML细胞系的增殖,包括携带T315I突变的细胞,AV65通过降低CML细胞中β-catenin的表达诱导CML细胞凋亡。此外,AV65可以抑制过度表达的β-catenin引起的缺氧导致的原始CML细胞的增殖。因此,AV65与伊马替尼组合对CML细胞的增殖具有协同抑制作用。这项研究表明AV65可能成为一种治疗CML的新型药物。
3 小结与展望慢性粒细胞白血病是一种较为多发的血液系统肿瘤,TKI药物的出现为其治疗带来了新的希望。但TKI药物昂贵的治疗费用和可能产生的耐药也为慢粒的治疗带来了新的挑战,尽管极少部分的患者经多年规律的服药可能达到无治疗缓解,但缓解后复发也是目前慢粒治疗中新的困难。目前Wnt信号通路抑制剂已在实体瘤治疗中取得了巨大的成功,但其在慢粒中的应用暂时还处于动物实验阶段,但根据目前研究表明,Wnt信号通路抑制剂可以显著减少白血病干细胞的增殖并且增强TKI药物的疗效。由于TKI药物对白血病干细胞不敏感,故慢粒患者在无治疗缓解后复发多数源于白血病干细胞的持续存在,因此我们可以设想在TKI药物使用的基础上联合Wnt信号通路抑制剂是否可以更快的达到无治疗缓解的目标,并且更加有效的清除慢粒患者体内的白血病干细胞,从而减少复发。Wnt信号通路抑制剂有望为慢粒的治疗打开一个新的局面。
作者贡献
侯艳:收集资料、完成论文撰写; 李文倩:课题的总负责人,承担课题的经费、设计、论文质量把关; 冯建明:参与课题项目申报; 艾国:文章把关; 解友邦:参与课题申报及论文撰写; 华青措:参与论文修改; 赵长明:参与论文书写指导及修改
| [1] | Radich JP, Mauro MJ. Tyrosine Kinase Inhibitor Treatment for Newly Diagnosed Chronic Myeloid Leukemia[J]. Hematol Oncol Clin North Am, 2017, 31(4): 577–87. DOI:10.1016/j.hoc.2017.04.006 |
| [2] | Rowley JD. Letter: A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining[J]. Nature, 1973, 243(5405): 290–3. DOI:10.1038/243290a0 |
| [3] | Saglio G, Sharf G, Almeida A, et al. Considerations for Treatment-free Remission in Patients With Chronic Myeloid Leukemia: A Joint Patient-Physician Perspective[J]. Clin Lymphoma Myeloma Leuk, 2018, 18(6): 375–9. DOI:10.1016/j.clml.2018.04.005 |
| [4] | Kantarjian HM, Talpaz M. Imatinib mesylate: clinical results in Philadelphia chromosome-positive leukemias[J]. Semin Oncol, 2001, 28(5 Suppl 17): 9–18. DOI:10.1053/sonc.2001.29184 |
| [5] | Wehrle J, von Bubnoff N. Ponatinib: A Third-Generation Inhibitor for the Treatment of CML[J]. Recent Results Cancer Res, 2018, 212: 109–18. DOI:10.1007/978-3-319-91439-8 |
| [6] | Corbin AS, Agarwal A, Loriaux M, et al. Human chronic myeloid leukemia stem cells are insensitive to imatinib despite inhibition of BCR-ABL activity[J]. J Clin Invest, 2011, 121(1): 396–409. DOI:10.1172/JCI35721 |
| [7] | Ge X, Wang X. Role of Wnt canonical pathway in hematological malignancies[J]. J Hematol Oncol, 2010, 3: 33. DOI:10.1186/1756-8722-3-33 |
| [8] | Nusse R, Varmus HE. Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome[J]. Cell, 1982, 31(1): 99–109. DOI:10.1016/0092-8674(82)90409-3 |
| [9] | Pai SG, Carneiro BA, Mota JM, et al. Wnt/beta-catenin pathway: modulating anticancer immune response[J]. J Hematol Oncol, 2017, 10(1): 101. |
| [10] | Masamoto Y, Kurokawa M. Targeting chronic myeloid leukemia stem cells: can transcriptional program be a druggable target for cancers?[J]. Stem Cell Investig, 2018, 5: 10. |
| [11] | Ashihara E, Takada T, Maekawa T. Targeting the canonical Wnt/beta-catenin pathway in hematological malignancies[J]. Cancer Sci, 2015, 106(6): 665–71. DOI:10.1111/cas.2015.106.issue-6 |
| [12] | Spaan I, Raymakers RA, van de Stolpe A, et al. Wnt signaling in multiple myeloma: a central player in disease with therapeutic potential[J]. J Hematol Oncol, 2018, 11(1): 67. |
| [13] | Yang K, Wang X, Zhang H, et al. The evolving roles of canonical WNT signaling in stem cells and tumorigenesis: implications in targeted cancer therapies[J]. Lab Invest, 2016, 96(2): 116–36. DOI:10.1038/labinvest.2015.144 |
| [14] | Ashihara E, Kawata E, Nakagawa Y, et al. beta-catenin small interfering RNA successfully suppressed progression of multiple myeloma in a mouse model[J]. Clin Cancer Res, 2009, 15(8): 2731–8. DOI:10.1158/1078-0432.CCR-08-1350 |
| [15] | Savvidou I, Khong T, Cuddihy A, et al. β-Catenin Inhibitor BC2059 Is Efficacious as Monotherapy or in Combination with Proteasome Inhibitor Bortezomib in Multiple Myeloma[J]. Mol Cancer Ther, 2017, 16(9): 1765–78. DOI:10.1158/1535-7163.MCT-16-0624 |
| [16] | Fiskus W, Sharma S, Saha S, et al. Pre-clinical efficacy of combined therapy with novel beta-catenin antagonist BC2059 and histone deacetylase inhibitor against AML cells[J]. Leukemia, 2015, 29(6): 1267–78. DOI:10.1038/leu.2014.340 |
| [17] | Kawahara T, Kawaguchi-Ihara N, Okuhashi Y, et al. Cyclopamine and quercetin suppress the growth of leukemia and lymphoma cells[J]. Anticancer Res, 2009, 29(11): 4629–32. |
| [18] | Khan NI, Bradstock KF, Bendall LJ. Activation of Wnt/beta-catenin pathway mediates growth and survival in B-cell progenitor acute lymphoblastic leukaemia[J]. Br J Haematol, 2007, 138(3): 338–48. DOI:10.1111/bjh.2007.138.issue-3 |
| [19] | Chu S, McDonald T, Lin A, et al. Persistence of leukemia stem cells in chronic myelogenous leukemia patients in prolonged remission with imatinib treatment[J]. Blood, 2011, 118(20): 5565–72. DOI:10.1182/blood-2010-12-327437 |
| [20] | Holyoake TL, Vetrie D. The chronic myeloid leukemia stem cell: stemming the tide of persistence[J]. Blood, 2017, 129(12): 1595–606. DOI:10.1182/blood-2016-09-696013 |
| [21] | Wang Y, Krivtsov AV, Sinha AU, et al. The Wnt/beta-catenin pathway is required for the development of leukemia stem cells in AML[J]. Science, 2010, 327(5973): 1650–3. DOI:10.1126/science.1186624 |
| [22] | Yu S, Li F, Xing S, et al. Hematopoietic and Leukemic Stem Cells Have Distinct Dependence on Tcf1 and Lef1 Transcription Factors[J]. J Biol Chem, 2016, 291(21): 11148–60. DOI:10.1074/jbc.M116.717801 |
| [23] | 刘毅. β-catenin对慢性粒细胞白血病急变期CD34+细胞的影响[C].重庆: 重庆医科大学, 2015. [ Liu Yi.Effects of β-catenin on CD34+ cells in blast caisis of CML[C]. Chongqing: Chongqing Medical University, 2015. ] http://cdmd.cnki.com.cn/Article/CDMD-10631-1016007564.htm |
| [24] | 邹外一, 许多荣, 苏畅, 等. 动态观察慢性髓性白血病患者β-catenin变化与细胞遗传学疗效的关系[J]. 南方医科大学学报, 2010, 30(8): 1868–70, 1873. [ Zou WY, Xu DR, Su C, et al. Dynamic observations of beta-catenin in chronic myeloid leukemia and its relationship with cytogenetic response[J]. Nanfang Yi Ke Da Xue Xue Bao, 2010, 30(8): 1868–70, 1873. ] |
| [25] | Sengupta A, Banerjee D, Chandra S, et al. Deregulation and cross talk among Sonic hedgehog, Wnt, Hox and Notch signaling in chronic myeloid leukemia progression[J]. Leukemia, 2007, 21(5): 949–55. DOI:10.1038/sj.leu.2404657 |
| [26] | 刘旭军, 周晋, 赵艳红, 等. 慢性粒细胞白血病耐药机制及治疗策略[J]. 现代生物医学进展, 2014, 14(5): 975–7. [ Liu XJ, Zhou J, Zhao YH, et al. Resistance mechanisms and treatment strategies of chronic myeloid leukemia[J]. Xian Dai Sheng Wu Yi Xue Jin Zhan, 2014, 14(5): 975–7. ] |
| [27] | Hu Y, Li S. Survival regulation of leukemia stem cells[J]. Cell Mol Life Sci, 2016, 73(5): 1039–50. DOI:10.1007/s00018-015-2108-7 |
| [28] | Zhang B, Li M, McDonald T, et al. Microenvironmental protection of CML stem and progenitor cells from tyrosine kinase inhibitors through N-cadherin and Wnt-beta-catenin signaling[J]. Blood, 2013, 121(10): 1824–38. DOI:10.1182/blood-2012-02-412890 |
| [29] | Gregory MA, Phang TL, Neviani P, et al. Wnt/Ca2+/NFAT signaling maintains survival of Ph+ leukemia cells upon inhibition of Bcr-Abl[J]. Cancer Cell, 2010, 18(1): 74–87. DOI:10.1016/j.ccr.2010.04.025 |
| [30] | Suknuntha K, Thita T, Togarrati PP, et al. Wnt signaling inhibitor FH535 selectively inhibits cell proliferation and potentiates imatinib-induced apoptosis in myeloid leukemia cell lines[J]. Int J Hematol, 2017, 105(2): 196–205. DOI:10.1007/s12185-016-2116-x |
| [31] | Nagao R, Ashihara E, Kimura S, et al. Growth inhibition of imatinib-resistant CML cells with the T315I mutation and hypoxia-adaptation by AV65--a novel Wnt/beta-catenin signaling inhibitor[J]. Cancer Lett, 2011, 312(1): 91–100. DOI:10.1016/j.canlet.2011.08.002 |
 2019, Vol. 46
2019, Vol. 46


