文章信息
- FoxO3基因与膀胱癌临床病理特征及预后的相关性
- Correlation of FoxO3 Gene with Clinicopathological Features and Prognosis of Bladder Cancer Patients
- 肿瘤防治研究, 2019, 46(1): 58-62
- Cancer Research on Prevention and Treatment, 2019, 46(1): 58-62
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0806
- 收稿日期: 2018-06-15
- 修回日期: 2018-08-23
2. 410000 长沙,中南大学湘雅二医院普外科
2. Department of General Surgery, Xiangya 2nd Hospital of Central South University, Changsha 410000, China
膀胱癌是泌尿生殖道恶性肿瘤,它对人类泌尿生殖系统的危害仅次于前列腺癌,是全球最常见的九大癌症之一,每年因膀胱癌死亡的人数不断上升,引起了人们的广泛关注[1-2]。膀胱癌的大部分病例为非肌层浸润性膀胱癌,其中大部分患者预后较好,但容易复发,复发后甚至可能进展为肌层浸润性膀胱癌[3-4];而其余部分预后不良的病例中死亡率约占50%[5]。对于浸润性膀胱癌的治疗,标准的方法仍以根治手术切除膀胱为主,同时联合化疗[6]。对于不能耐受或不愿意接受根治手术的患者,可采用膀胱部分切除(电切至肿瘤周围正常组织1.0 cm)联合辅助化疗的方法,它的优点是膀胱的保留率较高,同时还避免了根治性膀胱切除术后的并发症及对生活质量的影响,但临床分期、病理分级是决定预后的重要因素[7]。目前对于膀胱癌的确切发病机制尚不清楚,但膀胱癌的发生、发展与染色体异常、表观遗传学改变和遗传多态性密切相关,其遗传学改变与其治疗及预后密切相关[8-9]。大量研究已经证明癌基因和肿瘤抑制因子的表达在膀胱癌的发生和发展中起重要作用,在膀胱癌的早期检测和预后中发现新的生物标志物[10-11]。
叉头框O类(FoxO)转录因子属于转录调控因子的叉头家族,其特征在于由4个成员即FoxO1、FoxO3、FoxO4和FoxO6组成的称为“叉头框”的保守DNA结构域[12]。研究人员发现它们参与了细胞周期的调控、凋亡和对活性氧的抗性等多种细胞过程[13-15]。同时,也揭示了这些转录因子起到肿瘤抑制因子的作用,有利于干细胞的维持和寿命延长[16]。最新研究报道指出,在癌细胞凋亡过程中,circ-FoxO3被发现显著增加,能诱导肿瘤细胞的凋亡[17]。有研究表明FoxO3在许多癌症如乳腺癌和前列腺癌的发展中起着非常重要的作用[18-19]。因此,本研究旨在探讨FoxO3表达与膀胱癌临床病理特征及预后的关系。
1 资料与方法 1.1 资料收集湘雅二医院2011年1月—2013年1月期间,术后病理证实为膀胱癌患者的临床资料及其癌组织及癌旁组织标本111例,男79例,女32例。年龄36~79岁,平均年龄55.23±8.72岁。根据第7版AJCC癌症TNM分期[20],Tis~T1浅表性膀胱癌共63例,T2~T3非浅表性膀胱癌共48例。根据WHO2004分级法[21],组织学分型低级别77例,高级别34例。局部淋巴结转移者33例,无淋巴结局部转移者78例。全部111例膀胱癌组织作为实验组,在患者术后,依据患者的病情及实际情况进行相应的辅助治疗,分为根治性膀胱切除术8例,根治性膀胱切除术+GC方案(吉西他滨+顺铂)23例,电切手术+吉西他滨膀胱灌注63例,电切手术+MVAC方案(甲氨蝶呤+长春花碱+阿霉素+顺铂)10例,电切手术+CMV方案(顺铂、甲氨蝶呤和长春新碱)7例。同时取距肿瘤边缘1~2 cm以上,经病理证实为正常膀胱组织的111例癌旁正常组织作为对照组。
纳入标准:(1)经病理学明确诊断为膀胱癌; (2)具有充分的影像学检查和临床检查支持诊断; (3)出院后患者至少接受过一次随访或检查。排除标准:(1)患有其他肿瘤疾病; (2)接受治疗前膀胱癌已有远处转移者。本研究通过湘雅二医院临床试验伦理委员会批准,所有患者均对研究知情同意,并签署知情同意书。
1.2 实时荧光定量PCR检测FoxO3 mRNA含量提取肿瘤及癌旁正常组织中总RNA。总RNA提取试剂盒购买于北京天恩泽基因科技公司,反转录试剂盒购自杭州博日科技有限公司,操作步骤严格按照试剂盒说明。使用紫外分光光度计检测提取后的各RNA样本的OD260/280值,并计算RNA浓度,置-80℃保存备用。实时荧光定量PCR(real-time fluorescent quantitative polymerase chain reaction, RT-qPCR)方法测定样品中Foxo3 mRNA的含量。根据Genbank数据库公开的基因及miR BASE数据库中的基因序列,使用Primer5.0引物设计软件,通过上海生工公司合成引物。引物序列见表 1。PCR试剂盒购自美国Bio-Rad公司,RT-qPCR仪器使用德国ABI公司7500型定量PCR仪。RT-qPCR反应程序如下:95℃预变性30 s,然后按以下条件循环40次:变性95℃ 5 s,退火/延伸30 s。检测结果以β-actin为内参照,将目标基因的Ct值与β-actin的Ct值作对比,计算各目的基因mRNA的相对表达量,ΔCt目标=Ct目标-Ctβ-actin,ΔΔCt=ΔCt实验组–ΔCt对照组,以2-ΔΔCt表示两组目标基因表达量的比值[22]。
使用石蜡标本提取蜡块切片总蛋白,BCA法测蛋白浓度。取50 μg总蛋白变性后进行SDS-PAGE恒压电泳,半干法将电泳产物转移到PVDF膜上,5%脱脂奶粉封闭,4℃封闭2 h,滴加一抗(兔FoxO3多克隆抗体购于Abcam公司),4℃条件下保存10 h,TBST洗4次,每次10 min,滴加辣根过氧化物酶标记的二抗(山羊抗兔IgG,Santa Cruz公司),37℃条件下孵育2 h,TBST洗10 min,4次,ECL试剂盒进行显色,凝胶电泳成像分析系统自动成像并以β-actin为内参分析FoxO3蛋白的相对含量。
1.4 免疫组织化学染色采用SP法检测膀胱癌组织及癌旁正常组织中FoxO3蛋白的表达情况。选用已知正常膀胱组织切片作为阳性对照,用PBS代替一抗作为阴性对照,HistostainTMSP-9000免疫组织化学染色试剂盒(Zymed公司)染色。常规脱蜡至水的样本石蜡切片,微波加热修复抗原,至沸腾后停止加热5 min,然后重复加热一次,冷却至常温。切片经过PBS冲洗后滴加正常山羊血清。滴加一抗(兔FoxO3多克隆抗体购于Abcam公司),4℃过夜。复温并用PBS冲洗后,滴加二抗工作液(生物素标记山羊抗兔IgG),37℃下30 min。PBS冲洗后滴加辣根标记工作液孵育,DAB显色5~10 min,镜下调整染色时间,苏木精对比染色1 min后树胶封片,拷片后拍照保存。镜下随机取10个视野,根据每个视野中阳性细胞数,阳性染色细胞≤10%为阴性表达; > 10%为阳性表达。
1.5 随访首先对所有患者采用电话随访的方式了解其存活情况,随后对于仍存活的患者再采用门诊随访。随访截至2017年10月。统计5年总生存期和无瘤生存时间。总生存期为手术到死亡或最后随访时间,无瘤生存时间为手术至肿瘤复发或转移。根据随访结果绘制Kaplan-Meier(K-M)生存曲线,比较总生存率和无瘤生存率。所有患者均完成随访。
1.6 统计学方法应用SPSS统计学软件对数据进行分析。计量资料数据均以均数±标准差(x±s)表示。服从正态分布的计量资料两组之间的比较采用t检验和配对t检验。使用单因素方差分析进行多组间比较; 方差不齐时则行使Welch法,通过Dunnetts’T3检验进行组间多重比较。计数资料用χ2检验。预后的单因素分析采用Kaplan-Meier法,采用Log rank检验; 预后的多因素分析采用Cox模型; 相关分析采用Spearman等级法。P < 0.05为差异有统计学意义。
2 结果 2.1 免疫组织化学结果Foxo3蛋白主要集中表达于细胞核,细胞质弱表达,呈棕黄色或棕褐色颗粒的阳性反应,见图 1。Foxo3蛋白阳性表达率在膀胱癌组织中为32.4%,低于癌旁正常组织的72.1%(P < 0.05),见表 2。
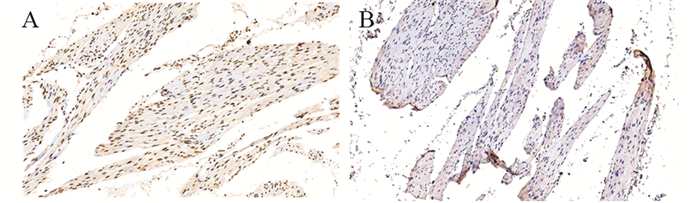
|
| 图 1 免疫组织化学检测癌旁正常(A)及膀胱癌组织(B)中FoxO3的表达(×200) Figure 1 FoxO3 expression in adjacent normal tissues(A) and bladder cancer tissues(B) detected by immunohistochemical method (×200) |

|
与癌旁正常组织相比,膀胱癌组织中的Foxo3 mRNA及其蛋白的表达显著下降(P < 0.0001),见图 2。
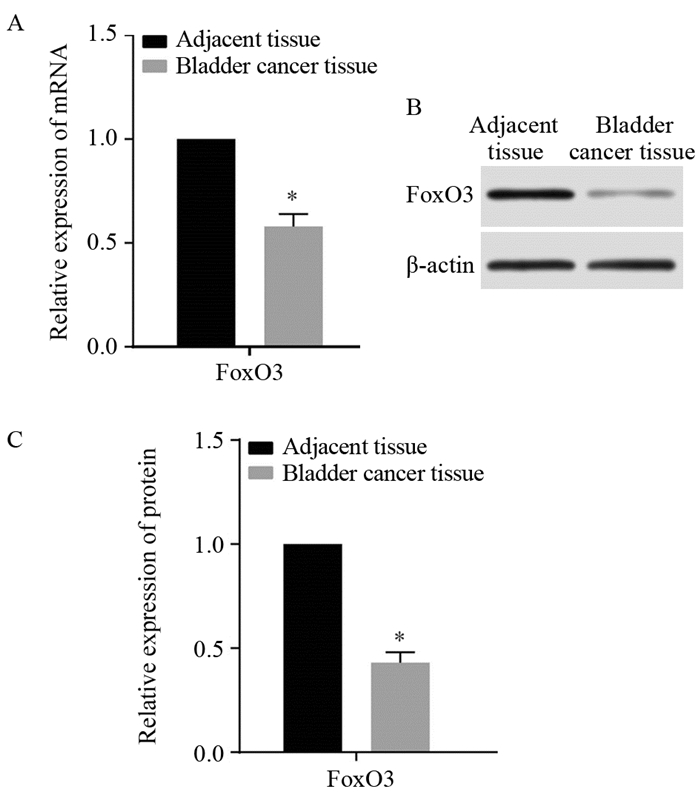
|
| *: P < 0.05, compared with adjacent normal tissues 图 2 RT-qPCR(A)及Western blot(B, C)检测膀胱癌及癌旁组织中Foxo3表达结果 Figure 2 FoxO3 expression in bladder cancer tissues and adjacent tissues was detected by RT-qPCR(A) and Western blot(B, C) analysis |
膀胱癌淋巴结转移组的Foxo3蛋白阳性率均显著低于无转移组(P=0.03)。TNM分期中,T2~T3浸润性膀胱癌组的Foxo3蛋白阳性率均显著低于Tis~T1浅表性膀胱癌组(P=0.0014)。WHO2004分级中,高级别组的Foxo3蛋白阳性率均显著低于低级别组(P=0.0018)。不同性别、年龄的膀胱癌患者Foxo3蛋白表达差异无统计学意义(P > 0.05),见表 3。
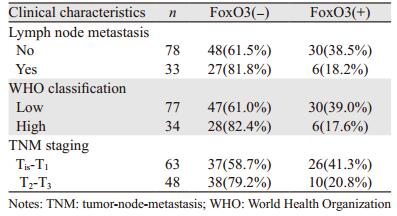
|
本组111例患者随访时间60月,失访12例,死亡59例,总生存率为46.9%。局部复发、转移70例,总体无瘤生存率为36.9%。对Foxo3在膀胱癌中的表达进行K-M分析显示,膀胱癌组织中Foxo3阳性者总体生存率(P=0.005)和总体无瘤生存率(P < 0.001)均显著高于FoxO3阴性者,见图 3。
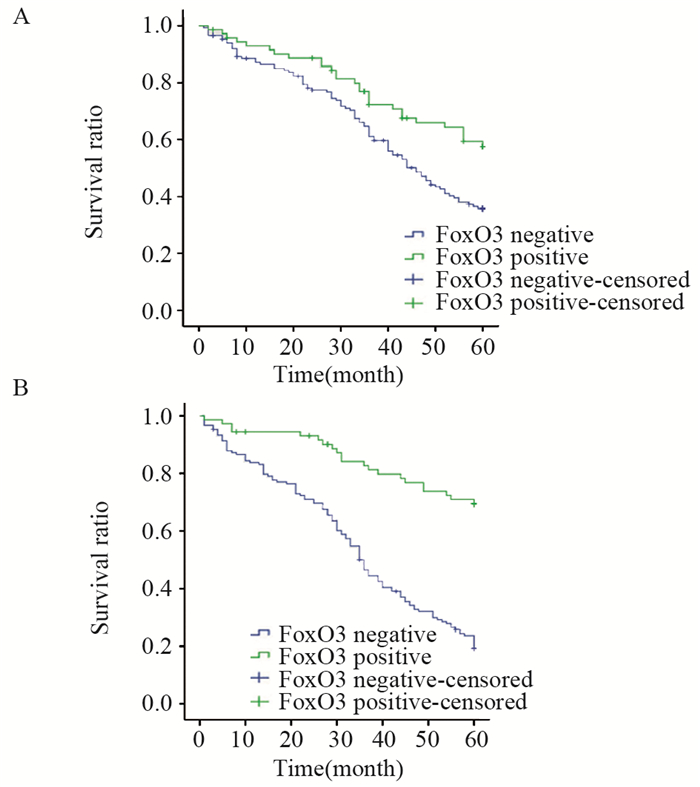
|
| 图 3 FoxO3表达与术后总体生存率(A)和无瘤生存率(B)的关系 Figure 3 Correlation of FoxO3 expression with postoperative overall survival ratio(A) and tumor-free survival ratio(B) |
将患者性别、年龄、Foxo3表达、淋巴结转移、TNM分期、WHO分级、治疗方法与预后的关系分别进行比较,治疗方法以手术治疗和手术结合辅助治疗分类,采用多因素Cox比例风险模型分析后,结果显示,Foxo3阴性表达、TNM分期、淋巴结转移和WHO分期是患者预后不良的影响因素(均P < 0.05)。而年龄、性别、治疗方法则与预后无关(均P > 0.05),见表 4。
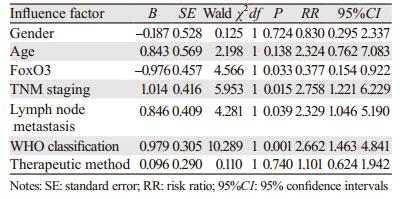
|
在过去30年里,转移性膀胱癌的治疗并没有取得重大的进展。尽管膀胱切除术联合新辅助化疗与膀胱癌患者预后的改善相关,但后期患者的生存率依然较差[23]。因此,从分子水平的角度来解决这一疾病至关重要。
本研究结果发现,与邻近的正常组织相比,膀胱癌组织中FoxO3的表达下降。众所周知,FoxO家族受多种信号转导途径调控,最重要的是PI3K-PKB/c-Akt信号通路[24]。该途径的直接磷酸化导致FoxO失活,膀胱癌也随着通路的逐渐磷酸化而发展[25]。这可能是FoxO3基因在膀胱癌组织减少的一种方式。同时也有人指出,所有FoxO家族成员的广泛体细胞缺失造成了进行性癌症倾向并且以血管瘤和胸腺淋巴瘤为特征的病症,表明FoxO是肿瘤抑制剂[26],这进一步支持了我们的结果。
早期研究表明,FoxO3a阳性表达与乳腺癌临床分期、腋窝淋巴结转移和预后相关[27]。在结直肠癌中,研究人员发现FoxO3表达可能与肿瘤分化、浸润深度、淋巴结转移、TNM分期和组织学分类有关,且FoxO3可能成为判定结直肠癌严重程度及预后效果的预测因子[28]。本研究也发现,浸润性膀胱癌患者的FoxO3蛋白阳性率低于浅表性膀胱癌患者,淋巴结转移患者FoxO3蛋白阳性率明显低于无淋巴结转移者。所有原发性膀胱肿瘤中约90%来源于膀胱黏膜的移行细胞癌,然后逐渐侵入固有层,并转移到固有肌层,周围脂肪和邻近的盆腔结构中,并且发展伴随着淋巴瘤发病率的增加淋巴结转移。随着肿瘤恶化入侵和淋巴结转移的晚期,膀胱癌细胞中持续的Akt激活,通过下调大量的转录因子FoxO3促进细胞分化和存活[25]。此外,我们还发现FoxO3在膀胱癌组织中的阳性表达与患者中较高的OS率相关。通过诱导Fas配体,Bcl-2家族成员和肿瘤坏死因子相关凋亡诱导配体等死亡受体配体的表达,活化的FoxO3蛋白很有可能增强细胞凋亡,因此阻止膀胱癌的进展[17]。
综上所述,我们推测FoxO3的表达可能与膀胱癌的临床病理特征和预后相关。因此,FoxO3的表达可以作为膀胱癌的预后指标。同时我们收集了来自根治性膀胱切除术、电子切除术以及根治性膀胱切除术、电子切除术与辅助化疗相结合的几种方法来源的病例样本,经Cox回归分析后表明手术与手术结合辅助治疗对患者的预后无明显差异,猜测原因可能与样本量较少、患者个体差异较大有关,因此这几种治疗方式对本研究患者的生存率分析影响无统计学意义,针对治疗方法与预后的相关性,仍需要我们后期会进一步研究更大的样本数据,以期重点研究不同的治疗方法对患者生存率的影响,同时结合FoxO3等相关蛋白分子的表达水平探讨它们共同作用下对患者生成率的影响。
作者贡献
杨晗杰:负责临床病理组织分析及全文统筹; 刘各亮:负责病理组织实验及分析; 刘波:负责分子生物学实验及报告分析
| [1] | Cattrini C, Boccardo F. Atezolizumab and bladder cancer: facing a complex disease[J]. Lancet, 2018, 391(10118): 305–6. |
| [2] | Luo CT, Liao W, Dadi S, et al. Graded Foxo1 activity in Treg cells differentiates tumour immunity from spontaneous autoimmunity[J]. Nature, 2016, 529(7587): 532–6. DOI:10.1038/nature16486 |
| [3] | 伦雪萍, 静进. 浅表性膀胱癌患者应对方式与生存质量相关性研究[J]. 中华肿瘤防治, 2013, 20(22): 1763–6. [ Lun XP, Jing J. Correlation of coping style with quality of life in superficial bladder cancer patients[J]. Zhonghua Zhong Liu Fang Zhi, 2013, 20(22): 1763–6. DOI:10.3969/j.issn.1673-5269.2013.22.015 ] |
| [4] | Martin-Doyle W, Leow JJ, Orsola A, et al. Improving selection criteria for early cystectomy in high-grade t1 bladder cancer: a meta-analysis of 15, 215 patients[J]. J Clin Oncol, 2015, 33(6): 643–50. DOI:10.1200/JCO.2014.57.6967 |
| [5] | Perez A, Loizaga A, Arceo R, et al. A Pilot Study on the Potential of RNA-Associated to Urinary Vesicles as a Suitable Non-Invasive Source for Diagnostic Purposes in Bladder Cancer[J]. Cancers(Basel), 2014, 6(1): 179–92. |
| [6] | Milowsky MI, Rumble RB, Booth CM, et al. Guideline on Muscle-Invasive and Metastatic Bladder Cancer (European Association of Urology guideline): American Society of Clinical Oncology Clinical Practice Guideline Endorsement[J]. J Clin Oncol, 2016, 34(16): 1945–52. DOI:10.1200/JCO.2015.65.9797 |
| [7] | 邓建军, 李迎. Skp2蛋白与子宫内膜样癌发生及临床病理特征的关系[J]. 中国妇产科临床杂志, 2016, 17(5): 410–2. [ Deng JJ, Li Y. The relationship between Skp2 protein and the occurrence and clinical pathological characteristics of endometrial carcinoma[J]. Zhongguo Fu Chan Ke Lin Chuang Za Zhi, 2016, 17(5): 410–2. ] |
| [8] | Curtius K, Wright NA, Graham TA, et al. An evolutionary perspective on field cancerization[J]. Nat Rev Cancer, 2018, 18(1): 19–32. |
| [9] | Hurst CD, Alder O, Platt FM, et al. Genomic Subtypes of Non-invasive Bladder Cancer with Distinct Metabolic Profile and Female Gender Bias in KDM6A Mutation Frequency[J]. Cancer Cell, 2017, 32(5): 701–15. DOI:10.1016/j.ccell.2017.08.005 |
| [10] | Das TP, Suman S, Alatassi H, et al. Inhibition of AKT promotes FOXO3a-dependent apoptosis in prostate cancer[J]. Cell Death Dis, 2016, 7: e2111. DOI:10.1038/cddis.2015.403 |
| [11] | Yu C, Zhang Z, Liao W, et al. The tumor-suppressor gene Nkx2.8 suppresses bladder cancer proliferation through upregulation of FOXO3a and inhibition of the MEK/ERK signaling pathway[J]. Carcinogenesis, 2012, 33(3): 678–86. DOI:10.1093/carcin/bgr321 |
| [12] | Luo CT, Li MO. Foxo transcription factors in T cell biology and tumor immunity[J]. Semin Cancer Biol, 2018, 50: 13–20. DOI:10.1016/j.semcancer.2018.04.006 |
| [13] | Wilhelm K, Happel K, Eelen G, et al. FOXO1 couples metabolic activity and growth state in the vascular endothelium[J]. Nature, 2016, 529(7585): 216–20. DOI:10.1038/nature16498 |
| [14] | Liu Y, Ao X, Ding W, et al. Critical role of FOXO3a in carcinogenesis[J]. Mol Cancer, 2018, 17(1): 104. |
| [15] | Kim DH, Park MH, Lee EK, et al. The roles of FoxOs in modulation of aging by calorie restriction[J]. Biogerontology, 2015, 16(1): 1–14. DOI:10.1007/s10522-014-9519-y |
| [16] | Eijkelenboom A, Burgering BM. FOXOs: signalling integrators for homeostasis maintenance[J]. Nat Rev Mol Cell Biol, 2013, 14(2): 83–97. |
| [17] | Du WW, Fang L, Yang W, et al. Induction of tumor apoptosis through a circular RNA enhancing Foxo3 activity[J]. Cell Death Differ, 2017, 24(2): 357–70. DOI:10.1038/cdd.2016.133 |
| [18] | Taylor S, Lam M, Pararasa C, et al. Evaluating the evidence for targeting FOXO3a in breast cancer: a systematic review[J]. Cancer Cell Int, 2015, 15(1): 1. |
| [19] | Liu H, Yin J, Wang H, et al. FOXO3a modulates WNT/β-catenin signaling and suppresses epithelial-to-mesenchymal transition in prostate cancer cells[J]. Cell Signal, 2015, 27(3): 510–8. DOI:10.1016/j.cellsig.2015.01.001 |
| [20] | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471–4. DOI:10.1245/s10434-010-0985-4 |
| [21] | Sobin LH. The WHO histological classification of urinary bladder tumours[J]. Urol Res, 1978, 6(4): 193–5. DOI:10.1007/BF00262616 |
| [22] | Chiong M, Cartes-Saavedra B, Norambuena-Soto I, et al. Mitochondrial metabolism and the control of vascular smooth muscle cell proliferation[J]. Front Cell Dev Biol, 2014, 2: 72. |
| [23] | 王力, 刘建民. 新辅助化疗联合经尿道膀胱肿瘤电切术治疗肌层浸润性膀胱癌疗效及预后分析[J]. 吉林医学, 2017, 38(8): 1429–31. [ Wang L, Liu JM. Clinical efficacy and prognosis of neoadjuvant chemotherapy combined with TURBT method used for muscle-invasive bladder cancer[J]. Jilin Yi Xue, 2017, 38(8): 1429–31. DOI:10.3969/j.issn.1004-0412.2017.08.013 ] |
| [24] | Ananda Sadagopan SK, Mohebali N, Looi CY, et al. Forkhead Box Transcription Factor (FOXO3a) mediates the cytotoxic effect of vernodalin in vitro and inhibits the breast tumor growth in vivo[J]. J Exp Clin Cancer Res, 2015, 34: 147. DOI:10.1186/s13046-015-0266-y |
| [25] | Yang H, Zhao R, Yang HY, et al. Constitutively active FOXO4 inhibits Akt activity, regulates p27 Kip1 stability, and suppresses HER2-mediated tumorigenicity[J]. Oncogene, 2005, 24(11): 1924–35. DOI:10.1038/sj.onc.1208352 |
| [26] | 羊丽丽, 王晓燕, 郑丽云, 等. FOX03a-Bim信号在雷公藤酯醇诱导膀胱癌T24细胞凋亡中的作用[J]. 中华医学杂志, 2017, 97(15): 1187–90. [ Yang LL, Wang XY, Zheng LY, et al. The role of FOXO3a-Bim signaling in triptolide induced bladder cancer T24 cells apoptosis[J]. Zhonghua Yi Xue Za Zhi, 2017, 97(15): 1187–90. DOI:10.3760/cma.j.issn.0376-2491.2017.15.016 ] |
| [27] | 徐骏飞, 江颖, 倪启超, 等. 乳腺癌组织中FOX03α、β-Catenin、PCNA的表达及临床意义[J]. 山东医药, 2011, 51(27): 16–8. [ Xu JF, Jiang Y, Ni QC, et al. Expression and significance of FOX03α, β-Catenin and PCNA in the tissue of breast cancer[J]. Shandong Yi Yao, 2011, 51(27): 16–8. DOI:10.3969/j.issn.1002-266X.2011.27.009 ] |
| [28] | 刘鑫, 胡皆乐, 李佑, 等. FOXO3在结直肠癌组织中的表达及临床意义[J]. 实用癌症杂志, 2016, 31(11): 1773–7. [ Liu X, Hu JL, Li Y, et al. Expression and Clinical Significance of FOXO3 in Colorectal Carcinoma[J]. Shi Yong Ai Zheng Za Zhi, 2016, 31(11): 1773–7. DOI:10.3969/j.issn.1001-5930.2016.11.010 ] |
 2019, Vol. 46
2019, Vol. 46

