文章信息
- 肿瘤标志物和肺门淋巴结与肺腺癌全身骨显像骨转移的关系
- Relationship of Tumor Markers and Hilar Lymph Nodes with Bone Metastasis of Whole Body Bone Imaging in Lung Adenocarcinoma
- 肿瘤防治研究, 2019, 46(2): 149-152
- Cancer Research on Prevention and Treatment, 2019, 46(2): 149-152
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0703
- 收稿日期: 2018-05-29
- 修回日期: 2018-09-13
肺癌,包括小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),非小细胞肺癌又包括腺癌、鳞癌、大细胞癌,是我国常见的恶性肿瘤之一[1]。肺癌的发病居恶性肿瘤首位,症状早期多不明显,待出现刺激性干咳、痰中带血或血痰、胸痛、发热、气促等症状时就诊,多已到中晚期,此时患者易出现多脏器转移,其中包括骨骼,引起骨骼疼痛、病理性骨折、贫血、脊髓压迫等,导致机体出现一系列的功能障碍,致使患者的生存质量下降。SPECT是确认患者是否出现骨转移的方法,临床应用率较高。肿瘤标志物是指存在于患者血液、体液和组织中的,与肿瘤发生发展有关的物质,其含量远超正常组织,在体外能用免疫学、生物学及化学的方法检测到,对肿瘤的诊断、分类、转归、复发判断及指导临床治疗均有重要参考意义。本研究探讨肿瘤标志物和肺门淋巴结与肺腺癌全身骨显像骨转移之间的关系。
1 资料与方法 1.1 基本资料选取2012年6月—2017年6月在北京协和医学院肿瘤医院病理科确诊的肺腺癌患者278例,其中骨转移者78例,占28%。其中女39例,年龄29~77岁,平均年龄53岁;男39例,年龄35~81岁,平均年龄58岁。未发生骨转移者200例,占72%。其中女125例,年龄34~80岁,平均年龄57岁;男75例,年龄35~82,平均年龄58.5岁。所有患者确诊后均行全身骨显像检查。纳入标准:(1)均经我院病理科确诊为肺腺癌;(2)无其他恶性肿瘤病史;(3)所用诊断信息CA125、CYFRA21-1、NSE、SCC、CEA、ProGRP、ALP、肺门淋巴节等均是初诊时或者与骨显像日期相近时间采集的数据。排除标准:(1)初诊患者中数据不全者;(2)严重肝肾功能障碍者。
1.2 研究方法 1.2.1 SPECT全身骨显像锝-亚甲基二膦酸盐(99mTc-MDP)由原子高科有限公司和北京森科公司提供,剂量为15~20 mCi,注射药物后,嘱患者饮水500~1 000 ml,注射后3 h开始行全身骨显像。所用仪器:美国SIEMENS公司制造Symbia T SPECT/CT和美国GE公司制造MillenniumTM VG SPECT/CT,配置低能高分辨准直器,能峰140,窗宽20%,矩阵1024×256。结果由有经验的2位高年资核医学医师审阅。骨转移诊断标准:(1)图像中局部有放射性浓聚,高于健侧或临近组织,且排除外伤、骨折,尤其是未能确诊的隐匿性骨折、炎性反应、退化等假阳性病变;(2)≥3处出现放射性浓聚灶为多发骨转移;(3)1~2处出现浓聚灶再结合本院MR确诊后,可判定为骨转移;(4)有放射性浓聚的单发病灶,但CT或MR未确定者可判断为可疑或退化,并按时复查;(5)CT或MR确诊骨质破坏而SPECT未出现,为阴性。CT、MR由放射科医师做出诊断。
1.2.2 相关肿瘤标志物检测采集患者清晨空腹静脉血样,全自动免疫电化学发光分析仪对糖类抗原(CA125)、细胞角蛋白可溶性片段19(CYFRA21-1)、神经元特异性烯醇化酶(NSE)、鳞状细胞癌抗原(SCC)、癌胚抗原(CEA)、胃泌素释放肽前体(ProGRP)六项肿瘤标志物进行检测,碱性磷酸酶(ALP)采用罗氏酶法检测。
1.3 统计学方法采用SPSS19.0统计软件进行单因素Pearson卡方分析,Logistic二分类回归分析软件处理数据,由于CA125、CYFRA21-1、NSE、SCC、CEA、ProGRP、ALP、肺门淋巴节均不符合正态分布,且骨显像为0骨未转、1骨转移两个类别,因此,对二分类变量和计量数据采用Pearson卡方检验法,获得初步的结果,然后利用二分类Logistic回归法分析CA125、CYFRA21-1、NSE、SCC、CEA、ProGRP、ALP、肺门淋巴节等与骨显像转移之间的关系,用比值比OR(odds ratio)表示,当OR > 1,是骨转移的危险因素;OR=1,与骨转移无关;OR < 1是保护性因素即该因素暴露时少骨转移发生。以P < 0.05为差异具有统计学意义。
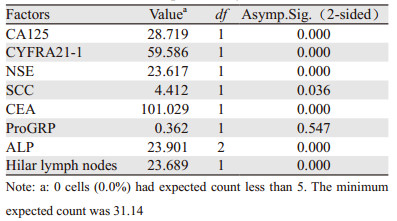
2 结果 2.1 单因素卡方分析结果除ProGRP与骨转移无关(P > 0.05),CA125、CYFRA21-1、NSE、SCC、CEA、ALP、肺门淋巴节均是骨转移的危险因素(P < 0.05),见表 1。
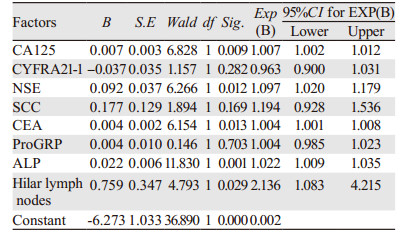
CA125、NSE、CEA、ALP和肺门淋巴节均有统计学意义,是骨转移的危险因素(均OR > 1且均P < 0.05);SCC、ProGRP无统计学意义,是骨转移的危险因素(OR > 1, P > 0.05);CYFRA21-1不是骨转移的危险因素(OR < 1),见表 2。
肺腺癌主要发生于黏液腺或肺边缘的杯状细胞内[2],其发病特点与肺癌总特点相似,发病隐匿,症状不易察觉,确诊时多已到中晚期,致使患者多处器官出现转移,其中包括骨骼,此时患者检查全身骨显像,将有30%~40%(本文28%)的患者发生骨转移[3],而骨转移预示患者的生活质量下降和生存期的缩短。本研究重点论述SPECT全身骨显像骨转移的发生与肺癌肿瘤标志物和肺门淋巴结的关系。
糖类抗原(CA125)是一种糖蛋白,是卵巢癌相关抗原[4-5],它不是肺癌的特异标志物,但对肺癌的诊断起一定的作用,更重要的是对肺腺癌的转移和预后具有重要意义[6]。在正常范围内(0~35 U/ml)的患者179例,其中骨转移31例,占11.2%(31/278);而大于35 U/ml的患者99例,骨转移者47例,占16.9%(47/278),高于正常范围内发生转移者。单因素(P < 0.05)和Logistic(P < 0.05, OR > 1)二分类分析均提示是骨转移的危险因素,与陈静[4]、张凌[6]、Pollab[7]等研究相似。
癌胚抗原(CEA)是一种广谱肿瘤标志物,主要用于肠癌的诊断,对肺腺癌也有重要的诊断价值[4-5]。Arrieta[8]等认为升高的CEA是脑转移的危险因素。CEA在正常范围内(0~5 ng/ml)的161例患者中,骨转移8例,占2.8%;大于5 ng/ml的117例患者中,骨转移者70例,占25.1%,是正常范围内骨转移患者的9倍,这说明骨转移的发生与血中CEA升高有一定的关系,与吴琼[9]、刘俊[10]等研究相同,同时,朱自力等[11]也认为CEA与骨转移的关联性最强。本文中单因素(P < 0.05)和Logistic(P < 0.05, OR > 1)分析均提示CEA是骨转移的危险因素,还与晚期总存活率预后不良有关[11]。
碱性磷酸酶(ALP)是骨代谢标志物,在骨细胞受到癌细胞侵袭并形成成骨转移灶时,其数值升高。在正常范围40~150 U/L之间,骨转移67例;大于150 U/L的13例患者中,未发生骨转移者2例,发生骨转移者11例,是未发生骨转者5倍。本文中单因素(P < 0.05)和Logistic(P < 0.05, OR > 1)分析均提示ALP与骨转移的发生有关,与朱礼[12]、李磊[13]的研究相似。
神经特异性烯醇化酶(NSE)也是肺癌的肿瘤标志物之一,是恶性程度高、进展快的小细胞肺癌的首选标志物,也是肿瘤扩散的重要标志物;而在某些NSCLC中,由于具有与SCLC相似的生物学行为,因此NSE也可用于NSCLC的诊断[7]。在NSE 0~18 ng/ml正常范围内有238例患者,其中发生骨转移54例;在 > 18 ng/ml范围内有患者40例,发生骨转移24例。单因素分析P < 0.05和Logistic分析均提示是肺腺癌骨转移的危险因素(P < 0.05, OR > 1),与张炜[14]研究相似。
单因素分析显示鳞状细胞癌抗原(SCC)与骨转移有关(P < 0.05),Logistic分析显示是骨转移的危险因素(OR > 1),但不具统计学意义(P > 0.05),而王颖颖[5]、张凌[6]等研究认为SCC主要用于鳞癌的诊断,并且认为SCC对鳞癌的诊断作用强于腺癌和小细胞癌,对肺腺癌的诊断作用有限,因此结合本文分析,SCC与肺腺癌骨转移无关。
胃泌素释放肽前体(ProGRP)对小细胞肺癌具有较高的特异性[6-7],并与NSE一起用于小细胞肺癌的诊断和预后。Logistic分析结果显示ProGRP是骨转移的危险因素(OR > 1),但无统计学意义,且单因素分析显示与骨转移无关(P > 0.05),因此ProGRP不是肺腺癌骨转移的危险因素。
单因素分析显示细胞角蛋白可溶性片段19(CYFRA21-1)与骨转移有关(P < 0.05),Logistic分析表明它不是肺腺癌骨转移的危险因素(P > 0.05, OR < 1)。CYFRA21-1与鳞癌的发生发展有关,主要与SCC一起用于鳞癌的诊断[7];但在论证与骨转移的关系上,吴琼[9]、刘俊[10]均认为CYFRA21-1与骨转移有关,但没有具体说明是与腺癌骨转移有关,还是与鳞癌或小细胞癌有关,本文分析结果表明CYFRA21-1不是肺腺癌骨转移的危险因素。
肿瘤肺门淋巴节转移主要通过血液、淋巴、局部侵袭三种途径。本文278例患者中未发生淋巴结转移者167例,其中发生骨转移29例,占比10%;发生淋巴结转移者111例,其中骨转移者49例,占比17%,后者数值高于前者。单因素和Logistic分析(P < 0.05, OR > 1)均说明与肺腺癌骨转移有关,是骨转移的危险因素,但相关文献较少。
综上所述,CA125、CEA、ALP、NSE、肺门淋巴节是肺腺癌骨转移的危险因素,SCC与肺腺癌骨转移的关系还需进一步论证;ProGRP、CYFRA21-1不是肺腺癌骨转移的危险因素。
作者贡献
曹仲年:负责论文的撰写及修改 郑 容:负责论文的审核 魏正茂、洪浩、关志梅、李玉焕:负责实验数据的审核
| [1] | 张树才, 张卉. 《中国原发性肺癌诊疗规范(2015版)》内科治疗解析[J]. 中华医学信息导报, 2015, 30(8): 19. [ Zhang SC, Zhang H. hinese Standard for the diagnosis and treatment of Primary Lung Cancer, 2015 Edition.Analysis of medical treatment[J]. Zhonghua Yi Xue Xin Xi Dao Bao, 2015, 30(8): 19. DOI:10.3760/j.issn.1000-8039.2015.08.014 ] |
| [2] | 朱韧, 徐建芳, 张海平. 全身骨扫描在临床诊断肺癌骨转移中的作用分析[J]. 中国癌症杂志, 2008, 18(5): 389–92. [ Zhu R, Xu JF, Zhang HP. The evaluation of whole body Bone scanning in detecting bone metastasis in patients with lung cancer[J]. Zhongguo Ai Zheng Za Zhi, 2008, 18(5): 389–92. DOI:10.3969/j.issn.1007-3639.2008.05.014 ] |
| [3] | 孙燕, 管忠震, 廖美琳, 等. 肺癌骨转移诊疗专家共识(2014版)[J]. 中国肺癌杂志, 2014, 17(2): 57–72. [ Sun Y, Guan ZZ, Liao ML. The diagnosis and treatment of Lung Cancer Bone Metastasis[J]. Zhongguo Fei Ai Za Zhi, 2014, 17(2): 57–72. ] |
| [4] | 陈静, 段凤英. 血清肿瘤标志物检测在肺癌中的临床应用价值[J]. 南昌大学学报(医学版), 2014, 54(3): 92–5. [ Chen J, Duan FY. Clinical applicable value of Serum tumor markers in Lung Cancer[J]. Nanchang Da Xue Xue Bao (Yi Xue Ban), 2014, 54(3): 92–5. ] |
| [5] | 王颖颖, 赵静. 探讨肺癌肿瘤标志物联合检测在诊断中的意义[J]. 实验与检验医学, 2016, 34(5): 639–42. [ Wang YY, Zhao J. Clinical significance of combined detection of tumor markers in lung cancer[J]. Shi Yan Yu Jian Yan Yi Xue, 2016, 34(5): 639–42. DOI:10.3969/j.issn.1674-1129.2016.05.034 ] |
| [6] | 张凌. 血清肺癌标志物研究现状及进展[J]. 实用医院临床杂志, 2014, 11(6): 198–200. [ Zhang L. Research status and progress of serum lung cancer marker Clinical[J]. Shi Yong Yi Yuan Lin Chuang Za Zhi, 2014, 11(6): 198–200. DOI:10.3969/j.issn.1672-6170.2014.06.076 ] |
| [7] | Pollab M, Varela G, Torre s A, et a1. Clinical value of p53, c-erbB-2, CEA and CAl25 regarding relapse, metastasis and death in resectable non-small cell lung cancer[J]. Int J Cancer, 2003, 107(5): 78l–90. |
| [8] | Arrieta O, Saaveda-Perez D, Kuri R, et al. Brain metastasis development and poor survival associated with carcinoembryonic antigen (CEA) level in advanced non small cell lung cancer:aprospective analysis[J]. BMC Cancer, 2009, 9: 119. DOI:10.1186/1471-2407-9-119 |
| [9] | 吴琼, 马海洋, 王雪臣, 等. 肺癌患者治疗前血清肿瘤标志物水平与肿瘤骨转移之间的关系分析[J]. 临床肺科杂志, 2018, 23(8): 1487–90. [ Wu Q, Ma HY, Wang XC, et al. Analysis of relationship between serum tumor markers and tumor bone metastasis in patients with lung cancer before treatment[J]. Lin Chuang Fei Ke Za Zhi, 2018, 23(8): 1487–90. DOI:10.3969/j.issn.1009-6663.2018.08.034 ] |
| [10] | 刘俊, 翟允鹏, 孙璀. ECT联合肿瘤标志物检测对肺癌骨转移的诊断意义探析[J]. 中国医药指南, 2017, 15(7): 19. [ Liu J, Zhai YP, Sun C. Diagnostic significance of ECT combined with tumor markers in the diagnosis of Bone Metastasis of Lung Cancer[J]. Zhognguo Yi Yao Zhi Nan, 2017, 15(7): 19. ] |
| [11] | 朱自力, 朱海霞, 张福明, 等. 肺癌患者血清肿瘤标志物水平与骨转移的关系[J]. 江苏医药, 2011, 37(8): 943–5. [ Zhu ZL, Zhu HX, Zhang FM, et al. Relationship between serum tumor markers and bone metastasis in patients with lung cancer[J]. Jiangsu Yi Yao, 2011, 37(8): 943–5. ] |
| [12] | 朱礼. 肺癌骨转移血清肿瘤标志物水平及放疗对血清PINP和β-CTX水平的影响分析[J]. 河北医学, 2017, 23(3): 394–8. [ Zhu L. Analysis of serum tumor markers and effects of radiotherapy on serum PINP and β-CTX levels in patients with bone metastases from lung cancer[J]. Hebei Yi Xue, 2017, 23(3): 394–8. DOI:10.3969/j.issn.1006-6233.2017.03.014 ] |
| [13] | 李磊, 李殿明. 血清碱性磷酸酶和血清钙水平测定对原发性肺癌骨转移的临床诊断价值[J]. 蚌埠医学院学报, 2017, 42(2): 158–61. [ Li L, Li DM. Clinical value of the levels of serum alkaline phosphatase and calcium in diagnosing the bone metastasis of primary lung cancer[J]. Bengbu Yi Xue Yuan Xue Bao, 2017, 42(2): 158–61. ] |
| [14] | 张炜, 郭万华. 99mTc-MDP全身骨扫描和血清CEA、NSE、CYFR21-1、CA125测定对小细胞肺癌骨转移的临床评价[J]. 东南大学学报(医学版), 2015, 34(6): 881–5. [ Zhang W, Guo WH. Clinical evaluation of bone metastasis in small cell lung cancer 99mTc-MDP whole body bone scan and determination of serum CEA、NSE、CYFR21-1、CA125[J]. Dong Nan Da Xue Xue Bao (Yi Xue Ban), 2015, 34(6): 881–5. DOI:10.3969/j.issn.1671-6264.2015.06.005 ] |
 2019, Vol. 46
2019, Vol. 46