文章信息
- 宫颈癌中卵泡抑素样蛋白过表达对下游基因的影响及生物信息学分析
- Effect of Overexpression of Follistatin-like Protein 1 on Downstream Genes in Cervical Cancer and Bioinformatic Analysis of Downstream Genes
- 肿瘤防治研究, 2019, 46(1): 26-31
- Cancer Research on Prevention and Treatment, 2019, 46(1): 26-31
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0665
- 收稿日期: 2018-05-21
- 修回日期: 2018-09-19
2. 530021 南宁,广西壮族自治区人民医院妇科
2. Department of Gynecology, The People's Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China
宫颈癌是危害全世界妇女健康最常见的恶性肿瘤之一,死亡率居女性生殖器官肿瘤第二位[1]。我们前期研究[2]显示卵泡抑素样蛋白(Follistatin-like protein, FSTL1)在宫颈癌组织中低表达,FSTL1能抑制宫颈癌细胞的迁移能力,然而FSTL1在宫颈癌中的调控机制尚不清楚。本研究采用基因芯片技术及生物信息学方法对FSTL1对下游基因及信号通路的影响,探讨FSTL1在宫颈癌发生中的分子机制,为宫颈癌的进一步研究提供理论依据。
1 材料与方法 1.1 细胞及细胞培养宫颈癌细胞HeLa(HPV-18+)购自中科院上海细胞库,用含有10%胎牛血清(Gibco, 澳大利亚)、1%10 000 u/ml青霉素和10 000 μg/ml链霉素(北京索莱宝科技有限公司)的RPMI 1640培养基(Gibco, 苏州赛默飞世尔仪器有限公司)培养,置于37℃、5%CO2培养箱中,细胞呈贴壁生长。
1.2 FSTL1慢病毒感染及稳转株的筛选FSTL1慢病毒及阴性对照慢病毒由上海吉凯基因化学技术有限公司构建和包装。转染前一天铺2 ml密度为(3~5)×104个/毫升的细胞于6孔板中,待第二天细胞融合度达到20%~30%时,按照上海吉凯基因化学技术有限公司的慢病毒使用操作手册说明分别感染FSTL1慢病毒(实验组, Overexpression, OE)和阴性对照(对照组, Negative control, NC),8~12 h后换回正常培养基继续培养。感染72 h后更换含有最佳筛选浓度的嘌呤霉素(1.0 μg/ml)完全培养基培养3天,之后用低浓度的嘌呤霉素(0.8 μg/ml)压力筛选2周后即为FSTL1稳转株。
1.3 RNA提取和RT-qPCR用TRIzol试剂(Invitrogen公司,美国)按说明书提取总RNA,经37℃ 15 min,85℃ 5 s反转录为cDNA(TaKaRa反转录试剂盒,RR047A,日本)。以GAPDH基因作为内参,参照SYBR Green PCR Master Mix试剂盒(FP205)说明书,经95℃预变性15 min,40个循环(95℃ 10 s、60℃ 32 s)进行PCR扩增。结果采用2-ΔΔCt法进行分析FSTL1 mRNA相对表达量。
1.4 芯片检测本实验基因芯片采用人全基因表达谱(Affymetrix GeneChip PrimeViewTM Human Gene Expression Array)芯片,由上海吉凯基因化学技术有限公司按照Affymetrix表达谱芯片检测说明书进行操作,通过RNA质检、纯化、杂交、洗染、扫描及数据分析来筛选出差异表达基因。
1.5 差异基因的筛选及生物学信息分析将样本芯片数据归一化及背景噪音过滤后,根据相同探针的表达差异倍数(Fold change)≥2和显著差异水平进行校正(FDR) < 0.05的筛选标准来筛选差异表达基因。运用DAVID在线分析软件的GO分类富集功能对FSTL1差异表达基因在生物学过程(biological process, BP)、细胞组件(cellular component, CC)和分子功能(molecular function, MF)3个方面进行功能富集分类。运用Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库对FSTL1差异表达基因进行经典信号通路的富集分析,以P < 0.05为界,筛选出具有统计学意义的信号通路。
1.6 差异基因的验证根据基因芯片结果结合文献选取29个差异表达基因进行RT-qPCR验证基因芯片结果。用TRIzol试剂(上海普飞生物技术有限公司)按说明书提取总RNA,经42℃ 1 h,70℃ 10 min反转录为cDNA(Promega反转录试剂盒,M1705)。以GAPDH基因作为内参,按照SYBR Master Mixture试剂盒说明书(TaKaRa, DRR041B),经95℃预变性30 s,40个循环(95℃ 5 s、60℃ 30 s)进行PCR扩增,结果采用2-ΔΔCt法分析各基因mRNA相对表达量。PCR引物由广州市锐博生物科技有限公司设计合成。
1.7 统计学方法所有数据均采用SPSS22.0统计软件进行分析。结果采用t检验,用(x±s)表示,P < 0.05为差异有统计学意义。
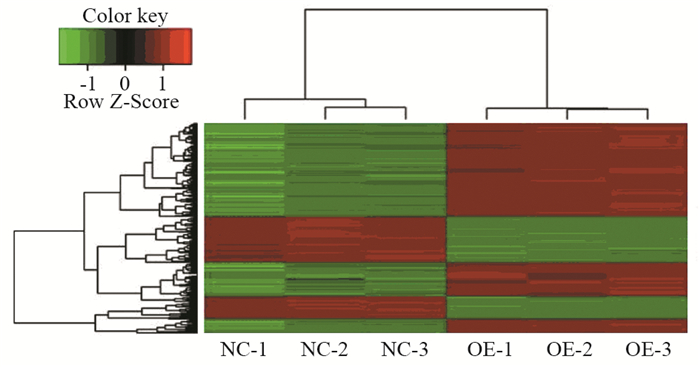
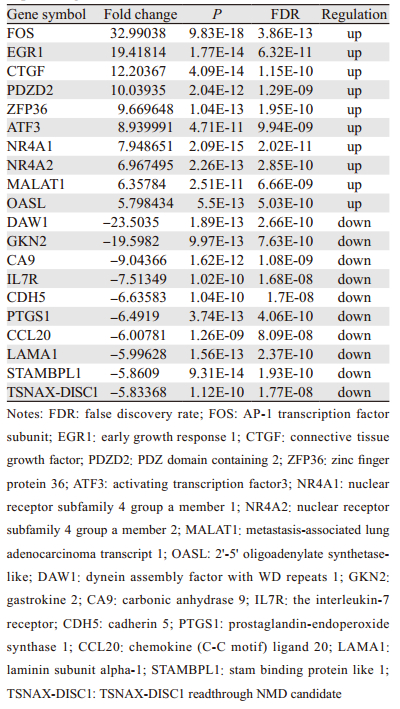
2 结果 2.1 差异基因筛选按照表达差异倍数(Fold change)≥2和显著差异水平进行校正(FDR) < 0.05的筛选条件,对实验组和对照组两组样本的基因进行数据的聚类分析。其中,每一列代表一个样本,每一行代表一个差异基因;红色表示基因的表达程度相对上调,绿色表示基因的表达程度相对下调,黑色表示基因的表达没有显著变化,见图 1。结果显示,与对照组相比,实验组有593个基因表达上调,288个基因表达下调。其中上调最明显的为FOS和EGR1,另外下调最明显的为DAW1和GKN2,见表 1。
|
| NC: negative control; OE: overexpression 图 1 HeLa细胞中上调和下调差异表达基因的聚类分析热图 Figure 1 Heat map of cluster analysis of up- and down-regulated differentially-expressed genes in HeLa cells |
 |
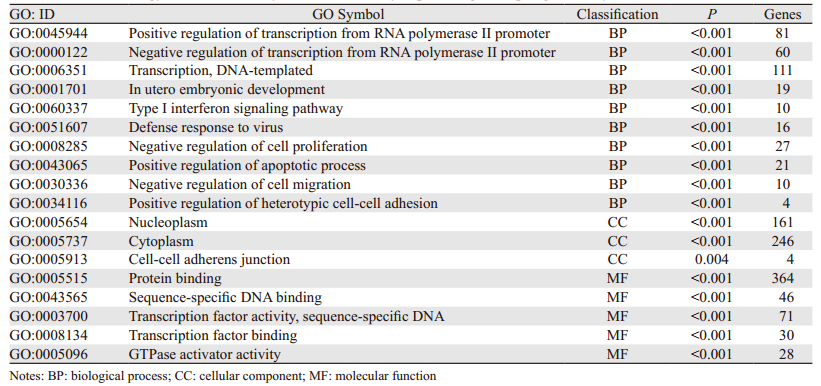
利用DAVID在线分析软件对FSTL1的差异表达基因进行富集分析,结果发现,FSTL1的上调差异表达基因的生物过程主要富集在转录调控、细胞增殖、凋亡、胚胎发育及对病毒的防御上,细胞组分富集于胞核、胞质,细胞间黏附等上,分子功能富集于转录调控、蛋白或核酸的结合等上,见表 2。下调差异表达基因的生物过程主要富集在细胞增殖、凋亡、胰岛素样生长因子的调控以及缺氧应激上,细胞组分富集于胞外、转录因子复合体等上,分子功能富集于胰岛素样生长因子结合、蛋白结合及细胞因子受体结合上,见表 3。
 |
 |
将FSTL1的差异表达基因进行KEGG信号通路富集分析。结果显示,在数据库KEGG中FSTL1的差异表达基因共参与了42项经典信号通路,其中,25条信号通路被激活,如癌症转录误调节信号通路(NFKBIZ、KDM6A、IL6、CEBPB、RXRA等基因)、丝裂源活化的蛋白激酶(MAPK)信号通路、癌症信号通路等;5条信号通路被抑制如癌症转录误调节信号通路(TRAF1、IGF1R、ID2、ARNT2、MET等基因)、P53信号通路、小细胞肺癌信号通路等;另外12条信号通路差异无统计学意义,见表 4。
 |
基于GeneSet等关于疾病和功能的公共数据库,利用IPA在线分析软件对FSTL1差异表达基因进行疾病与功能的富集,结果显示,FSTL1差异表达基因主要参与调节癌症发生、机体的损伤和发育、胃肠道疾病和基因的表达等生物学过程,见图 2。

|
| 图 2 FSTL1的疾病与功能富集显著性富集情况 Figure 2 Disease and functional enrichment analysis of FSTL1 |
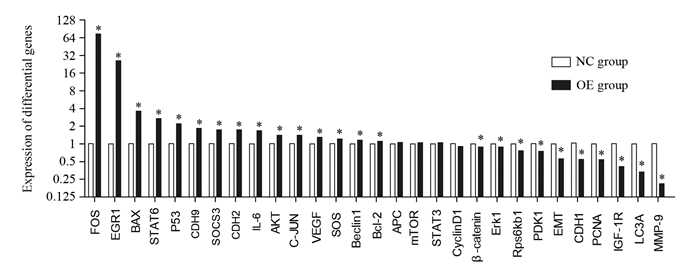
基于芯片数据及文献的结果,我们共选择29个差异表达基因进行RT-qPCR验证。结果显示,29个基因在HeLa细胞中的表达结果均与基因芯片结果趋势一致,18个差异基因表达上调,11个差异基因表达下调,其中4个差异基因无统计学意义。结果表明RT-PCR结果与基因芯片结果趋势一致,见图 3。
|
| *: P < 0.05, compared with NC group 图 3 RT-qPCR验证FSTL1下游差异表达基因情况 Figure 3 RT-qPCR verification of differentially-expressed downstream genes of FSTL1 |
近来研究证实,FSTL1与多种疾病的发生、发展密切相关。FSTL1是一种除外周淋巴细胞以外,几乎所有的哺乳动物细胞均有表达的分泌性糖蛋白,是富含半胱氨酸的分泌性酸性(SPARC)家族蛋白之一,但它的功能和生物学特性与SPARC家族蛋白有所不同[3]。FSTL1在多种肿瘤中异常表达,有研究报道,FSTL1在乳腺癌[4]、肺癌、肾透明细胞癌[5]、鼻咽癌中表达下调,而在食管鳞癌[6]、前列腺癌[7]、肝癌[8]中表达上调。我们的前期研究发现FSTL1在宫颈癌组织中低表达,并与宫颈癌细胞的迁移有关,然而FSTL1在宫颈癌中的作用机制尚不清楚。本研究在宫颈癌HeLa细胞中过表达FSTL1,通过基因芯片技术共筛选出593个下游基因表达上调,288个基因表达下调,其中上调最明显的是FOS和EGR1,下调最明显的是DAW1和GKN2。因此,我们猜测FSTL1可能通过影响对下游差异基因FOS、EGR1、DAW、GKN2等的表达参与宫颈癌的发生发展。
FSTL1在不同的疾病中发挥的作用及机制也不尽相同。研究不仅发现FSTL1可与细胞周期依赖蛋白激酶(cyclinB1)、缺氧诱导因子(HIF)、细胞凋亡蛋白酶(Caspase-9)等多种酶或分子结合,调节肿瘤细胞的增殖、凋亡及周期[9]。研究还发现FSTL1可通过调节多种白介素及免疫细胞,在肿瘤细胞免疫调节中也发挥着重要作用[10]。在肾透明细胞癌中,FSTL1可以通过抑制细胞NF-κB和HIF-2α的表达而较少细胞凋亡[5]。在鼻咽癌中FSTL1可以通过上调NF-κB和下调JNK的表达来增强树突状细胞的抗原识别能力,增强鼻咽癌患者的固有免疫应答能力[10]。然而FSTL1在宫颈癌中发挥的作用仍不清楚,本实验通过基因芯片筛选转染FSTL1后HeLa细胞中的下游基因的表达变化,通过对这些差异基因进行功能富集分析发现,这些差异基因参与的生物过程主要富集在转录调控、细胞增殖、凋亡、胚胎发育、病毒防御以及缺氧应激、胰岛素样生长因子的调控上,细胞组分富集于胞核、胞质,细胞间黏附、胞外、转录因子复合体等上,分子功能富集于转录调控、蛋白或核酸的结合、胰岛素样生长因子结合及细胞因子受体结合等上。结合文献,我们选取部分富集的差异表达基因进行RT-qPCR验证。结果显示,FOS、EGR1、Bax、Bcl-2、P53、Akt等基因表达上调,MMP-9、MET、LC3A等基因表达下调。因此,推测FSTL1可能通过调控这些富集的基因的表达,从而参与宫颈癌细胞的增殖、凋亡、转移等一系列生物学过程。
FSTL1不仅能与蛋白激酶和细胞因子等相互作用,而且还参与多条信号通路调控不同的生物学活动,尤其是在肿瘤细胞的增殖、生长、侵袭和转移等方面发挥着重要调节作用。有研究[11-14]显示,Wnt/β-catenin、PI3K/AKT/NF-κB、MAPK、TGF-β、IGF-1等信号通路参与宫颈癌的发生、发展。这些信号通路与细胞的增殖、恶变、周期和转移相关。研究证实,FSTL1也参与调控NF-κB、MAPK、PI3K/AKT等信号通路[5, 8, 15-16]。本研究对差异表达基因进行KEGG富集分析,结果显示,差异基因共参与42项经典信号通路。其中30条经典信号通路有统计学意义(P < 0.05),30条经典信号通路中25条通路被激活,如癌症转录调节信号通路、MAPK信号通路、癌症信号通路等;5条信号通路被抑制,如癌症转录误调节信号通路、P53信号通路、小细胞肺癌信号通路等。结合文献报道,我们选取以上信号通路中的部分基因进行进行RT-qPCR验证。结果显示,Bax、Bcl-2、P53、Akt、MMP-9、ERK1、FOS、SOS等基因表达异常。因此,我们推测FSTL1在宫颈癌中作用机制可能通过调控PI3K/AKT/Bax/Bcl-2和P53信号通路来参与宫颈癌的发生发展。对这些信号通路的深入研究有助于我们更好的理解宫颈癌的发生机制,为进一步对宫颈癌的研究提供理论依据。
作者贡献
张红:实验操作,数据统计及文稿编修;洛若愚、胡晓霞:项目负责,指导完成研究;陈欢、王琳琳:协助完成实验操作及数据资料分析
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | Liu W, Gao G, Hu X, et al. Activation of miR-9 by human papillomavirus in cervical cancer[J]. Oncotarget, 2014, 5(22): 11620–30. |
| [3] | Hambrock HO, Kaufmann B, Müller S, et al. Structural characterization of TSC-36/Flik: analysis of two charge isoforms[J]. J Biol Chem, 2004, 279(12): 11727–35. DOI:10.1074/jbc.M309318200 |
| [4] | An J, Wang L, Zhao Y, et al. Effects of FSTL1 on cell proliferation in breast cancer cell line MDA-MB-231 and its brain metastatic variant MDA-MB-231-BR[J]. Oncol Rep, 2017, 38(5): 3001–10. DOI:10.3892/or.2017.6004 |
| [5] | Liu Y, Tan X, Liu W, et al. Follistatin-like protein 1 plays a tumor suppressor role in clear-cell renal cell carcinoma[J]. Chin J Cancer, 2018, 37(1): 2. |
| [6] | Lau MC, Ng KY, Wong TL, et al. FSTL1 Promotes Metastasis and Chemoresistance in Esophageal Squamous Cell Carcinoma through NFkappaB-BMP Signaling Cross-talk[J]. Cancer Res, 2017, 77(21): 5886–99. DOI:10.1158/0008-5472.CAN-17-1411 |
| [7] | Su S, Parris AB, Grossman G, et al. Up-Regulation of Follistatin-Like 1 By the Androgen Receptor and Melanoma Antigen-A11 in Prostate Cancer[J]. Prostate, 2017, 77(5): 505–16. DOI:10.1002/pros.v77.5 |
| [8] | Yang W, Wu Y, Wang C, et al. FSTL1 contributes to tumor progression via attenuating apoptosis in a AKT/GSK-3beta -dependent manner in hepatocellular carcinoma[J]. Cancer Biomark, 2017, 20(1): 75–85. DOI:10.3233/CBM-170132 |
| [9] | Bae K, Park KE, Han J, et al. Mitotic cell death caused by follistatin-like 1 inhibition is associated with up-regulated Bim by inactivated Erk1/2 in human lung cancer cells[J]. Oncotarget, 2016, 7(14): 18076–84. |
| [10] | Wang H, Huang S, Wu S, et al. Follistatin-Like Protein-1 Upregulates Dendritic Cell-Based Immunity in Patients with Nasopharyngeal Carcinoma[J]. J Interferon Cytokine Res, 2017, 37(11): 494–502. DOI:10.1089/jir.2017.0064 |
| [11] | Liu XF, Li XY, Zheng PS, et al. DAX1 promotes cervical cancer cell growth and tumorigenicity through activation of Wnt/beta-catenin pathway via GSK3beta[J]. Cell Death Dis, 2018, 9(3): 339. DOI:10.1038/s41419-018-0359-6 |
| [12] | Wang KS, Lv Y, Wang Z, et al. Imperatorin efficiently blocks TNF-alpha-mediated activation of ROS/PI3K/Akt/NF-kappaB pathway[J]. Oncol Rep, 2017, 37(6): 3397–404. DOI:10.3892/or.2017.5581 |
| [13] | Dong W, Sun S, Cao X, et al. Exposure to TNFalpha combined with TGFbeta induces carcinogenesis in vitro via NF-kappaB/Twist axis[J]. Oncol Rep, 2017, 37(3): 1873–82. DOI:10.3892/or.2017.5369 |
| [14] | Shen MR, Hsu YM, Hsu KF, et al. Insulin-like growth factor 1 is a potent stimulator of cervical cancer cell invasiveness and proliferation that is modulated by alphavbeta3 integrin signaling[J]. Carcinogenesis, 2006, 27(5): 962–71. DOI:10.1093/carcin/bgi336 |
| [15] | Shang H, Liu X, Guo H. Knockdown of Fstl1 attenuates hepatic stellate cell activation through the TGFbeta1/Smad3 signaling pathway[J]. Mol Med Rep, 2017, 16(5): 7119–23. DOI:10.3892/mmr.2017.7445 |
| [16] | Liu Y, Wei J, Zhao Y, et al. Follistatin-like protein 1 promotes inflammatory reactions in nucleus pulposus cells by interacting with the MAPK and NFkappaB signaling pathways[J]. Oncotarget, 2017, 8(26): 43023–34. |
 2019, Vol. 46
2019, Vol. 46


