文章信息
- 芒柄花黄素应用于抗癌药物开发的研究进展
- Research Progress of Formononetin for Anticancer Drug Development
- 肿瘤防治研究, 2019, 46(2): 183-187
- Cancer Research on Prevention and Treatment, 2019, 46(2): 183-187
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0643
- 收稿日期: 2018-08-18
- 修回日期: 2018-11-15
恶性肿瘤是威胁人类健康的主要因素之一,临床治疗手段通常包括手术、放疗、化疗、生物治疗或联合治疗等,但效果却差强人意。近年来中国传统中医药的抗癌作用成为海内外学者的关注热点,人们尝试采用天然产物对抗癌细胞,取得了不错的效果。
芒柄花黄素(7-羟基-4’-甲氧基异黄酮,FN)是一种异黄酮类植物雌激素,亦称刺芒柄花素、芒柄花素,是豆科植物红三叶草的主要活性成分,也是当归、黄芪、葛根、鸡血藤等常用中草药的活性成分之一,化学分子式为C16H12O4,可以通过浸提、超声波、微波、超临界、亚临界水、加压法等药物提取纯化方法从天然植物中得到,也可以通过人工方法进行合成和改构。FN在水中溶解性差,易溶于甲醇、乙酸乙酯、乙醚等有机溶剂和稀碱溶液。
诸多研究表明,芒柄花黄素对乳腺、前列腺、膀胱、肺、子宫内膜、卵巢等多种恶性肿瘤显示出良好的抑制作用,因此这种天然产物在癌症防治领域具有重要研究价值。本文就芒柄花黄素应用于抗癌药物开发的最新研究进展进行综述。
1 抗癌药理作用及其机制芒柄花黄素具有抗多种恶性肿瘤增殖、转移的潜能,其抗癌作用可以通过多种药理作用实现。
1.1 抗氧化作用氧自由基(ORF)是机体代谢的副产物,有很强的氧化作用,其中·OH化学性质最活泼。人体内产生的氧自由基如果不能得到及时清除,会对组织和细胞造成不可逆性损伤,与癌症的发生发展密切相关。许多植物提取成分被报道具有抗氧化活性,如多酚、生物碱和黄酮类化合物等。
本课题组在前期研究[1]中发现,芒柄花黄素对体外反应体系的超氧阴离子自由基和羟自由基·OH具有明显的抑制及清除作用。Mu等[2]实验表明,在小鼠体内模型中芒柄花黄素能有效增强抗氧化酶超氧化物歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-Px)和过氧化氢酶(CAT)的活性,同样可以减少氧自由基生成。因此,芒柄花黄素可能通过清除有害的氧自由基、增加机体抗氧化能力在体内外发挥抗癌作用。此外,Zhang等[3]从分子结构和热力学角度揭示了芒柄花黄素发挥抗氧化作用的活性部位为结构式中的B环,见图 1,主要机制为氢原子转移(hydrogen atom transfer, HAT)。

|
| 图 1 芒柄花黄素的化学结构 Figure 1 Chemical structure of formononetin |
恶性肿瘤的生长、迁移均伴有新生血管形成的过程。抑制肿瘤血管生成从而抑制癌细胞的增殖和远处转移,是抗癌药物研发领域的热点。
芒柄花黄素具有抗血管生成潜能,这种作用可能与抑制成纤维细胞生长因子2(FGF2)和血管内皮细胞生长因子(VEGF)的活性有关。FGF2可诱导VEGF的表达,因此抑制FGF2活性也可以间接抑制VEGF。Wu等[4]的实验结果表明,在乳腺癌裸鼠模型中芒柄花黄素作为成纤维细胞生长因子受体2(FGFR2)抑制剂,能够阻断FGFR2介导的PI3K-Akt信号通路,降低肿瘤细胞活性。Auyeung等[5]实验中,芒柄花黄素通过抑制VEGF和基质金属蛋白酶MMPs阻滞癌细胞肿瘤血管生成的作用也得到了验证。作为一种抗癌效应良好的天然产物,芒柄花黄素或许可以用于肿瘤血管阻断疗法中的中西医结合药剂的研发。
1.3 调节基因和蛋白的表达,作用于信号转导通路植物雌激素可以在人体多个代谢途径中发挥作用。已有研究表明,芒柄花黄素可通过调节相关基因和蛋白质的表达,如调控抑癌基因P21、p27,抑制细胞周期调控关键蛋白Cyclin A、Cyclin D1、Cyclin E和PCNA[6-9],激活凋亡相关蛋白Bcl-2家族和Caspase家族[7, 9-14],抑制基质金属蛋白酶[4, 11](基质金属蛋白酶是一类锌依赖性肽链内切酶,能降解细胞外基质中阻碍细胞迁移的多种成分,为癌细胞的转移提供条件)和核糖体S6蛋白激酶[15],直接或间接抑制癌细胞增殖、促进细胞凋亡、抑制肿瘤的迁徙和转移。
此外,一些经典癌症相关信号通路均被证明是芒柄花黄素的作用靶点,研究较多的包括PI3K/Akt信号通路[6, 8, 15-17]、MAPK信号通路[10, 15, 18-20]、IGF-1/IGF-1R信号通路[8, 12]和JAK-STAT信号通路[21]。有研究表明芒柄花黄素可以通过调控乳腺癌细胞中HIF-1α/CXCR4信号转导影响癌细胞的增殖和迁移[22]。此外,芒柄花黄素还可上调膀胱癌T739细胞中“抑瘤因子”GSK-3β、Axin蛋白的表达,降低“促瘤因子”β-catenin蛋白的表达,因此还可能与Wnt-β-catenin信号通路相关[23]。随着越来越多的癌症相关基因、蛋白和通路不断被发现,探究芒柄花黄素的抗癌机制可以进一步明确这种天然植物药对机体代谢的影响,为其在制药领域的开发和利用奠定理论基础。
1.4 调节人体免疫功能、改善机体内环境芒柄花黄素具有对机体损伤的保护作用、降低血清LDL胆固醇、改善骨密度、调节激素分泌等预防保健功效,对人体内环境和稳态起到良性调节,这可能是它发挥抗癌作用的重要机制之一。例如,芒柄花黄素能有效抑制雌激素依赖性子宫内膜癌细胞中FOXA1和GATA-3蛋白的表达而使雌激素受体水平下降,改善体内的内分泌微环境,从而改善患者预后[24]。此外,芒柄花黄素的抗炎作用可以帮助机体清除代谢废物,使机体处于良好的适于正常细胞代谢的环境,增强机体对癌细胞的免疫力。
2 衍生产物和混合药剂的抗癌作用由于难溶于水的理化性质和受到机体代谢作用影响,芒柄花黄素在血液和靶组织中的浓度不高,疗效受限。在Singh等[25]的实验中,FN单体在大鼠体内的生物利用度仅约3%。目前,许多科研人员致力于研究芒柄花黄素改构、改善剂型或药物间的相互作用,取得了诸多成果。
2.1 芒柄花黄素改构基于两个或多个具有药效亚基的生物活性分子,通过化学方法合成溶解性更大、更利于人体吸收的芒柄花黄素衍生物以增强其抗癌效果,是很有前景的研究方向。
氮芥是临床常用的抗肿瘤药物,环磷酰胺等氮芥类化合物发挥作用的药效亚基为其烷基化部分(氮芥基)。Ren等[26]发现在芒柄花黄素3’位引入氮芥(图 2A)可以增强它的细胞毒作用,部分衍生物具有比左旋苯丙氨酸氮芥(米尔法兰)更强的抗肿瘤活性。同时,7位引入环烷基的FN化合物较引入支链烷烃、直链烷烃、苯环类以及烯烃类基团的抗肿瘤活性更强,且抑制作用与环的大小成正比。这说明在芒柄花黄素7位羟基引入体积较大的环烷烃具有更大的价值,或可为基于芒柄花黄素支架开发更有效、更具选择性的抗肿瘤改构药物提供重要线索。
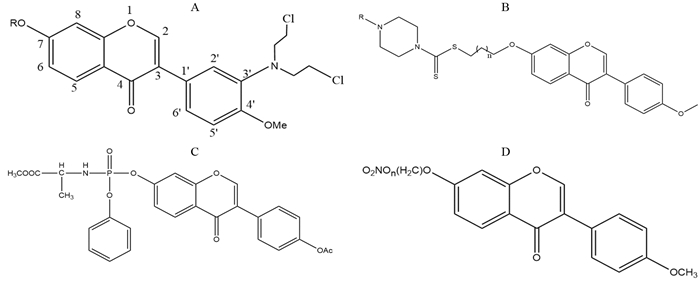
|
| A: Formononetin nitrogen mustard derivatives[26]. R represents the substituent. When R is cyclopentyl, cyclohexyl or cycloheptyl respectively, the anti-tumor activity increased in turn; B: Formononetin-dithiocarbamate hybrids[27]. When n=3, R is t-Butyloxy carbonyl, it has the strongest tumor inhibition effect; C: Formononetin-7-phosphoramidate derivatives[28]; D: Formononetin derivatives with NO releasing function[29], n=4 or n=6. 图 2 芒柄花黄素衍生物 Figure 2 Derivatives of formononetin |
二硫代氨基甲酸盐被报道具有多种药用价值,如抗癌、抑制碳酸酐酶活性等,是连接不同抗增殖分子结构的理想支架。Fu等[27]设计合成的14种芒柄花黄素二硫代氨基甲酸酯衍生物(图 2B)均对前列腺癌PC-3细胞的生长和迁移表现出良好的抑制作用。这两种分子结构具有潜在的协同效应,由它们合成的活性最强的化合物抗前列腺癌PC3细胞的效果比芒柄花黄素单体高约28倍。
前药是一种有效改善原药药代动力学的手段。由于磷酸基团极性较大,引入氨基磷酸酯的前药修饰技术可以增加药物的水溶性。Li等[28]在大豆苷元7位引入氨基磷酸酯合成的芒柄花黄素结构类似物(图 2C)可以引起G2/M期细胞周期阻滞,显著诱导肝癌HepG-2细胞的早期凋亡。而直接由芒柄花黄素合成这一化合物的实验目前未见报道,可以此结果作为参考,纳入FN改构的研究。
李芳耀[29]在芒柄花黄素7位羟基上连接NO供体片段合成了两个衍生物(7-(4-硝基氧基)丁氧基-4'-甲氧基异黄酮和7-(6-硝基氧基)己氧基-4'-甲氧基异黄酮,图 2D),或许可以在体内释放NO,利用NO的抗肿瘤效应增强抗癌活性。该实验的结果仍有待进一步验证。
此外,研究人员还合成了一些未知抗癌活性的水溶性芒柄花黄素衍生物,如芒柄花黄素-3’-磺酸钠[30],Frasinyuk等[31]还合成了一系列芒柄花黄素氨基酸衍生物,在FN改构药物开发方面均具有继续研究价值。
2.2 改善剂型芒柄花黄素属于生物药剂学分类系统中的BCSⅡ类,具有低溶解性和高渗透性的特点。通过先进制药包封工艺制备利于人体摄取的剂型,增加芒柄花黄素在胃肠道中的溶解度和吸收利用度,是值得探讨的问题。提高BCSⅡ类药物的体内溶出和吸收的常用方法包括制备包合物、固体分散体和药物前体,微粉化、改变晶型、自乳化以及纳米技术等。目前文献报道的FN改良制剂包括纳米乳、环糊精和脂质体,在这一领域仍具有广阔的探索前景。
TPGS(D-α-tocopherol polyethylene glycol1000succinate,聚乙二醇1000维生素E琥珀酸酯)是由亲水性基团(聚乙二醇)和亲脂性基团(维生素E琥珀酸酯)组成的载体,当它形成胶束时可以显著改善药物的胃肠道吸收和利用。Cheng等[32]制备了芒柄花黄素TPGS胶束,经测试其稳定性良好,抗肺癌的药用效能明显提高。与游离FN相比,胶束作用后细胞摄药量增加(P < 0.01),细胞毒性增强(药物的半抑制浓度IC50由58.19 µmol/L降低至35.95 µmol/L)。并且,FN-TPGS胶束在小鼠体内能更迅速地聚集于肿瘤位点,显著提升肿瘤抑制率(由34.03%提高到67.39%)。
环糊精包合是一种常用的改善药剂溶解度的方法。药物分子被包含或嵌入环糊精的桶状结构内,形成超微粒分散物,稳定性增加且更易于人体吸收。李德强等[33]和郭波红等[34]制备的芒柄花黄素-β-环糊精包合物,比FN单体水溶性更好,具有一定的缓释作用,若用于临床可以减少患者用药频率,降低FN的不良反应。最近,Liu等[35]和Guo等[36-37]利用羟丙基-β-环糊精(HP-β-CD)分别修饰羧基化单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs),以及制备PLGA纳米粒作为药物载体,得到的芒柄花黄素制剂均具有很好的缓释性能及靶向效应,并且增加了FN单体的抗肿瘤活性。
此外,廖灿城等[38]发现,直接制备FN脂质体包封率低,而且芒柄花黄素容易从药剂中泄漏。因此他们首先对芒柄花黄素进行环糊精包合以改善其成药性,之后制备出的芒柄花黄素-胆固醇(FMN-CHOL)前药较普通脂质体包封率显著增高(由(5.38±1.46)%优化到(81.63±0.79)%)且缓释效果更好。由上述研究可知芒柄花黄素脂质体制剂的生物利用度明显增高,可以推测它具有优于游离芒柄花黄素的药效,但其对癌细胞的抑制效果仍有待进一步验证。
2.3 药剂联合使用的效应研究在癌症化疗阶段加用芒柄花黄素,能够增强某些药物的疗效。如可以在体外条件下几乎完全阻断人脐静脉内皮细胞(HUVEC)的侵袭,增强VEGFR2抑制剂舒尼替尼对癌细胞生长迁移的抑制作用[4]。FN可以降低多药耐药(multidrug resistance, MDR)的发生,显著增强抗肿瘤药表柔比星对宫颈癌HeLa细胞的细胞毒作用[39]和替莫唑胺对胶质瘤C6细胞的化疗疗效[40]。在临床上,应用化疗药物会诱导肿瘤细胞发生上皮-间质转化(epithelial-mesenchymal transition, EMT),增强其恶性程度,与肿瘤耐药性的发生密切相关。Liu等[41]研究表明,FN或许能逆转这种作用,增加阿霉素的抗癌效果。此外,芒柄花黄素还可以减轻化疗不良反应,用于预防顺铂导致的肾脏毒性[42-43]。
3 耐受剂量和毒副作用综合诸多抗癌研究的结果可知,在一定浓度范围内,芒柄花黄素对恶性肿瘤的抑制作用呈剂量-时间依赖性。但在某些实验中较低浓度芒柄花黄素对癌细胞抑制作用不明显,甚至促进癌细胞增殖[44-45]。起效剂量尚难以确定,也无相关研究验证芒柄花黄素对机体产生不良反应的剂量,因此更多的大规模体内外实验有待继续进行。
Zhang等[9]实验结果表明,芒柄花黄素作为抗前列腺癌药物使用对正常人前列腺上皮细胞并不具有可检测的毒性。同样,在动物模型中,在芒柄花黄素治疗的小鼠的心脏、肝脏、脾脏、肺、肾和脑等器官均未观察到明显损伤,药物处理组与对照组小鼠体重不具有显著性差异[4]。在目前的研究中并没有相关数据显示芒柄花黄素对正常组织细胞产生明显的不良反应,表明其在生物体内治疗耐受性良好,可以作为一种理想的抗癌药物。
4 总结与展望芒柄花黄素来源广泛,获取便捷、廉价,具有很好的开发利用前景。诸多研究已表明,FN具有抗多种癌细胞的作用,若制成生物利用度好的药剂形式可以显著改善患者的生存和预后。但是目前芒柄花黄素抗癌的药理作用主要是通过体外细胞实验进行研究,缺乏临床数据的支持。因此在未来进一步的动物体内实验和大规模药物研究应继续进行,以期早日将芒柄花黄素制剂应用于临床预防治疗方案。此外,利用芒柄花黄素类化合物与其他抗癌药物合用发挥协同作用或者研发出活性更强的衍生物,也是很有意义的研究方向。
作者贡献
王茹月:负责起草方案, 修改内容; 叶雨:负责经费支持, 文章选题设计
| [1] | 叶雨, 陈健. 芒柄花黄素对超氧阴离子及羟自由基清除作用的研究[J]. 四川生理科学杂志, 2012, 34(2): 53–5. [ Ye Y, Chen J. Scavenging effects of formononetin on superoxide anion free radical and hydroxy free radical[J]. Sichuan Sheng Li Ke Xue Za Zhi, 2012, 34(2): 53–5. DOI:10.3969/j.issn.1671-3885.2012.02.003 ] |
| [2] | Mu H, Bai YH, Wang ST, et al. Research on antioxidant effects and estrogenic effect of formononetin from Trifolium pratense (red clover)[J]. Phytomedicine, 2009, 16(4): 314–9. DOI:10.1016/j.phymed.2008.07.005 |
| [3] | Zhang JH, Du FP, Peng B, et al. Structure, electronic properties, and radical scavenging mechanisms of daidzein, genistein, formononetin, and biochanin A: A density functional study[J]. J Mol Struc: Theochem, 2010, 955(1-3): 1–6. DOI:10.1016/j.theochem.2010.04.036 |
| [4] | Wu XY, Xu H, Wu ZF, et al. Formononetin, a novel FGFR2 inhibitor, potently inhibits angiogenesis and tumor growth in preclinical models[J]. Oncotarget, 2015, 6(42): 44563–78. |
| [5] | Auyeung KK, Law PC, Ko JK. Novel anti-angiogenic effects of formononetin in human colon cancer cells and tumor xenograft[J]. Oncol Rep, 2012, 28(6): 2188–94. DOI:10.3892/or.2012.2056 |
| [6] | Wang AL, Li Y, Zhao Q, et al. Formononetin inhibits colon carcinoma cell growth and invasion by microRNA149 mediated EphB3 downregulation and inhibition of PI3K/AKT and STAT3 signaling pathways[J]. Mol Med Rep, 2018, 17(6): 7721–9. |
| [7] | Yang Y, Zhao Y, Ai X, et al. Formononetin suppresses the proliferation of human non-small cell lung cancer through induction of cell cycle arrest and apoptosis[J]. Int J Clin Exp Pathol, 2014, 7(12): 8453–61. |
| [8] | Chen J, Zeng J, Xin M, et al. Formononetin induces cell cycle arrest of human breast cancer cells via IGF1/PI3K/Akt pathways in vitro and in vivo[J]. Horm Metab Res, 2011, 43(10): 681–6. DOI:10.1055/s-0031-1286306 |
| [9] | Zhang X, Bi L, Ye Y, et al. Formononetin induces apoptosis in PC-3 prostate cancer cells through enhancing the Bax/Bcl-2 ratios and regulating the p38/Akt pathway[J]. Nutr Cancer, 2014, 66(4): 656–61. DOI:10.1080/01635581.2014.894098 |
| [10] | Ye Y, Hou R, Chen J, et al. Formononetin-induced apoptosis of human prostate cancer cells through ERK1/2 mitogen-activated protein kinase inactivation[J]. Horm Metab Res, 2012, 44(4): 263–7. DOI:10.1055/s-0032-1301922 |
| [11] | Zhang J, Liu L, Wang J, et al. Formononetin, an isoflavone from Astragalus membranaceus inhibits proliferation and metastasis of ovarian cancer cells[J]. J Ethnopharmacol, 2018, 221: 91–9. DOI:10.1016/j.jep.2018.04.014 |
| [12] | Huang WJ, Bi LY, Li ZZ, et al. Formononetin induces the mitochondrial apoptosis pathway in prostate cancer cells via downregulation of the IGF-1/IGF-1R signaling pathway[J]. Pharm Biol, 2014, 52(4): 466–70. DOI:10.3109/13880209.2013.842600 |
| [13] | Liu Y, He J, Chen X, et al. The proapoptotic effect of formononetin in human osteosarcoma cells: involvement of inactivation of ERK and Akt pathways[J]. Cell Physiol Biochem, 2014, 34(3): 637–45. DOI:10.1159/000363029 |
| [14] | Hu W, Xiao Z. Formononetin induces apoptosis of human osteosarcoma cell line U2OS by regulating the expression of Bcl-2, Bax and MiR-375 in vitro and in vivo[J]. Cell Physiol Biochem, 2015, 37(3): 933–9. DOI:10.1159/000430220 |
| [15] | Park S, Bazer FW, Li mW, et al. The O-methylated isoflavone, formononetin, inhibits human ovarian cancer cell proliferation by sub G0/G1 cell phase arrest through PI3K/AKT and ERK1/2 inactivation[J]. J Cell Biochem, 2018, 119(9): 7377–87. DOI:10.1002/jcb.v119.9 |
| [16] | Zhou R, Xu L, Ye M, et al. Formononetin inhibits migration and invasion of MDA-MB-231 and 4T1 breast cancer cells by suppressing MMP-2 and MMP-9 through PI3K/AKT signaling pathways[J]. Horm Metab Res, 2014, 46(11): 753–60. DOI:10.1055/s-00000025 |
| [17] | Jin YM, Xu TM, Zhao YH, et al. In vitro and in vivo anti-cancer activity of formononetin on human cervical cancer cell line HeLa[J]. Tumour Biol, 2014, 35(3): 2279–84. DOI:10.1007/s13277-013-1302-1 |
| [18] | Liu XJ, Li YQ, Chen QY, et al. Up-regulating of RASD1 and apoptosis of DU-145 human prostate cancer cells induced by formononetin in vitro[J]. Asian Pac J Cancer Prev, 2014, 15(6): 2835–9. DOI:10.7314/APJCP.2014.15.6.2835 |
| [19] | Chen J, Sun L. Formononetin-induced apoptosis by activation of Ras/p38 mitogen-activated protein kinase in estrogen receptor-positive human breast cancer cells[J]. Horm Metab Res, 2012, 44(13): 943–8. DOI:10.1055/s-00000025 |
| [20] | Wu Y, Zhang X, Li Z, et al. Formononetin inhibits human bladder cancer cell proliferation and invasiveness via regulation of miR-21 and PTEN[J]. Food Funct, 2017, 8(3): 1061–6. DOI:10.1039/C6FO01535B |
| [21] | Kim C, Lee SG, Yang WM, et al. Formononetin-induced oxidative stress abrogates the activation of STAT3/5 signaling axis and suppresses the tumor growth in multiple myeloma preclinical model[J]. Cancer Lett, 2018, 431: 123–41. DOI:10.1016/j.canlet.2018.05.038 |
| [22] | 葛新, 李林, 王芳, 等. 芒柄花素抑制乳腺癌细胞HIF-1α/CXCR4信号以及细胞增殖和迁移[J]. 河南医学研究, 2016, 25(9): 1542–5. [ Ge X, Li L, Wang F, et al. Formononetin regresses HIF-1α/CXCR4 signaling and cell proliferation and migration in breast cancer cells[J]. He'nan Yi Xue Yan Jiu, 2016, 25(9): 1542–5. DOI:10.3969/j.issn.1004-437X.2016.09.003 ] |
| [23] | 柳青, 梁梅花, 张幸, 等. 芒柄花黄素对人膀胱癌细胞T739增殖、凋亡的影响及机制探讨[J]. 中国医药导报, 2017, 14(25): 4–7. [ Liu Q, Liang MH, Zhang X, et al. Effects of formononetin on proliferation and apoptosis of human bladder cancer cells T739 and its mechanism[J]. Zhongguo Yi Yao Dao Bao, 2017, 14(25): 4–7. ] |
| [24] | 顾万, 邹穗怡. 芒柄花黄素对HEC-1A荷瘤裸鼠的抗肿瘤作用[J]. 广东医学, 2014, 35(8): 1167–70. [ Gu W, Zou SY. Anti-Tumor Effect of formononetin on HEC-1A Tumor-Bearing Nude Mice[J]. Guangdong Yi Xue, 2014, 35(8): 1167–70. ] |
| [25] | Singh SP, Wahajuddin, Tewari D, et al. PAMPA permeability, plasma protein binding, blood partition, pharmacokinetics and metabolism of formononetin, a methoxylated isoflavone[J]. Food Chem Toxicol, 2011, 49(5): 1056–62. DOI:10.1016/j.fct.2011.01.012 |
| [26] | Ren J, Xu HJ, Cheng H, et al. Synthesis and antitumor activity of formononetin nitrogen mustard derivatives[J]. Eur J Med Chem, 2012, 54: 175–87. DOI:10.1016/j.ejmech.2012.04.039 |
| [27] | Fu DJ, Zhang L, Song J, et al. Design and synthesis of formononetin-dithiocarbamate hybrids that inhibit growth and migration of PC-3 cells via MAPK/Wnt signaling pathways[J]. Eur J Med Chem, 2017, 127: 87–99. DOI:10.1016/j.ejmech.2016.12.027 |
| [28] | Li YQ, Yang F, Wang L, et al. Phosphoramidate protides of five flavones and their antiproliferative activity against HepG2 and L-O2 cell lines[J]. Eur J Med Chem, 2016, 112: 196–208. DOI:10.1016/j.ejmech.2016.02.012 |
| [29] | 李芳耀, 杨新平, 黄兰, 等. 具有NO释放作用的芒柄花素衍生物的合成与表征[J]. 化学试剂, 2011, 33(10): 958–60. [ Li FY, Yang XP, Huang L, et al. Synthesis and characterization of formononetin derivatives with NO releasing function[J]. Hua Xue Shi Ji, 2011, 33(10): 958–60. DOI:10.3969/j.issn.0258-3283.2011.10.028 ] |
| [30] | 王秋亚, 孟庆华, 张尊听, 等. 芒柄花素磺化物的合成、溶解性能及降脂保肝活性[J]. 药学学报, 2009, 44(4): 386–9. [ Wang QY, Meng QH, Zhang ZT, et al. Synthesis, solubility, lipids-lowering and liver-protection activities of sulfonated formononetin[J]. Yao Xue Xue Bao, 2009, 44(4): 386–9. DOI:10.3321/j.issn:0513-4870.2009.04.011 ] |
| [31] | Frasinyuk MS, mrug GP, Fedoryak OD, et al. Synthesis of amino-acid derivatives of formononetin and cladrin[J]. Chemistry of Natural Compounds, 2012, 48(4): 570–3. DOI:10.1007/s10600-012-0313-2 |
| [32] | Cheng XD, Yan HM, Jia XB, et al. Preparation and in vivo/in vitro evaluation of formononetin phospholipid/vitamin E TPGS micelles[J]. J Drug Target, 2016, 24(2): 161–8. DOI:10.3109/1061186X.2015.1064435 |
| [33] | 李德强, 雷英杰, 丁玫. 芒柄花素-β-环糊精包合物的制备工艺[J]. 天津理工大学学报, 2010, 26(3): 35–7. [ Li DQ, Lei YJ, Ding M. Preparation of formononetin-β-cyclodextrin inclusion complex[J]. Tianjin Li Gong Da Xue Xue Bao, 2010, 26(3): 35–7. DOI:10.3969/j.issn.1673-095X.2010.03.011 ] |
| [34] | 郭波红, 廖灿城, 吴秀君, 等. 芒柄花素2-羟丙基-β-环糊精包合物的制备及其包合行为探讨[J]. 中草药, 2017, 48(14): 2877–82. [ Guo BH, Liao CC, Wu XJ, et al. Preparation of formononetin-2-hydroxypropyl-β-cyclodextrin inclusion complex and study of its inclusion behavior[J]. Zhong Cao Yao, 2017, 48(14): 2877–82. ] |
| [35] | Liu XD, Xu DQ, Liao CC, et al. Development of a promising drug delivery for formononetin: Cyclodextrin-modified single-walled carbon nanotubes[J]. J Drug Deliv Sci Tec, 2017, 43: 461–8. |
| [36] | Guo BH, Xu DQ, Liu XH, et al. Characterization and cytotoxicity of PLGA nanoparticles loaded with formononetin cyclodextrin complex[J]. J Drug Deliv Sci Tec, 2017, 41: 375–83. DOI:10.1016/j.jddst.2017.08.010 |
| [37] | Guo B, Liao C, Liu X, et al. Preliminary study on conjugation of formononetin with multiwalled carbon nanotubes for inducing apoptosis via ROS production in HeLa cells[J]. Drug Des Devel Ther, 2018, 12: 2815–26. DOI:10.2147/DDDT |
| [38] | 廖灿城, 郭波红, 许丹翘, 等. 芒柄花素包合物脂质体的制备及质量评价[J]. 中国药房, 2018, 29(3): 303–6. [ Liao CC, Guo BH, Xu DQ, et al. Preparation and Quality Evaluation of Formononetin Inclusion Compound Liposome[J]. Zhongguo Yao Fang, 2018, 29(3): 303–6. ] |
| [39] | Lo YL, Wang W. Formononetin potentiates epirubicin-induced apoptosis via ROS production in HeLa cells in vitro[J]. Chem Biol Interact, 2013, 205(3): 188–97. DOI:10.1016/j.cbi.2013.07.003 |
| [40] | Zhang X, Ni Q, Wang Y, et al. Synergistic Anticancer Effects of Formononetin and Temozolomide on Glioma C6 Cells[J]. Biol Pharm Bull, 2018, 41(8): 1194–202. DOI:10.1248/bpb.b18-00002 |
| [41] | Liu Q, Sun Y, Zheng JM, et al. Formononetin sensitizes glioma cells to doxorubicin through preventing EMT via inhibition of histone deacetylase 5[J]. Int J Clin Exp Pathol, 2015, 8(6): 6434–41. |
| [42] | Huang D, Wang C, Duan Y, et al. Targeting Oct2 and P53: Formononetin prevents cisplatin-induced acute kidney injury[J]. Toxicol Appl Pharmacol, 2017, 326: 15–24. DOI:10.1016/j.taap.2017.04.013 |
| [43] | Lee H, Lee D, Kang KS, et al. Inhibition of Intracellular ROS Accumulation by Formononetin Attenuates Cisplatin-Mediated Apoptosis in LLC-PK1 Cells[J]. Int J Mol Sci, 2018, 19(3): pii:E813. DOI:10.3390/ijms19030813 |
| [44] | Guo YH, Wang Y, Xin M. Low concentration of formononetin stimulates the proliferation of nasopharyngeal carcinoma cell line CNE2 by upregulating bcl-2 and p-ERK1/2 expression[J]. Pharm Biol, 2016, 54(9): 1841–6. DOI:10.3109/13880209.2015.1129546 |
| [45] | Chen J, Zhang X, Wang Y, et al. Formononetin promotes proliferation that involves a feedback loop of microRNA-375 and estrogen receptor alpha in estrogen receptor-positive cells[J]. Mol Carcinog, 2016, 55(3): 312–9. DOI:10.1002/mc.22282 |
 2019, Vol. 46
2019, Vol. 46


