文章信息
- 三种方案治疗Ⅰb2、Ⅱa2期宫颈癌患者生存状况及术后并发症的比较
- Comparison of Survival and Postoperative Complication of Stage Ⅰb2-Ⅱa2 Cervical Cancer Patients Among Three Kinds of Therapeutic Regimens
- 肿瘤防治研究, 2019, 46(9): 825-828
- Cancer Research on Prevention and Treatment, 2019, 46(9): 825-828
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0605
- 收稿日期: 2018-11-19
- 修回日期: 2019-05-05
对于Ⅰb2、Ⅱa2期宫颈癌患者,欧美临床诊疗指南推荐行盆腔外+近距离放疗同步含铂化疗方案治疗[1],但国内受放疗仪器普及率和治疗费用等因素影响,手术切除治疗仍是该类患者临床治疗首选。单纯根治手术切除用于Ⅰb2、Ⅱa2期宫颈癌治疗可在消除病灶同时有效降低卵巢功能损伤,避免新辅助治疗后并发症发生,但较大体积病灶切除过程中因手术操作空间不足,极易对周围脏器造成损伤,严重影响术后康复进程[2]。有回顾性研究显示,对于肿瘤体积较大宫颈癌患者行新辅助化疗后总体疾病控制率(disease control rate, DCR)不足55%,且远期生存时间方面未见明显获益[3]。近年来国外学者报道,术前同步近距离放疗+化疗治疗早中期宫颈癌可延长生存时间,降低远期复发转移风险[4],但国内在此方面研究仍较为缺乏,且研究结论间存在较大差异。本文回顾性分析140例Ⅰb2、Ⅱa2期宫颈癌患者临床资料,探讨单纯根治手术、新辅助化疗联合根治手术及同步放化疗联合根治手术方案对Ⅰb2、Ⅱa2期宫颈癌患者生存时间及术后并发症的影响。
1 资料与方法 1.1 临床资料回顾性分析南阳市第二人民医院2012年4月—2014年10月收治的140例Ⅰb2、Ⅱa2期宫颈癌患者临床资料,分三组:单纯根治手术(A)组48例,平均年龄为(55.61±6.40)岁,其中鳞癌35例、腺癌13例,根据FIGO分期标准,Ⅰb2期21例、Ⅱa2期27例;新辅助化疗联合根治手术(B)组59例,平均年龄为(56.28±6.60)岁,其中鳞癌43例、腺癌16例,根据FIGO分期标准,Ⅰb2期27例、Ⅱa2期32例;同步放化疗联合根治手术(C)组33例,平均年龄为(55.09±6.14)岁,其中鳞癌24例、腺癌9例,根据FIGO分期标准,Ⅰb2期14例、Ⅱa2期19例。
1.1.1 纳入标准(1)经宫颈液基细胞学及活检病理诊断为宫颈癌;(2)符合FIGO分期标准划分的Ⅰb2、Ⅱa2期[5];(3)可实现宫颈肿物测距;(4)年龄18~80岁;(5)方案经本院伦理委员会批准,且患者及家属签署知情同意书。
1.1.2 排除标准(1)有手术和放化疗禁忌证;(2)既往有放化疗史;(3)全身严重感染者;(4)有免疫系统疾病者;(5)其他类型恶性肿瘤;(6)重要脏器功能障碍者;(7)有精神系统疾病;(8)有凝血功能障碍。
1.2 治疗方法A组:给予单纯根治手术治疗,即行广泛全子宫、附件切除及同期盆腔及腹主动脉旁淋巴结清扫,如患者年龄45岁以下,可征询意愿后实施卵巢移位术;B组:给予新辅助化疗联合根治手术治疗,其中新辅助化疗方案为顺铂30 mg/m2+紫杉醇脂质体55 mg/m2,每周1次静脉滴注,连用5周;结束后1周对身体机能状态评价,符合条件者实施宫颈癌根治术(广泛全子宫、附件切除及同期盆腔及腹主动脉旁淋巴结清扫);C组:给予同步放化疗联合根治手术治疗,其中同步放化疗方案包括近距离后装放疗(192Ir,A点剂量每次16 Gy,每周4次,连用2周)+同期化疗(顺铂30 mg/m2+紫杉醇脂质体55 mg/m2,每周1次,连用2周);同步放化疗后1周对身体机能状态评价,符合条件者实施宫颈癌根治术(广泛全子宫、附件切除及同期盆腔及腹主动脉旁淋巴结清扫)。
1.3 观察指标(1)术中、术后临床指标:手术用时、手术出血量及总住院时间;(2)根据术后病理结果进行脉管、神经和深肌层侵犯及淋巴结转移判定;(3)术后并发症:输尿管损伤、阴道残端感染、淋巴水肿、输尿管阴道瘘及尿潴留;(4)生存情况:中位总生存时间和术后随访生存率(1、2及3年)。
1.4 统计学方法采用SPSS20.0软件进行数据分析,其中计量资料采用方差分析,以均数±标准差表示,计数资料采用χ2检验,以百分比(%)表示;生存分析采用Kaplan-Meier法和Log rank检验;检验水准为α=0.05。
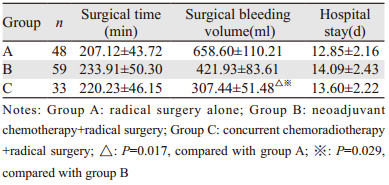
2 结果 2.1 三组患者术中、术后临床指标水平比较三组患者一般资料比较差异无统计学意义(P > 0.05),三组患者手术用时(P=0.147)和总住院时间(P=0.228)比较差异无统计学意义,C组患者手术出血量显著少于A(P=0.017)、B组(P=0.029),见表 1。
|
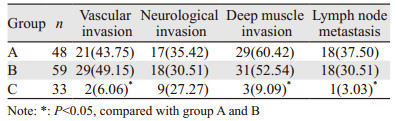
C组患者术后脉管(P=0.011, 0.022)和深肌层侵犯率(P=0.027, 0.018)及淋巴结转移率(P=0.032, 0.031)均显著低于A、B组;三组患者术后神经侵犯率比较差异无统计学意义(P=0.673),见表 2。
|
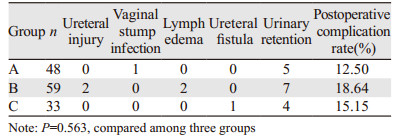
三组患者术后并发症发生率比较差异无统计学意义(P=0.563),见表 3。
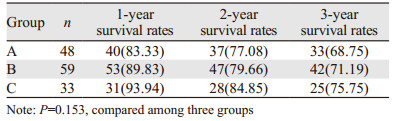
A、B及C组中位总生存时间分别为35.6月(95%CI: 26.1~39.4)、34.9月(95%CI: 25.7~38.9)和36.8月(95%CI: 26.1~39.8)。三组患者中位总生存时间比较差异均无统计学意义(P=0.227);同时三组患者术后1、2及3年生存率比较差异均无统计学意义(P=0.153),见表 4。
|
B组按术前治疗方式进一步分为放疗组(28例)、化疗组(13例)和放化疗组(18例),结果显示放疗组3年生存率明显高于化疗组与放化疗组(P=0.027, 0.035),见表 5。
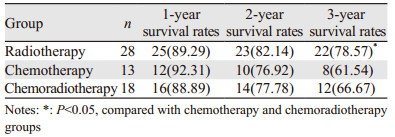
|
单纯宫颈癌根治术治疗Ⅰb2、Ⅱa2期宫颈癌较术前新辅助化疗应用在改善术后卵巢和阴道功能方面优势明显,但部分患者因肿瘤体积较大,术中极易发生毗邻脏器医源性损伤,同时术中操作视野受限还可能导致切缘阳性和局部浸润复发风险上升[6]。以往临床研究表明,术前新辅助化疗可有效提高宫颈癌患者pCR率,降低术后并发症发生风险,但在生存时间改善方面证据并不充分;同时为提高疗效,部分患者增加化疗药物用量还可能引起多种严重不良反应,严重影响手术顺利完成和术后康复进程[7]。近年来大剂量放疗在延长早中期宫颈癌患者生存时间方面优势已获得广泛认可,但包括会阴水肿、放射性直肠或膀胱炎在内多种并发症往往导致远期生活质量明显下降,而序贯给予化疗药物应用是否能增加患者生存受益亦存在争议,且可能导致卵巢和阴道功能丧失[8]。国外多中心回顾性研究显示,术前同步放化疗方案应用有助于降低宫颈癌特别是病灶体积较大者肿瘤负荷,改善病情控制效果及控制局部复发转移,同时术后患者中仅20%~30%出现卵巢和阴道功能丧失,在提高治疗依从性和耐受性方面更具优势[9]。
近距离后装放疗与常规放疗方案比较具有定位准确,灵活调整剂量及照射时间缩短等优势;同时随着经阴道影像学技术不断发展进步,临床医师根据术前详尽肿瘤体积和测距信息可进一步提高A点剂量一致性。此外三维适形技术应用还有助于改善肿瘤靶区勾画准确程度,提高放疗剂量集中程度,减轻周围组织和器官放疗损伤[10]。国外学者报道显示,早中期宫颈癌患者行近距离后装放疗随访3年生存率超过75%[11]。
本研究结果显示,同步放化疗联合根治手术组患者手术出血量显著少于单纯根治手术和新辅助化疗联合根治手术组(P < 0.05),证实同步放化疗联合根治手术方案治疗Ⅰb2、Ⅱa2期宫颈癌在减少手术出血量和降低手术创伤程度方面具有优势;以往报道结果显示,术前放疗可增加肿瘤组织脆性,切除过程中出血更难控制,并进一步导致术野清晰度下降[12]。我们认为行同步放化疗后可更有效地降低肿瘤负荷和减少局部血流灌注量可能是其在降低手术出血量方面具有优势的关键机制所在。本研究中三种方案在手术操作难度和术后康复用时方面较为接近,其中有学者认为术前新辅助化疗或同步放化疗均可有效降低肿瘤负担和术中病变切除难度,进而缩短操作用时[13]。
本研究结果提示Ⅰb2、Ⅱa2期宫颈癌患者行同步放化疗联合根治手术方案有助于降低肿瘤侵犯和淋巴结转移风险,与Hansen等[10]文献结果一致。同步放化疗中化疗药物静脉滴注能有效抑杀血清及病灶区域肿瘤细胞,而与放疗联合应用则能够协同增强增殖周期和乏氧肿瘤细胞抑杀效果,这是造成患者局部复发和淋巴结转移风险下降关键原因[14],但三组患者术后神经侵犯率比较差异无统计学意义(P > 0.05),这一现象可能与入选患者例数较少所致偏倚有关。部分学者报道支持术前同步放化疗方案应用可延长早期宫颈癌患者生存时间这一论断[15],但本次研究结果中,三组患者中位总生存时间和术后随访生存率比较差异均无统计学意义(P > 0.05),这可能是因为患者年龄 > 50岁,且随访时间较短造成了这一现象。
本研究中,三组患者术后并发症发生率比较差异无统计学意义(P > 0.05),显示同步放化疗联合根治手术方案用于Ⅰb2、Ⅱa2期宫颈癌治疗相较于其他两种方案并未增加术后并发症发生率。传统观点认为术前新辅助化疗能够降低宫颈癌术后并发症发生率[16],而对基线资料进行分析后显示FIGO分期和化疗剂量可能是影响术后并发症发生率的关键原因。同时,C组患者术前放疗剂量每次仅为16 Gy,并未诱发严重放疗并发症发生,安全性值得认可。另亚组分析结果证实Ⅰb2、Ⅱa2期宫颈癌患者术前行新辅助放疗更有助改善总体生存获益,但亚组样本量相对较小,可作为后续探索的方向。
综上所述,三组方案治疗Ⅰb2、Ⅱa2期宫颈癌具有相近生存时间和术后并发症风险,但同步放化疗联合根治手术方案应用有助于减轻手术创伤,降低术后局部侵犯和淋巴结转移率。但鉴于纳入样本量不足、随访时间短、单一中心及非随机对照研究等制约,所得结论仍有待更大规模随机对照研究确证。
作者贡献
蒋洪青:文章构思、设计及可行性分析,文献、资料收集与整理,论文撰写
刘平:文章修订
刘志惠:文章质量控制及审校,对文章整体负责,监督管理
| [1] | He L, Wu L, Su G, et al. The efficacy of neoadjuvant chemotherapy in different histological types of cervical cancer[J]. Gynecol Oncol, 2014, 134(2): 419–425. DOI:10.1016/j.ygyno.2014.06.001 |
| [2] | Aggarwal U, Goyal AK, Rath G. Development and characterization of the cisplatin loaded nanofibers for the treatment of cervical cancer[J]. Mater Sci Eng C Mater Biol Appl, 2017, 75(4): 125–132. |
| [3] | Haie-Meder C, Morice P, Castiglione M, et al. Cervical cancer: ESMO clinical recommendations for diagnosis, treatment and follow-up[J]. Ann Oncol, 2017, 20(Suppl 4): 27–28. |
| [4] | Landoni F, Colombo A, Milani R, et al. Randomized study between radical surgery and radiotherapy for the treatment of stage ⅠB-ⅡA cervical cancer: 20-year update[J]. J Gynecol Oncol, 2017, 28(3): e34. DOI:10.3802/jgo.2017.28.e34 |
| [5] | 陈惠祯, 蔡红兵. 现代妇科肿瘤学[M]. 武汉: 科学技术出版社, 2006: 206-207. [ Chen HZ, Cai HB. Modern gynecological oncology[M]. Wuhan: Science and Technology Press, 2006: 206-207. ] |
| [6] | Mazeron R, Kamsu Kom L, Rivin del Campo E, et al. Comparison between the ICRU rectal point and modern volumetric parameters in brachytherapy for locally advanced cervical cancer[J]. Cancer Radiother, 2014, 18(3): 177–182. DOI:10.1016/j.canrad.2014.03.002 |
| [7] | Benito V, Carballo S, Silva P, et al. Should the Presence of Metastatic Para-Aortic Lymph Nodes in Locally Advanced Cervical Cancer Lead to More Aggressive Treatment Strategies?[J]. J Minim Invasive Gynecol, 2017, 24(4): 609–616. DOI:10.1016/j.jmig.2017.01.016 |
| [8] | Sabour S. Prediction of rehabilitation needs after treatment of cervical cancer: a methodological mistake[J]. Support Care Cancer, 2017, 25(7): 2041. DOI:10.1007/s00520-017-3711-y |
| [9] | Wei LC, Wang N, Shi M, et al. Clinical outcome observation of preoperative concurrent chemoradiotherapy/radiotherapy alone in 174 Chinese patients with local advanced cervical carcinoma[J]. Oncol Targets Ther, 2013, 6: 67–74. |
| [10] | Hansen H, Hogdall C, Engelholm S. Radiation therapy without cisplatin for elderly cervical cancer patients[J]. Int J Radiat Oncol Biol Phys, 2014, 90(1Suppl): S484–S485. |
| [11] | Jia MX, Zhang X, Yin C, et al. Peripheral dose measurements in cervical cancer radiotherapy: a comparison of volumetric modulated arc therapy and step-and-shoot IMRT techniques[J]. Radiat Oncol, 2014, 9: 61. DOI:10.1186/1748-717X-9-61 |
| [12] | Zhang G, He F, Fu C, et al. Definitive extended field intensity-modulated radiotherapy and concurrent cisplatin chemosensitization in the treatment of ⅠB2-ⅢB cervical cancer[J]. J Gynecol Oncol, 2014, 25(1): 14–21. DOI:10.3802/jgo.2014.25.1.14 |
| [13] | Fu ZZ, Li K, Peng Y, et al. Efficacy and toxicity of different concurrent chemoradiotherapy regimens in the treatment of advanced cervical cancer: A network meta-analysis[J]. Medicine(Baltimore), 2017, 96(2): e5853. |
| [14] | Zhang Q, Li W, Kanis MJ, et al. Oncologic and obstetrical outcomes with fertility-sparing treatment of cervical cancer: a systematic review and meta-analysis[J]. Oncotarget, 2017, 8(28): 46580–46592. |
| [15] | Fu JH, Gao Z, Ren CC, et al. Comparison of Clinical Efficacy of Three Different Neoadjuvant Approaches (Chemotherapy Combined Vaginal Intracavitary Irradiation, Neoadjuvant Chemotherapy Alone or Radiotherapy) Combined with Surgery for Patients with StageⅠb2 and Ⅱa2 Cervical Cancer[J]. Asian Pac J Cancer Prev, 2013, 14(4): 2377–2381. DOI:10.7314/APJCP.2013.14.4.2377 |
| [16] | Vizza E, Corrado G, Zanagnolo V, et al. Neoadjuvant chemotherapy followed by robotic radical hysterectomy in locally advanced cervical cancer: a multi-institution study[J]. Gynecol Oncol, 2014, 133(2): 180–185. DOI:10.1016/j.ygyno.2014.02.035 |
 2019, Vol. 46
2019, Vol. 46