文章信息
- 外周血中性粒细胞及血小板与淋巴细胞的比值与局部晚期鼻咽癌预后及疗效的相关性
- Relationship of Peripheral Blood Neutrophil/Lymphocyte Ratio and Platelet/Lymphocyte Ratio with Curative Effect and Prognosis of Patients with Locally Advanced Nasopharyngeal Carcinoma
- 肿瘤防治研究, 2019, 46(1): 32-36
- Cancer Research on Prevention and Treatment, 2019, 46(1): 32-36
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0578
- 收稿日期: 2018-05-02
- 修回日期: 2018-08-23
近年来,中性粒细胞与淋巴细胞的比值(NLR)和血小板与淋巴细胞的比值(PLR)作为炎性因子的重要代表之一,被证实与多种肿瘤的预后相关。NLR被证实为肾癌、胰腺癌、食管癌、胃癌等多种肿瘤的独立预后因素之一[1-4],PLR在胃癌、肝癌等恶性肿瘤预后中也具有重要价值[5-6]。
尽管目前对于NLR及PLR可预测鼻咽癌患者预后已初步被报道[7-9],但缺乏针对局部晚期鼻咽癌的报道,且治疗方案不统一,故NLR及PLR是否可预测局部晚期鼻咽癌患者预后存在一定争议。因此,我们分析了一项随机前瞻性临床试验的数据,探讨NLR与PLR对局部晚期鼻咽癌患者治疗疗效的临床预测价值,并探讨NLR及PLR在指导局部晚期鼻咽癌患者选择时辰化疗时是否有临床指导意义。
1 资料与方法 1.1 选择标准(1)经病理确诊的初治Ⅲ~Ⅳa/b期鼻咽癌患者(根据2010年UICC分期标准[10]),均有可测量的肿瘤病灶;(2)KPS≥70;(3)年龄18~70岁,性别不限;(4)无主要器官的功能障碍,骨髓造血功能、肝、肾功能正常;(5)无急性损伤、急性炎性反应、血液系统疾病、免疫系统疾病;(6)患者无体格或精神疾病,并经研究者认为患者可完全或充分理解本研究可能存在的并发症;(7)无妊娠或者泌乳期间。
1.2 临床资料收集2015年7月至2016年12月一项来自贵州省肿瘤医院头颈肿瘤科随机前瞻性临床试验(临床试验注册号:ChiCTRNCT02937519)的病理诊断明确的局部晚期(2010年UICC分期为Ⅲ期或Ⅳa/b期)鼻咽癌患者的临床信息。108例患者随机分为常规组55例及时辰组53例;其中男78例、女30例;中位年龄47岁(18~68岁);Ⅲ期21例、Ⅳa/b期87例,T1+T2期共7例、T3+T4期101例,N0+N1期32例、N2+N3期76例。常规组:男43例,女12例;中位年龄45(18~68)岁;Ⅲ期10例,Ⅳ期45例;中位NLR值3.02(1.07~5.53);中位PLR值182.43(67.86~328.77)。时辰组:男35例、女18例;中位年龄(19~65岁);Ⅲ期11例、Ⅳ期42例;中位NLR值2.28(1.01~8.17);中位PLR值137.60(50.43~454.43)。
1.3 治疗方法(1)放疗方法:两组均采用适型调强放疗(intensity modulated radiation therapy, IMRT),6MV-X放射源,剂量:GTVnx 69.96~73.92 Gy/33 f,PTVnx 69.96 Gy/33 f,PGTVnd 69.96 Gy/33 f,PTV1 60.06 Gy/33 f,PTV2 50.96 Gy/28 f,7~8周完成。(2)化疗方法:诱导化疗采用TPF方案,21天/周期,共2周期。常规组:多西他赛75 mg/m2,静脉滴注,d1;顺铂75 mg/m2,静脉滴注,d1天;氟尿嘧啶750 mg/(m2·d),d1~d5持续静脉泵入(120 h)。时辰组:用药剂量同常规组。多西他赛:凌晨03:30~04:30,d1,静脉滴注;顺铂10:00~22:00,d1~5,静脉泵入;氟尿嘧啶22:00~10:00静脉泵入。以上同步放化疗采用单药顺铂化疗2周期,21天/周期。常规组:顺铂100 mg/m2,d1、d22,静脉滴注。时辰组:顺铂100 mg/m2,第1天及第22天10:00~22:00静脉泵入。N3期及放疗后3月复查总体疗效未达CR的患者行2周期辅助化疗,方案同诱导化疗。
1.4 近期疗效评价及随访按1.1版实体瘤治疗疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)[11]于放疗结束即刻及放疗结束后3月进行评价疗效。
1.5 NLR、PLR的定义及分组统计患者治疗前1周内血常规中性粒细胞、淋巴细胞及血小板的绝对值,NLR定义为中性粒细胞绝对值/淋巴细胞绝对值,PLR定义为血小板绝对值/淋巴细胞绝对值。计算出全组NLR及PLR值,按从小到大的顺序排列NLR及PLR,分别取第54及第55位NLR及PLR值,取其平均值即NLR及PLR中位值。以患者治疗前NLR及PLR的中位数作为患者NLR及PLR的截断值再分组。≤截断值者为低组,>截断值者为高组。
1.6 统计学方法符合入组标准的患者将会按1:1的配置比例随机分配到组1和组2。随机的区组大小由统计设计人员确定,且每个区组内包含的组1和组2的患者人数相等。通过计算机随机组1与组2的入组顺序,患者按此随机顺序入组,并且在整个试验过程中保持不变。采用SPSS19.0统计软件包进行统计分析,计量资料采用均数±标准差(x±s)表示,对于正态分布或者经转化服从正态分布的资料采用独立样本t检验进行统计分析;计数资料采用频数(%)表示,采用普通卡方或似然比卡方检验进行统计分析;P < 0.05为差异有统计学意义。
2 结果 2.1 即刻及治疗3月后的疗效放疗结束时总体即刻疗效达完全缓解(complete response, CR)15例、部分缓解(partial response, PR)87例、疾病稳定(stable disease, SD)4例、疾病进展(progressive disease, PD)2例;原发灶CR 34例、PR 70例、SD 3例、PD 1例,转移淋巴结达CR 30例、PR 67例、SD 2例、PD 0例,远处转移1例。常规化疗组55例,时辰化疗组53例。88例患者随访到放疗后满3月疗效,其中原发灶疗效达CR 65例、PR 21例;转移淋巴结疗效达CR 55例、PR 18例、SD 1例;发现远处转移3例(其中2例患者未随访到原发灶及淋巴结疗效),故治疗结束3月后总体疗效达CR 58例、PR 26例、SD 1例、PD3例。
2.2 临床特征结果108例患者治疗前NLR平均值为2.80±1.29,其中Ⅳa/b期患者的NLR平均值高于Ⅲ期患者(P=0.010),T3+T4期较T1+T2期有增高趋势(P=0.089)。治疗前PLR平均值为160.87±65.85,其中Ⅳa/b期高于Ⅲ期患者(P=0.010),见表 1。
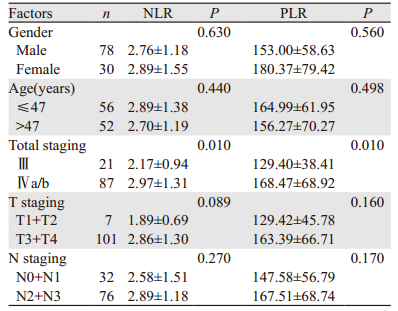 |
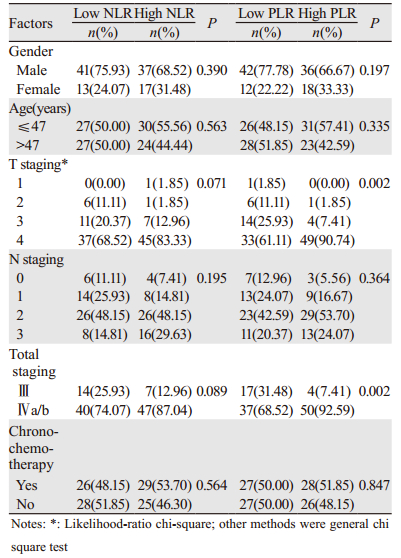
患者治疗前NLR的中位数为2.65(1.01~8.17),>2.65为高NLR组,≤2.65为低NLR组。PLR中位数为159.60(50.43~454.43),>159.60为高PLR组,≤159.60为低PLR组。在T分期及总分期上,高、低NLR两组患者临床特点差异无统计学意义(P > 0.05),高PLR组患者T分期为4期患者多于低PLR组(P=0.002),总分期上高PLR组Ⅳ期患者多于低PLR组(P=0.002),其余临床特点两组未见明显差异(P > 0.05),见表 2。
 |
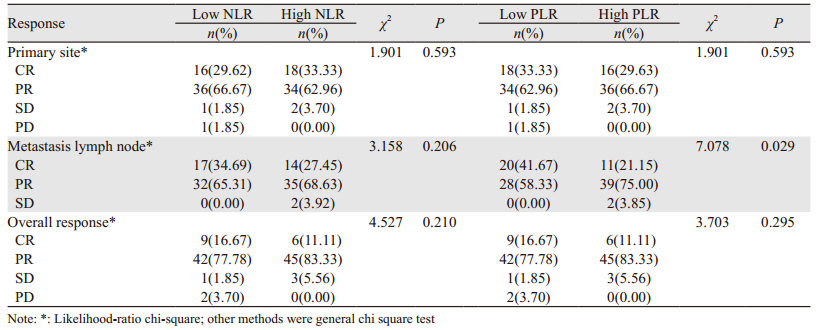
不同PLR分组的转移淋巴结即刻疗效差异具有统计学意义(P=0.029),见表 3。
 |
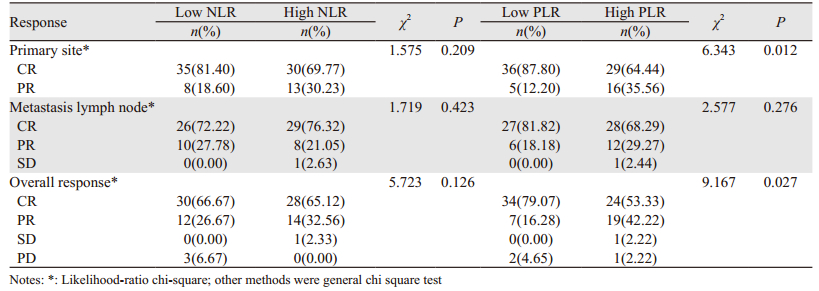
高、低NLR两组放疗后3月的原发灶评价疗效、淋巴结疗效及总体疗效差异均无统计学意义(P > 0.05)。高、低PLR组放疗后3月的原发灶评价疗效及总体疗效低PLR组疗效优于高PLR组,差异具有统计学意义(P < 0.05),见表 4。
 |
高NLR、低NLR患者常规组和时辰组即刻疗效差异无统计学意义(P=0.527, P=0.108)。高PLR、低PLR患者常规组和时辰组即刻疗效差异也无统计学意义(P=0.336, P=0.242)。高NLR、低NLR常规组和时辰组3月疗效差异无统计学意义(P=0.328, P=0.285)。高PLR、低PLR组常规组和时辰组3月疗效差异无统计学意义(P=0.897, P=0.934)。
3 讨论越来越多的证据显示慢性炎性反应可促进肿瘤的发生发展[12-14]。肿瘤细胞的细胞因子及肿瘤微环境可以激发系统的免疫应答[15],该应答中的循环免疫细胞如中性粒细胞、淋巴细胞、单核细胞及血小板的计数升高。NLR升高说明机体炎性反应增加,而淋巴细胞介导的抗肿瘤反应下降,进而易引起肿瘤恶化、转移、最终导致患者预后不良[16-17]。PLR的升高提示血小板的相对升高,淋巴细胞的相对降低。血小板被认为与肿瘤细胞的生长、播散及血管形成有关[18-19]。而淋巴细胞参与免疫监视,与清除肿瘤细胞有关,宿主免疫反应依赖于淋巴细胞。
李晓惠等[20]前瞻性研究了226例初治鼻咽癌患者,分析治疗前NLR与放疗剂量及放疗结束后3月疗效的关系,结果显示T3+T4期NLR高于T1+T2期,男性的NLR高于女性(P=0.039, P=0.032),随着NLR升高鼻咽癌患者放疗敏感度逐渐降低,较敏感组和中等敏感组差异显著(P=0.043)。本研究发现NLR及PLR均与鼻咽癌分期存在一定的联系,Ⅳa/b期患者的NLR及PLR值高于Ⅲ期患者(P=0.010),T3+T4期NLR值较T1+T2期也有增高的趋势(P=0.089)。本研究未得出男性NLR值高于女性的结果,这可能与本组研究病例数较少有关。An等[21]研究结果提示年龄、N分期是影响鼻咽癌患者预后的因素,但本研究近期观察未发现年龄及N分期与NLR及PLR差异之间的联系,还需要长期随访。本研究患者在根治性放疗结束即刻及放疗后3月高、低NLR组疗效差异无统计学意义,结果也与李晓惠等研究结果类似。可能提示NLR对局部晚期鼻咽癌患者的近期疗效预测价值不佳,确切结果有待进一步扩大病例数及继续随访。放疗结束时,高PLR组患者的转移淋巴结疗效较低PLR组差(P=0.029);放疗后3月,高PLR组患者原发灶疗效及总体疗效较低PLR组差(P=0.012, P=0.027)。治疗前PLR值可能是预测患者近期疗效的生物指标。
目前研究提示NLR及PLR与鼻咽癌预后有一定关系,但多数研究中分期及治疗方式不统一。本研究针对局部晚期患者,采用相同治疗方案减少了偏倚。He等[22]按NLR的四分位间距将患者分为四组,Li等[23]建立的鼻咽癌预后分期模型研究了NLR与鼻咽癌患者预后的关系,结果均发现NLR是影响患者预后的独立因素。本研究病例数较少且单中心限制了上述分组方法的使用,基于数据的特征,本研究选择了中位数作为分组的截断值。而本研究最终目的在于观察患者的长期生存及预后,目前入组病例数有待进一步扩大,更准确的结果需要继续延长观察时间。
本研究是来自本中心一项随机前瞻性研究的临床资料,化疗方案的治疗药物及剂量完全相同,只是在给药时间上有差别,分为时辰给药和常规给药(而既往文献研究报道中的治疗方案不一致),本研究另一目的亦渴望了解时辰给药模式是否对NLR、PLR提示预后不佳的病例能改善预后的可能。本中心既往的一项鼻咽癌Ⅱ期临床研究结果表明,时辰诱导化疗可提高患者的局部控制率[24],减轻患者的化疗不良反应,而本研究结果提示,时辰化疗与常规化疗给药方式在患者即刻疗效及放疗后3月疗效中各组差异均无统计学意义,这可能与本研究患者病例数少,且随访时间短有关。因此,需要扩大临床病例数及延长观察时间获得进一步研究结果。
综上所述,NLR和PLR均与鼻咽癌临床分期有关,分期越晚,NLR和PLR值越高。NLR对患者的近期疗效预测价值欠佳,需要进一步扩大数据。PLR可能是预测局部晚期鼻咽癌患者近期疗效的指标,高PLR患者的近期疗效差。NLR及PLR的临床指导意义有待进一步探讨。
作者贡献
唐红:数据收集、整理、分析、论文书写;吴伟莉:指导课题、修改论文;金风:指导课题;龙金华:指导临床试验;李媛媛、罗秀玲、龚修云、陈潇潇:实施临床试验;张芒:收集、整理数据;杨春李:收集数据
| [1] | Hu K, Lou L, Ye J, et al. Prognostic role of the neutrophil-lymphocyte ratio in renal cell carcinoma: a meta-analysis[J]. BMJ Open, 2015, 5(4): e006404. DOI:10.1136/bmjopen-2014-006404 |
| [2] | Yang JJ, Hu ZG, Shi WX, et al. Prognostic significance of neutrophil to lymphocyte ratio in pancreatic cancer: a meta-analysis[J]. World J Gastroenterol, 2015, 21(9): 2807–15. DOI:10.3748/wjg.v21.i9.2807 |
| [3] | Yang X, Huang Y, Feng JF, et al. Prognostic significance of neutrophil-to-lymphocyte ratio in esophageal cancer: a meta-analysis[J]. Onco Targets Ther, 2015, 8: 789–94. |
| [4] | Luigina G, Elisabetta M, Verena De A, et al. Prognostic value of preoperative neutrophils to lymphocytes ratio in patients resected for gastric cancer[J]. Am J Surg, 2015, 209(2): 333–7. DOI:10.1016/j.amjsurg.2014.06.014 |
| [5] | Chen Q, Dai Z, Yin D, et al. Negative Impact of Preoperative Platelet-Lymphocyte Ratio on Outcome After Hepatic Resection for Intrahepatic Cholangio-carcinoma[J]. Medicine(Baltimore), 2015, 94(13): e574. |
| [6] | Kusumanto YH, Dam WA, Hospers GA, et al. Platelets and granulocytes, in particular the neutrophils, form important compartments for circulating vascular endothelial growth factor[J]. Angiogenesis, 2003, 6(4): 283–7. DOI:10.1023/B:AGEN.0000029415.62384.ba |
| [7] | Chang H, Gao J, Xu BQ, et al. Haemoglobin, neutrophil to lymphocyte ratio and platelet count improve prognosis prediction of the TNM staging system in nasopharyngeal carcinoma: development and validation in 3, 237 patients from a single institution[J]. Clin Oncol (R Coll Radiol), 2013, 25(11): 639–46. DOI:10.1016/j.clon.2013.07.004 |
| [8] | Jin Y, Ye X, He C, et al. Pretreatment neutrophil-to-lymphocyte ratio as predictor of survival for patients with metastatic nasopharyngeal carcinoma[J]. Head Neck, 2015, 37(1): 69–75. DOI:10.1002/hed.23565 |
| [9] | Jiang R, Zou X, Hu W, et al. The elevated pretreatment platelet-to-lymphocyte ratio predicts poor outcome in nasopharyngeal carcinoma patients[J]. Tumour Biol, 2015, 36(10): 7775–87. DOI:10.1007/s13277-015-3505-0 |
| [10] | Edge SB, Byrd DR, Compton CC, et al. AJCC cancer staging manual[M]. 7th. New York: Springer, 2010. |
| [11] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: Revised recist guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228–47. DOI:10.1016/j.ejca.2008.10.026 |
| [12] | Tsai YD, Wang CP, Chen CY, et al. Pretreatment circulating monocyte count associated with poor prognosis in patients with oral cavity cancer[J]. Head Neck, 2014, 36(7): 947–53. DOI:10.1002/hed.v36.7 |
| [13] | Torisu H, Ono M, Kiryu H, et al. Macrophage infiltration correlates with tumor stage and angiogenesis in human malignant melanoma: possible involvement of TNFalpha and IL-1alpha[J]. Int J Cancer, 2000, 85(2): 182–8. DOI:10.1002/(ISSN)1097-0215 |
| [14] | Varney ML, Olsen KJ, Mosley RL, et al. Paracrine regulation of vascular endothelial growth factor--a expression during macrophage-melanoma cell interaction: role of monocyte chemotactic protein-1 and macrophage colony-stimulating factor[J]. J Interferon Cytokine Res, 2005, 25(11): 674–83. DOI:10.1089/jir.2005.25.674 |
| [15] | Valero C, Pardo L, Lopez M, et al. Pretreatment count of peripheral neutrophils, monocytes, and lymphocytes as independent prognostic factor in patients with head and neck cancer[J]. Head Neck, 2017, 39(2): 219–26. DOI:10.1002/hed.24561 |
| [16] | Cerwenka A, Lanier LL. Natural killer cell memory in infection, inflammation and cancer[J]. Nat Rev Immunol, 2016, 16(2): 112–23. |
| [17] | Wang D, DuBois RN. Immunosuppression associated with chronic inflammation in the tumor microenvironment[J]. Carcinogenesis, 2015, 36(10): 1085–93. DOI:10.1093/carcin/bgv123 |
| [18] | Radziwon-Balicka A, Moncada de la Rosa C, Jurasz P. Platelet-associated angiogenesis regulating factors: a pharmacological perspective[J]. Can J Physiol Pharmacol, 2012, 90(6): 679–88. DOI:10.1139/y2012-036 |
| [19] | Takagi S, Takemoto A, Takami M, et al. Platelets promote osteosarcoma cell growth through activation of the platelet-derived growth factor receptor-Akt signaling axis[J]. Cancer Sci, 2014, 105(8): 983–8. DOI:10.1111/cas.2014.105.issue-8 |
| [20] | 李晓惠, 徐冰清, 高劲, 等. 中性粒细胞与淋巴细胞比值对鼻咽癌放射敏感性及预后影响的研究[J]. 中华放射肿瘤学杂志, 2016, 25(5): 432–6. [ Li XH, Xu BQ, Gao J, et al. Influence of neutrophil-lymphocyte ratio on radiosensitivity and prognosis in patients with nasopharyngeal carcinoma[J]. Zhonghua Fang She Zhong Liu Za Zhi, 2016, 25(5): 432–6. DOI:10.3760/cma.j.issn.1004-4221.2016.05.002 ] |
| [21] | An X, Ding PR, Wang FH, et al. Elevated neutrophil to lymphocyte ratio predicts poor prognosis in nasopharyngeal carcinoma[J]. Tumour Biol, 2011, 32(2): 317–24. DOI:10.1007/s13277-010-0124-7 |
| [22] | He JR, Shen GP, Ren ZF, et al. Pretreatment levels of peripheral neutrpphils and lymphocytes as independent prognostic factors in patients with nasopharyngeal carcinoma[J]. Head Neck, 2012, 34(12): 1769–76. DOI:10.1002/hed.v34.12 |
| [23] | Li JP, Chen SL, Liu XM, et al. A Novel Inflammation-Based Stage (ⅠStage) Predicts Overall Survival of Patients with Nasopharyngeal Carcinoma[J]. Int J Mol Sci, 2016, 17(11): pii: E1900. DOI:10.3390/ijms17111900 |
| [24] | Feng J. Induction Chronochemotherapy Plus Radiation Therapy for Nasopharyngeal Carcinoma: A Phase 2 Prospective Randomized Study[J]. Inter J Radiation Oncol Biol Phys, 2013, 87(2Suppl): S448. |
 2019, Vol. 46
2019, Vol. 46


