文章信息
- 568例HER2不确定乳腺癌原位杂交结果分析
- In Situ Hybridization Status of 568 Cases of HER2 Equivocal Breast Cancer
- 肿瘤防治研究, 2019, 46(7): 605-609
- Cancer Research on Prevention and Treatment, 2019, 46(7): 605-609
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0482
- 收稿日期: 2019-01-09
- 修回日期: 2019-04-04
编码HER2蛋白的人类表皮生长因子受体2(Human epidermal growth factor receptor, HER2)基因位于17号染色体。HER2基因扩增与肿瘤的侵袭性增强和预后不良相关,约15%~20%的乳腺癌患者存在HER2基因扩增[1]。曲妥珠单抗(Herceptin,赫赛汀)是针对HER2基因扩增患者的单克隆抗体,作为一线药物,与紫杉类药物联合应用能延长转移性乳腺癌患者的生存期,提高患者生存质量,单药应用也能起到治疗作用[2-3]。新药如拉帕替尼、帕妥珠单抗[4]等也逐渐被用于临床。准确判定HER2基因状态是患者筛选和疗效预测的前提。
对于免疫组织化学(immunohistochemistry, IHC)为2+的HER2不确定病例,ASCO/CAP乳腺癌HER2检测指南推荐使用原位杂交(in situ hybridization, ISH)法进一步检测HER2基因扩增状态。荧光原位杂交(fluorescent in situ hybridization, FISH)检测结果准确,在临床应用最为广泛。双色银增强原位杂交(dual-color silver enhanced in-situ hybridization, DISH)因其亮视野的优势也逐渐应用于HER2基因状态评估。对于ISH结果判定,2018版[5] HER2检测指南与2013版[1]相比,取消了HER2“不确定”的诊断名称,将双探针ISH的HER2检测结果分为5组,且更强调HER2/CEPl7的重要,旨在进一步提高检测结果的准确性,指导临床用药。本研究分别采用2013版及2018版ASCO/CAP指南标准,对568例免疫组织化学HER2不确定浸润性乳腺癌组织的FISH结果进行对比分析,并随机抽取60例进行DISH检测,比较FISH及DISH检测结果差异。
1 资料与方法 1.1 标本处理收集西安交通大学第一附属医院病理科2013—2017年手术切除诊断为浸润性乳腺癌的标本568例。标本采用4%中性甲醛固定液切开固定6~24 h,标准化取材,石蜡包埋,4 µm厚连续切片。
1.2 IHC检测采用HER2(4B5,兔单克隆抗体,Ventana公司,瑞士)抗体、ultra View Universal DAB(Ventana公司,瑞士)检测试剂盒及Ventana BenchMark XT(罗氏公司,瑞士)全自动切片染色机。所有病例均设有阳性对照,由2位病理医生判读,结果均为2+。
1.3 FISH检测所有病例均进行HER2双探针FISH检测,并按2013版及2018版ASCO/CAP乳腺癌HER2检测指南标准分别判读。所用PathVysion HER2 DNA、第17号染色体着丝粒(CEP17)双荧光探针试剂盒、蛋白酶缓冲液、橡胶水泥等均购于中山大学达安基因股份有限公司。石蜡切片56℃烤片过夜、常规脱蜡、蛋白酶消化、乙醇脱水,取10 µl探针混合液加盖玻片、橡胶水泥封片,75℃变性10 min后在杂交仪(美国Abbott StatSpin ThermoBrite公司)内37℃杂交过夜(15~17 h)。次日洗片后二脒基苯基吲哚(DAPI)染色,荧光显微镜下观察结果,VideoTest软件进行图像合成。
1.4 DISH检测随机抽取60例进行DISH检测并评估HER2基因扩增状态。全过程包括脱蜡、修复、酶消化、探针杂交、显色等,均在BenchMark XT全自动切片染色机内进行。采用试剂购自罗氏公司,包括HER2/CEP17号染色体DNA双探针、清洗缓冲液、银染原位杂交DNP染色液及原位杂交地高辛红染染色液及银染清洗缓冲液。操作步骤及参数设置按照操作手册及试剂说明书。常规封片,光学显微镜下观察。
1.5 判读标准分别采用2013版及2018版ASCO/CAP乳腺癌HER2原位杂交判读标准,FISH与DISH检测判读标准相同,判读至少2个浸润性癌区域,随机选择20个肿瘤细胞,细胞核大小一致且边界完整、无重叠、信号清楚。结果不一致的病例,由第三位高年资病理医生参与共同阅片,确定最终结果。
1.6 统计学方法采用SPSS21.0统计软件进行数据分析,对于不同标准下的检测结果行配对t检验,以P < 0.05为差异有统计学意义。FISH与DISH两种检测结果的相关性,通过Pearson相关性分析进行检测。
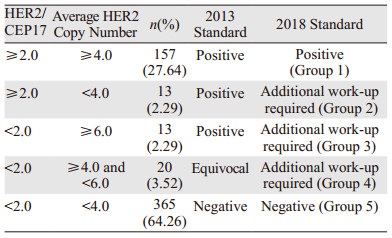
2 结果 2.1 FISH检测结果568例浸润性乳腺癌均为IHC检测不确定标本,男6例,女562例,平均年龄51.3岁(24~85岁),依据2013版ASCO/CAP指南分为:HER2阳性183例(183/568, 32.22%)、阴性365例(365/568, 64.26%)、不确定20例(20/568, 3.52%);在阳性病例中,HER2/CEP17≥2.0者170例(170/183, 92.90%),HER2/CEP17 < 2.0者13例(13/183, 7.10%)。依据2018版ASCO/CAP HER2检测指南分为:HER2阳性157例(157/568, 27.64%)、阴性365例(365/568, 64.26%)、需进一步检测HER2状态46例(46/568, 8.10%),其中第二、三组均为13例(2.29%),第四组20例(3.52%),见表 1。
|
采用2018版标准后,在未进行进一步IHC或ISH计数的前提下,HER2阳性率减少了4.58%,阴性率无差异,需进一步检测HER2基因状态的病例增加了4.58%,两种诊断标准相比较,差异具有统计学意义(P=0.002)。
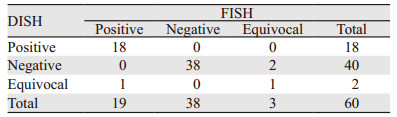
2.3 FISH和DISH检测结果比较在FISH检测的568例浸润性乳腺癌患者中,随机抽取60例进行DISH检测,两种检测方法比较结果,见表 2。
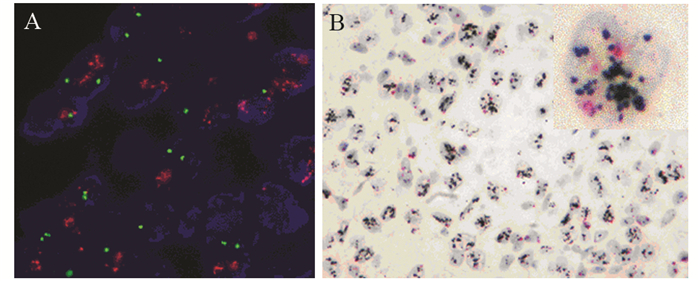
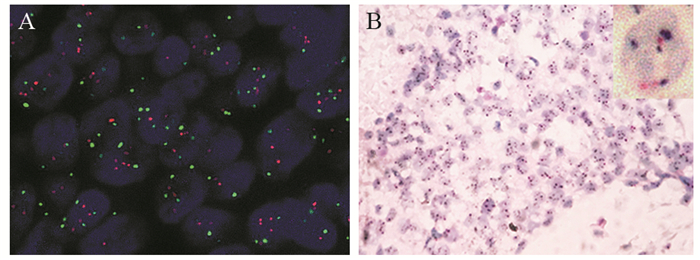
按2013版ASCO/CAP检测指南对60例浸润性乳腺癌HER2基因扩增状态的FISH和DISH检测结果比较显示,两者总符合率为95.0%(57/60),其中19例FISH阳性病例中DISH阳性18例(图 1)、DISH为不确定1例,阳性符合率为94.7%;3例FISH不确定病例(图 2A、3A),DISH不确定1例(图 2B)、阴性2例(图 3B),符合比例为33.3%;38例FISH阴性病例中DISH均为阴性,阴性符合率为100.0%。
|
| A: FISH ×1000; B: DISH×400 图 1 HER2基因扩增阳性的浸润性乳腺癌 Figure 1 HER2 positive invasive breast cancer specimen tested by FISH and DISH |
|
| A: FISH ×1000; B: DISH×400 图 2 HER2基因扩增不确定的浸润性乳腺癌 Figure 2 HER2 equivocal invasive breast cancer specimen tested by FISH and DISH |
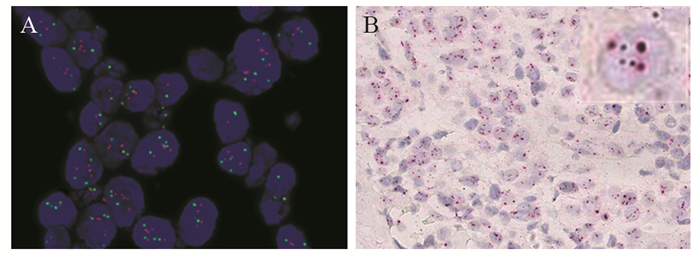
|
| A: HER2 equivocal tested by FISH (×1000); B: HER2 negative tested by DISH (×400) 图 3 FISH与DISH检测结果不一致病例 Figure 3 Inconsistent case tested by FISH and DISH |
FISH方法检测结果中HER2/CEP17比值范围为0.9~10.0,中位数为1.4,DISH方法检测结果中HER2/CEP17比值范围为0.7~12.5,中位数为2.4,通过Pearson相关性分析,两种方法的检测结果显著相关(r=0.636, P < 0.01)。
3 讨论1987年Slamon第一次提出HER2基因在乳腺癌生物学行为和肿瘤发生方面具有重要的意义[6]。2000年,针对HER2基因扩增的单克隆抗体曲妥珠单抗在欧洲注册并用于治疗HER2阳性乳腺癌患者,据报道该小分子抑制剂可减少50%复发率及约30%的死亡率[7-8]。目前,已有四种HER2靶向药物被批准用于临床,曲妥珠单抗、拉帕替尼、帕妥珠单抗及ado-曲妥珠单抗emtansine[9]。HER2基因状态的准确评估,对于HER2基因扩增乳腺癌患者的筛选、临床用药选择及患者预后至关重要。
2007年ASCO/CAP首次推荐乳腺癌HER2检测指南[10]作为临床及病理医生判读评估乳腺癌患者HER2基因状态的依据,旨在减少假阳性病例诊断,避免HER2靶向治疗药物过度使用而产生的不良反应及经济负担。该指南于2013年更新[1]。2018年7月,根据文献回顾及真实世界研究数据分析,ASCO/CAP发表了最新版HER2检测指南[5],与前几版相比,该指南判读标准更明确、分类更精细。变动主要包括以下几方面:第一,将HER2 IHC 2+的定义由弱至中等强度的不完整细胞膜着色,更改为完整细胞膜着色。从而减少了IHC不确定病例的数量;第二,对于初诊为HER2阴性的穿刺标本,不再强调术后必须重复进行HER2状态检测。认为穿刺与手术切除标本具有较高的一致性;第三,取消了HER2“不确定”的诊断名称,将双探针ISH的HER2检测结果分为5组,对于争议比较大的2、3、4组,建议联合IHC和ISH的检测结果综合判读。本研究同时进行IHC、FISH和DISH的60例样本中,3例为FISH不确定,属于第4组,即HER2/CEP17 < 2.0,HER2平均拷贝数≥4且 < 6,根据2018版指南要求,重新进行IHC结果为2+,随后进行第二种原位杂交方法DISH检测,阴性2例,不确定1例,该不确定病例按照2013版指南应诊断为HER2不确定,但是根据2018版指南,则应诊断为HER2阴性。我们认为,和前几版相比,2018版指南减少了病理医生诊断方面的困惑,特别是取消了“HER2不确定”的诊断名称,对临床用药更具指导作用。
许多学者认为,相对于HER2/CEP17比值而言,HER2基因拷贝数目更为重要。Varga等[11]研究发现,HER2基因扩增常常伴随着丝粒区的扩增,如果不强调HER2基因拷贝数,会导致HER2/CEPl7 < 2.0的假阴性结果。另一方面,对于HER2/CEP17≥2.0且HER2拷贝数 < 4的病例,根据2013版指南,应判读为HER2基因扩增,但实际是否存在扩增,专家之间意见尚未统一,有学者认为应是CEP17拷贝数过低造成的假阳性结果。这部分阳性病例需更进一步的随访。本研究中13例(2.29%)可归为此类,目前相关的用药疗效统计仍在进行中。
目前,临床主要使用IHC法检测HER2蛋白的表达水平,采用ISH法检测HER2基因的扩增水平。我国乳腺癌HER2检测指南推荐以上两种方法相结合的检测策略[12]。在建立完善的实验室标准操作程序及使用标准化检测试剂等前提下,IHC以其费用低、操作简便等优点,被广泛应用于临床。虽然,IHC仅能检测HER2蛋白表达水平,但是仍可以准确评估HER2状态。Hanna等研究发现,对于手术切除标本情况为0~1+的病例,与ISH相比,IHC仅存在0.84%的假阴性误差[13]。双探针FISH自1998年获得FDA批准以来,因其准确客观的优点,一直作为检测HER2基因状态的“金标准”被广泛应用[14]。但FISH需全程避光并且需要配备荧光显微镜观察信号,荧光易淬灭、切片不易长期保存。2008年,显色原位杂交(chromogenic in situ hybridization, CISH)经FDA批准应用于临床。作为亮视野下的原位杂交,该项技术由Tanner等首先引入乳腺癌HER2检测[15]。但CISH不含17号染色体着丝粒探针,所以不能准确判断17号染色体多体的状态,对HER2多倍体的病例判读时会产生假阳性结果。DISH技术是一种能够同时检测到HER2基因和17号染色体着丝粒的亮视野原位杂交技术,可实现全自动操作,耗时短,无需避光,普通光学显微镜可观察结果,信号清晰,切片可长期保存,于2012年通过FDA认证[16],2014年获得我国乳腺癌HER2检测指南推荐应用临床[14]。对照研究发现,DISH技术与FISH和CISH符合率为94%~99%[17]。更有研究发现,在使用原位杂交技术检测浸润性乳腺癌中TOP2A基因状态时,DISH较FISH更具优势[18]。Lim等的对比研究证明DISH与FISH相比,检测符合率高,且用时短[16]。根据实验室2年统计,DISH耗时仅为FISH检测的1/2~1/3。
我们随机抽取60例患者进行DISH检测,与FISH检测的总体符合率为95.0%,其中阳性符合率为94.7%,阴性符合率为100%。DISH与FISH检测结果的不一致性主要表现为阳性病例的减少和不确定病例的增加。判读有差别的病例分析原因,主要有以下两点:(1)DISH判读标准中,黑色重叠信号计数为1个,低拷贝或CEP17多体时,易判读为阴性结果;(2)计数区域选择不同,乳腺癌异质性较高,人为选择计数区域会有差异,造成可能的判读结果不同。所以,进行DISH检测时,应根据各实验室的实际条件,选择最佳条件,减少误差。并加强人员标准化培训,选择合适的区域进行计数,在判读黑色重叠信号时,应用最科学准确的方法。
综上所述,2018版指南取消“HER2不确定”诊断名称,判读标准更明确,对于准确判读HER2基因状态、临床用药等方面更具指导作用。HER2基因的染色体多体性在乳腺癌中少见,因此判读结果时HER2/CEP17比值与CEP17拷贝数同样重要。但是,对于HER2/CEP17比值≥2.0,CEP17拷贝数 < 4的病例实际是否存在HER2基因扩增还需深入研究。在临床应用中,检测浸润性乳腺癌患者HER2状态,IHC、FISH和DISH三种方法相辅相成,各具优缺点。虽然DISH技术具有FISH和CISH缺乏的显著优点,并且检测结果准确可靠,但阳性率仍有待提高,应结合各实验室实际情况,优化实验条件,确保检测准确性。
作者贡献
蒋依娜: 实验设计、部分FISH及DISH实验操作、数据整理及分析、论文撰写及修改
王博: 统计学分析
周灿: 临床资料整理及分析
王鸿雁: 实验及论文指导
| [1] | Wolff AC, Hammond ME, Hicks DG, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update[J]. J Clin Oncol, 2013, 31(31): 3997–4013. DOI:10.1200/JCO.2013.50.9984 |
| [2] | Baselga J, Perez EA, Pienkowski T, et al. Adjuvant Trastuzumab A Milestone in the Treatment of HER-2-Positive Early Breast Cancer[J]. Oncologist, 2006, 11(Suppl 1): 4–12. |
| [3] | Press MF, Sauter G, Buyse M, et al. HER2 Gene Amplification Testing by Fluorescent In Situ Hybridization (FISH): Comparison of the ASCO-College of American Pathologists Guidelines With FISH Scores Used for Enrollment in Breast Cancer International Research Group Clinical Trials[J]. J Clin Oncol, 2016, 34(29): 3518–3528. DOI:10.1200/JCO.2016.66.6693 |
| [4] | von Minckwitz G, Procter M, de Azambuja E, et al. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer[J]. N Engl J Med, 2017, 377(2): 122–131. DOI:10.1056/NEJMoa1703643 |
| [5] | Wolff AC, Hammond MEH, Allison KH, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update[J]. J Clin Oncol, 2018, 36(20): 2105–2122. DOI:10.1200/JCO.2018.77.8738 |
| [6] | Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer correlation of relapse and survival with amplification of the HER-2 neu oncogene[J]. Science, 1987, 235(4785): 177–182. DOI:10.1126/science.3798106 |
| [7] | Schmidt M, Lewark B, Kohlschmidt N. Long-term prognostic significance of HER-2 neu in untreated node-negative breast cancer depends on the method of testing[J]. Breast Cancer Res, 2005, 7(2): R256–R266. DOI:10.1186/bcr991 |
| [8] | Romond EH, Perez EA, Bryant J, et al. Trastuzumab plus Adjuvant Chemotherapy for Operable HER2-Positive Breast Cancer[J]. N Engl J Med, 2005, 353(16): 1673–1684. DOI:10.1056/NEJMoa052122 |
| [9] | Zhao B, Zhao H. Impact of clinicopathological characteristics on the efficacy of neoadjuvant therapy in patients with human epidermal growth factor receptor-2-positive breast cancer[J]. Int J Cancer, 2018, 142(4): 844–853. DOI:10.1002/ijc.31097 |
| [10] | Wolff AC, Hammond ME, Schwartz JN, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer[J]. J Clin Oncol, 2007, 25(1): 118–145. |
| [11] | Varga Z, Tubbs RR, Wang Z, et al. Co-amplification of the HER2 gene and chromosome 17 centromere: a potential diagnostic pitfall in HER2 testing in breast cancer[J]. Breast Cancer Res Treat, 2012, 132(3): 925–935. DOI:10.1007/s10549-011-1642-8 |
| [12] | 《乳腺癌HER2检测指南》编写组. 乳腺癌HER2检测指南(2019版)[J]. 中华病理学杂志, 2019, 48(3): 169–175. [ Writing group of guide for the detection of HER-2 in breast cancer. Guide for the detection of HER-2 in breast cancer (2019 edition)[J]. Zhonghua Bing Li Xue Za Zhi, 2019, 48(3): 169–175. DOI:10.3760/cma.j.issn.0529-5807.2019.03.001 ] |
| [13] | Hanna WM, Barnes PJ, Chang MC, et al. Human epidermal growth factor receptor 2 testing in primary breast cancer in the era of standardized testing: a Canadian prospective study[J]. J Clin Oncol, 2014, 32(35): 3967–3973. DOI:10.1200/JCO.2014.55.6092 |
| [14] | 《乳腺癌HER2检测指南》编写组. 乳腺癌HER2检测指南(2014版)[J]. 中华病理学杂志, 2014, 43(4): 262–267. [ Writing group of guide for the detection of HER-2 in breast cancer. Guide for the detection of HER-2 in breast cancer (2014) edition[J]. Zhonghua Bing Li Xue Za Zhi, 2014, 43(4): 262–267. DOI:10.3760/cma.j.issn.0529-5807.2014.04.012 ] |
| [15] | Tanner M, Gancberg D, Di Leo A, et al. Chromogenic in situ hybridization a practical alternative for fluorescence in situ hybridization to detect HER-2 neu oncogene amplification in archival breast cancer samples[J]. Am J Pathol, 2000, 157(5): 1467–1472. DOI:10.1016/S0002-9440(10)64785-2 |
| [16] | Lim SJ, Cantillep A, Carpenter PM, et al. Validation and workflow optimization of human epidermal growth factor receptor 2 testing using INFORM HER2 dual-color in situ hybridization[J]. Hum Pathol, 2013, 44(11): 2590–2596. DOI:10.1016/j.humpath.2013.07.005 |
| [17] | Lee Y, Ryu Y, Jeong H, et al. Effectiveness of silver-enhanced in situ hybridization for evaluating HER2 gene status in invasive breast carcinoma: a comparative study[J]. Arch Med Res, 2012, 43(2): 139–144. DOI:10.1016/j.arcmed.2012.03.010 |
| [18] | Garcia-Caballero T, Prieto O, Vazquez-Boquete A, et al. Dual-colour CISH is a reliable alternative to FISH for assessment of topoisomerase 2-alpha amplification in breast carcinomas[J]. Breast Cancer Res Treat, 2014, 143(1): 81–89. |
 2019, Vol. 46
2019, Vol. 46