文章信息
- 阿帕替尼治疗合并有KDR基因突变的晚期肾上腺皮质癌获长期缓解1例报道
- Long-term Remission of Advanced Adrenocortical Carcinoma with KDR Gene Mutation Treated with Apatinib Mesylate: A Case Report
- 肿瘤防治研究, 2019, 46(1): 99-102
- Cancer Research on Prevention and Treatment, 2019, 46(1): 99-102
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0400
- 收稿日期: 2018-03-26
- 修回日期: 2018-09-26
肾上腺皮质癌(adrenocortical carcinoma, ACC)是一种罕见且具有高度侵袭性的恶性病变。局限期患者的治疗以根治性手术为主,晚期ACC的治疗方案一般都是基于非随机对照试验或者回顾性研究,因此关于晚期ACC治疗的推荐意见证据等级大多在Ⅱ~Ⅳ级。苏州市立医院(东区)肿瘤科近期使用甲磺酸阿帕替尼治疗1例合并有KDR(kinase domain receptor)基因突变的晚期非功能性ACC患者,疗效显著。为提高对ACC治疗的认识,结合相关文献进行讨论,现报告如下。
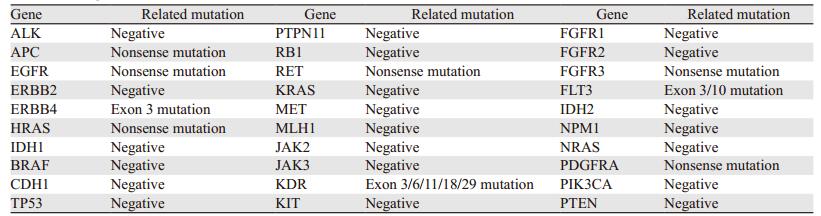
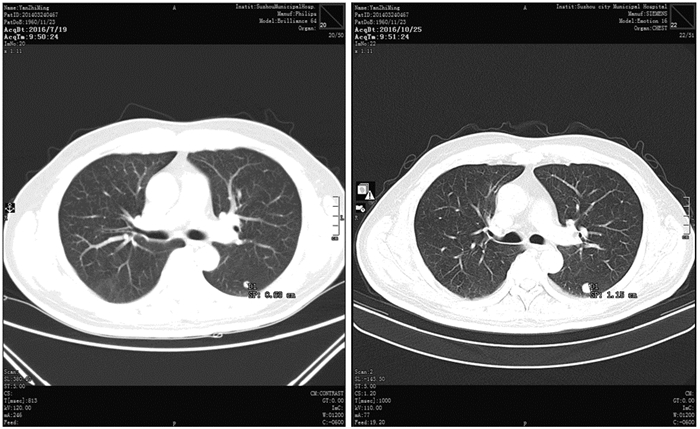
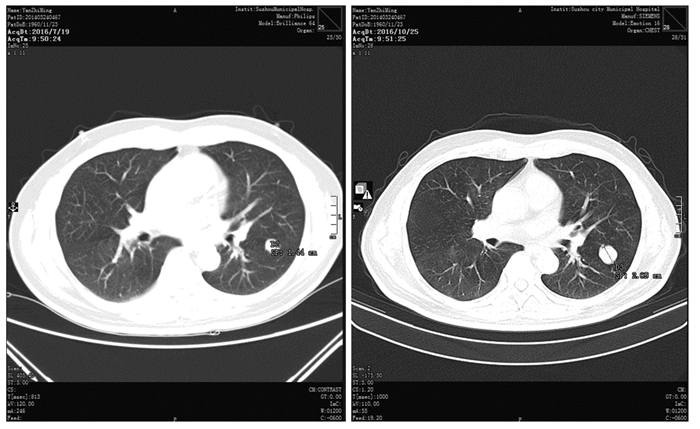
1 临床资料 1.1 一般资料患者男,56岁,2015年5月底体检时发现右侧肾上腺巨大占位,当时无任何不适症状,进一步进行肾上腺皮质功能检查未见异常。同年6月4日行“右侧肾上腺+右肾部分切除术”,术中见:右侧肾上腺位置巨大肿块,大小13 cm×10 cm,肿块下极与肾脏上极相连,术后病理:(右肾上腺)肾上腺皮质肿瘤。免疫组织化学:CgA(-),Inhibin-α(-),Vimentin(+),Syn(+),CD56(+),CK7(-),AE1/AE3(+/-),CD10(-),S100(-),Ki67(+ < 1%),PAX8(-),RCC(-),WT-1(-),CD34(-),Actin(-),CK8/18(-),CD99(+),CK5/6(-),Melan A(+),B-catenin(-/+)。术后未予特异性抗肿瘤治疗。2016年7月随访中CT检查发现:右肾肿块,两肺多发结节,考虑为转移癌,见图 1~3。7月26日再行“右肾切除术”,术后病理:(右肾)肾上腺皮质癌伴出血和坏死,癌组织浸润周围脂肪组织,累及肾周被膜,肾实质未见明确累及,脉管内见癌栓,输尿管切缘未见癌累及。考虑患者诊断为ACC,Ⅳ期,属疾病晚期,以系统性姑息治疗为主。遂于8月23日~10月5日予吉西他滨+奥沙利铂方案化疗四周期(吉西他滨1.0 g/m2,奥沙利铂100 mg/m2,每14天为一周期),10月25日复查胸部CT显示双肺病灶增多增大,见图 1~3,按RECIST标准疗效评价为进展。
|
| 图 1 治疗前左上肺靶病灶一(0.63 cm增大至1.15 cm) Figure 1 The first target lesion in upper left lung increased from 0.63cm to 1.15cm before treatment |
|
| 图 2 治疗前左上肺靶病灶二(1.44 cm增大至2.09 cm) Figure 2 The second target lesion in upper left lung increased from 1.44cm to 2.09cm before treatment |
|
| 图 3 治疗前左下肺靶病灶三(0.48 cm增大至1.12 cm) Figure 3 The third target lesion in lower left lung increased from 0.48cm to 1.12cm before treatment |
征得患者知情同意后,对50个具有治疗靶点的常见肿瘤突变基因进行了高通量二代测序,第二次手术石蜡标本和外周血同时送检,测序深度为500X,测序基因结果见表 1。发现患者存在KDR基因第6/11/18/29外显子突变(11号外显子Q472H突变,6, 18, 29无义突变)。
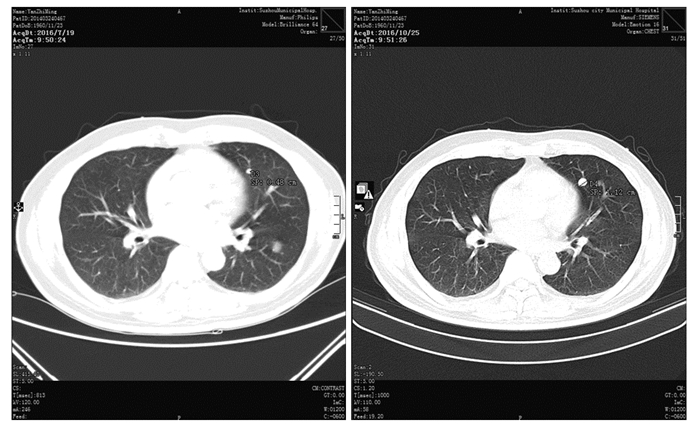
患者于2016年10月27日起试予甲磺酸阿帕替尼500 mg qd口服治疗,至11月25日复查CT提示两肺3枚靶病灶较前缩小44.6%,另外有一枚非靶病灶完全消失,疗效判定为PR,见图 4~7。2016年12月26日、2017年2月23日再次复查CT,上述靶病灶仍在进一步缩小,最近一次复查时间为2018年6月,仍维持PR状态。治疗后患者一般情况好,有Ⅰ度乏力,手足皮肤反应Ⅰ~Ⅱ度,目前仍在继续治疗,并随访观察中。
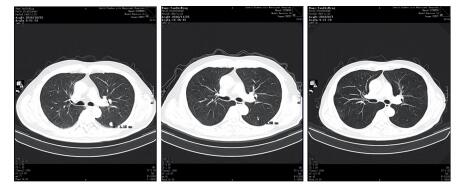
|
| 图 4 治疗后左上肺靶病灶一(1.15 cm缩小至0.65 cm) Figure 4 The first target lesion in upper left lung decreased from 1.15cm to 0.65cm after treatment |
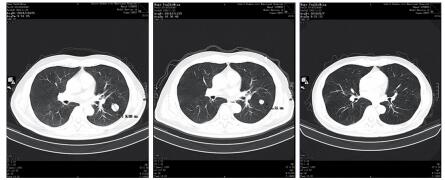
|
| 图 5 治疗后左上肺靶病灶二(2.09 cm缩小至1.11 cm) Figure 5 The second target lesion in upper left lung decreased from 2.09cm to 1.11cm after treatment |
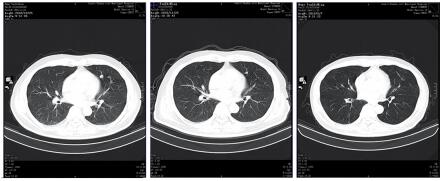
|
| 图 6 治疗后左下肺靶病灶三(1.12 cm缩小至0.64 cm) Figure 6 The third target lesion in lower left lung decreased from 1.12cm to 0.64cm after treatment |
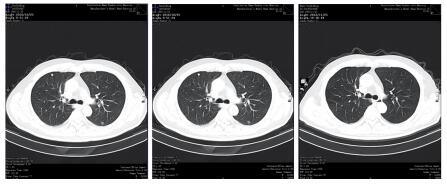
|
| 图 7 治疗后右上肺非靶病灶消失 Figure 7 Non-target lesion in right upper lung disappeared after treatment |
肾上腺皮质癌起源于肾上腺皮质细胞,具有高度侵袭性,临床罕见,人群中的年发病率为1.0~2.0/100万人,实际发病率可能略高。ACC根据临床表现分为功能性和无功能性两类,功能性ACC占45%~60%,混合或单纯分泌皮质醇、雄激素[1]。无功能性ACC起病隐匿,多以腹部包块、胀痛等原因就诊,半数患者以转移症状为其首发的临床表现[2]。近年来研究显示ACC的分子机制主要与基因突变、细胞因子表达异常、miRNA失调、DNA甲基化等诸多因素有关。Xu等[3]研究显示70.83%(128/169例)的肾上腺皮质癌患者VEFG表达水平升高。
早期的肾上腺皮质癌治疗手段主要是在影像学检查和内分泌标志物检查的基础上,由经验丰富的医生进行R0切除。在有经验的中心,对局限性的肾上腺皮质癌来说,腹腔镜下的肾上腺切除和开放手术一样安全、有效。因肾上腺皮质癌极易复发,米托坦可以用作辅助治疗药物。有国际多中心的研究建议使用肿瘤分期、切除是否彻底、以及Ki-67指数作为预测模型来判断是否有必要使用米托坦作为术后辅助治疗[4]。
在进展期或者复发并且不能完全切除的ACC患者中,单纯手术治疗是不够的。这些病例可以使用米托坦单药或者联合化疗药物。在最近发表的一项Ⅲ期临床试验中,化疗方案依托泊苷+阿霉素+顺铂联合米托坦(EDP+米托坦)及链唑霉素联合米托坦)的比较中,EDP+米托坦方案在缓解率和PFS均优于链唑霉素+米托坦方案。关于新的化疗方案研究目前也有了一定的进展,例如吉西他滨联合卡培他滨[5]、多西他赛联合顺铂[6]均是可能的二线或三线化疗方案。对内分泌分泌过量具有相关症状的患者,可以用类固醇类的抑制剂对症处理。
近年来在晚期ACC患者中开展了多项针对类胰岛素生长因子1(insulin-like growth factor 1, IGF1)、表皮生长因子受体(EGFR)、m-TOR以及血管内皮生长因子(VEGF)的临床研究,但其研究结果均显示只对极少部分患者有效,并未取得无进展生存及总生存的获益,同时也未发现可以预测疗效的分子标志物。
KDR激酶功能区受体,又称内皮生长因子受体Ⅱ(vascular endothelial growth factor receptor Ⅱ, VEGFR2), 主要介导内皮细胞的增殖,导致血管通透性的增高,并阻止内皮细胞凋亡、维持内皮细胞的存活、与胚胎期内皮细胞的分化有关,是VEGF在肿瘤新生血管形成中发挥功能的主要受体,抑制它的激酶活性就可以抑制KDR的生物活性。以KDR为靶点进行肿瘤的抑制血管治疗比直接以肿瘤细胞为靶向的治疗具有如下优点:治疗药物易到达作用部位,不会产生多药耐药性、广谱性和不良反应小等,虽然不同肿瘤来源的血管类型不同,但受VEGF/KDR信号途径的调控这一点是共同的。因此,以KDR为靶点抑制新生血管α的形成将成为一种很有希望治愈肿瘤的方法,并逐渐成为当今的一个主要方向。有报道帕唑帕尼治疗在有KDR基因突变的转移性血管肉瘤及基底细胞癌中显示了良好的疗效[7-8],另外瑞戈非尼的临床研究也显示对其KDR R961W突变的晚期结直肠癌患者疗效更为显著。晚期ACC患者中VEFG表达水平显著升高,提示对于存在KDR基因突变的患者抗VEGFR-2治疗可能有效。值得注意的是,索拉菲尼和舒尼替尼在以往的体外实验中已被证实具有抑制KDR活性的能力[9],因此考虑给予抗VEGFR-2靶向治疗。
甲磺酸阿帕替尼是新一代的小分子VEGFR-2酪氨酸激酶高效抑制剂,高度选择性竞争细胞内VEGFR-2的ATP结合位点,阻断下游信号转导,抑制肿瘤组织新血管生成。其对VEGFR-2的IC50(nmol/L)是舒尼替尼的1/5,索拉菲尼的1/45[10]。2014年11月获得CFDA批准作为1.1类新药上市,目前主要用于国人晚期胃癌三线及三线以上治疗,显示了一定疗效并且安全性良好。该药在非小细胞肺癌、结直肠癌、食管癌等常见肿瘤中的临床研究也正在进行。
3 总结该例患者为无功能性ACC,以腹部巨大包块就诊,无明显临床症状,初次手术后1年左右出现复发转移,传统的细胞毒治疗无效。高通量二代测序提示存在KDR基因突变,给予甲磺酸阿帕替尼500 mg qd治疗后效果显著,疾病部分缓解并且目前仍处于持续缓解状态。提示对于晚期ACC患者尤其是存在KDR基因突变者,抗VEGFR-2治疗可能是一种新的选择。虽然目前阿帕替尼治疗晚期KDR突变型ACC没有明确的临床相关性,但我们通过成功治疗这例KDR基因突变(11号外显子Q472H突变)的患者,显示了高通量二代测序技术在临床罕见肿瘤中应用具有巨大价值,通过识别一些潜在的可治疗靶点,采取异病同治的策略,为晚期ACC甚或其他罕见肿瘤的诊治提供了新的思路和治疗方案。
| [1] | Kerkhofs TM, Kerstens MN, Kema IP, et al. Diagnostic Value of Urinary Steroid Profiling in the Evaluation of Adrenal Tumors[J]. Horm Cancer, 2015, 6(4): 168–75. DOI:10.1007/s12672-015-0224-3 |
| [2] | Else T, Williams AR, Sabolch A, et al. Adjuvant therapies and patient and tumor characteristics associated with survival of adult patients with adrenocortical carcinoma[J]. J Clin Endocrinol Metab, 2014, 99(2): 455–61. DOI:10.1210/jc.2013-2856 |
| [3] | Xu YZ, Zhu Y, Shen ZJ, et al. Significance of heparanase-1 and vascular endothelial growth factor in adrenocortical carcinoma angiogenesis: potential for therapy[J]. Endocrine, 2011, 40(3): 445–51. DOI:10.1007/s12020-011-9502-1 |
| [4] | Zini L, Porpiglia F, Fassnacht M. Contemporary management of adrenocortical carcinoma[J]. Eur Urol, 2011, 60(5): 1055–65. DOI:10.1016/j.eururo.2011.07.062 |
| [5] | Sperone P, Ferrero A, Daffara F, et al. Gemcitabine plus metronomic 5-fluorouracil or capecitabine as a second-/third-line chemotherapy in advanced adrenocortical carcinoma: a multicenter phase Ⅱ study[J]. Endocr Relat Cancer, 2010, 17(2): 445–53. DOI:10.1677/ERC-09-0281 |
| [6] | Urup T, Pawlak WZ, Petersen PM, et al. Treatment with docetaxel and cisplatin in advanced adrenocortical carcinoma, a phase Ⅱstudy[J]. Br J Cancer, 2013, 108(10): 1994–7. DOI:10.1038/bjc.2013.229 |
| [7] | Zhrebker L, Cherni I, Gross LM, et al. Case report: whole exome sequencing of primary cardiac angiosarcoma highlights potential for targeted therapies[J]. BMC Cancer, 2017, 17(1): 17. DOI:10.1186/s12885-016-3000-z |
| [8] | Akbulut H, Altuntas F, Akbulut KG, et al. Prognostic role of serum vascular endothelial growth factor, basic fibroblast growth factor and nitric oxide in patients with colorectal carcinoma[J]. Cytokine, 2002, 20(4): 184–90. DOI:10.1006/cyto.2002.1993 |
| [9] | Herbst RS. Dose-comparative monotherapy trials of ZD1839 in previously treated non-small cell lung cancer patients[J]. Semin Oncol, 2003, 30(1 Suppl): 30–8. |
| [10] | Li J, Zhao X, Chen L, et al. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10: 529. DOI:10.1186/1471-2407-10-529 |
 2019, Vol. 46
2019, Vol. 46