文章信息
- 抑制FoxM1基因表达对甲状腺乳头状癌TPC-1细胞糖酵解途径的影响
- Effect of Inhibiting FoxM1 Gene Expression on Glycolytic Pathway in Thyroid Papillary Carcinoma TPC-1 Cells
- 肿瘤防治研究, 2019, 46(4): 289-293
- Cancer Research on Prevention and Treatment, 2019, 46(4): 289-293
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0081
- 收稿日期: 2018-06-19
- 修回日期: 2019-02-20
2. 200040 上海,复旦大学附属华山医院普外科
2. Department of General Surgery, Affiliated Huashan Hospital, Fudan University, Shanghai 200040, China
近年来,全球范围内甲状腺癌发病率逐年增高。研究显示:2013年中国甲状腺癌新增发病人数为33 939例,与1990年相比增加了21 898例,标准化发病率由1.25/10万升至2.07/10万,增加65.6%,而其中80%~90%为甲状腺乳头状癌。与其他恶性肿瘤相比,甲状腺癌术后预后相对较好,但是手术根治性切除后仍有20%~30%的患者出现远期复发,且在复发的病例中还有部分病例出现远处转移[1]。然而关于甲状腺乳头状癌的侵袭转移机制目前并不明了。FoxM1基因是Forkhead-box(FOX)家族的一员,参与调控细胞增殖分化,近年来研究发现胰腺癌、卵巢癌、甲状腺癌等恶性肿瘤细胞中FoxM1基因出现高度表达。沃伯格效应(Warburg effect)被认为是肿瘤细胞的一个显著特征,即与正常细胞相比,肿瘤细胞摄取并消耗大量的葡萄糖,即使在氧气充足的条件下,糖酵解率和乳酸产量也会大大增加[2-5]。诸多研究发现,在多种恶性肿瘤中,FoxM1基因表达与肿瘤细胞糖酵解密切相关。因此在本实验中,通过研究抑制FoxM1基因对甲状腺癌细胞糖酵解的影响,探讨其在甲状腺癌发生发展过程中的作用机制。
1 材料与方法 1.1 实验试剂小量质粒抽提试剂盒和Trans2K PlusⅡDNA Marker购自北京全式金生物公司; 琼脂糖凝胶回收试剂盒购自美国Omega公司; DNA引物合成、DNA测序、DMEM培养基、胎牛血清FBS和胰蛋白酶Trypsin 0.25%EDTA购自美国Invitrogen公司; HET kit和JM109感受态购自深圳百恩维生物科技有限公司; 限制性内切酶XhoⅠ、限制性内切酶EcoRⅠ、限制性内切酶BamHⅠ和T4 DNA Ligase购自美国NEB公司; Qiagen大规模质粒抽提试剂盒购自德国Qiagen公司; TPC-1细胞购自中科院上海细胞所; Beta-Actin抗体购自上海碧云天生物技术公司; 兔抗小鼠FoxM1抗体购自美国Sigma公司; 兔抗小鼠Glut1抗体、兔抗小鼠HK1抗体和兔抗小鼠HK2抗体购自英国Abcam公司。
1.2 pLVX-shRNA2-Puro-hFoxM1载体构建、干扰效率筛选及慢病毒包装设计shRNA,在3’端引入XhoⅠ酶切位点,合成shRNA片段。载体pLVX-shRNA2-puro用限制性内切酶EcoRⅠ+BamHⅠ双酶切,将回收大片段与shRNA-hFoxM1的稀释退火产物连接,然后用连接产物转化100 μl JM109感受态细胞。抽提质粒,挑取酶切鉴定正确的阳性菌测序。将筛选后干扰效率最佳的重组质粒pLVX-shRNA2-puro-hFoxM1-1导入293T细胞,产生高滴度含目的基因的慢病毒(简称慢病毒rLv-hFoxM1)。
1.3 慢病毒rLv-hFoxM1转染TPC-1细胞后检测FoxM1基因mRNA的表达 1.3.1 总RNA的提取用rLv-hFoxM1(MOI=5)处理TPC-1细胞,并设定TPC-1细胞作为对照。置于37℃,5%CO2培养箱培养。使用TRIzol提取总RNA,检测所得RNA的纯度和完整性,-80℃超低温冰箱保存备用。
1.3.2 cDNA模板的合成将Oligo(dT)12~18(500 μg/ml)、总RNA、dNTP混合物在65℃加热5 min,迅速置于冰上冷却。短暂离心后,加入以下组分:5×第一链合成缓冲液、0.1 mol/L DTT。然后在37℃下孵育2 min。在室温下加入1 μl(200单位)M-MLV反转录酶,轻轻地吹打混匀。在70℃加热15 min以终止反应。cDNA产物直接作为qPCR的模板。
1.3.3 qPCR检测分别设计内参beta-actin和目的基因hFoxM1扩增引物。(1.3.1~1.3.3具体方法见参考文献[6]。)
1.4 慢病毒rLv-hFoxM1转染TPC-1细胞后检测FoxM1蛋白的表达将慢病毒rLv-hFoxM1(滴度为1.0×108 TU/ml)转染TPC-1细胞,命名为TPC-1-shRNA-hFoxM1组,将未转染慢病毒的TPC-1细胞作为对照,命名为TPC-1-control组,感染72 h后观察细胞形态变化并换成正常培养基,加入终浓度为10 μg/ml(经梯度实验确定)嘌呤霉素进行抗生素筛选。每隔2~3 d换1次终浓度为10 μg/ml的嘌呤霉素新鲜培养基。待对照细胞完全死亡后,扩增存活细胞,继续培养。取部分细胞裂解提取蛋白,聚丙烯酰胺凝胶电泳、转膜、封闭后加一抗4℃摇床孵育过夜,再加标有荧光标记的二抗室温摇床孵育1 h,应用奥德赛双色红外激光成像系统检测hFoxM1蛋白的表达。以β-actin为内参使用Western blot检测hFoxM1蛋白表达水平。
1.5 MTT比色法检测细胞活性噻唑蓝(MTT)比色法显色深浅随孔板中活细胞数增加而逐渐加深,其吸光值亦随之升高。将对照组TPC-1细胞及慢病毒rLv-hFoxM1转染的TPC-1细胞消化,收集细胞,调整细胞密度至2×104/ml,以每孔200 μl接种于96孔培养板中,设两组(TPC-1-control组和TPC-1-shRNA-hFoxM1组),每组7个复孔。待细胞贴壁后换用无血清的培养基继续培养24 h,使细胞同步化。于同步化之后24、48、72、96、120 h分别用MTT法测定细胞吸光度值(OD值)。
1.6 乳酸生产和葡萄糖利用分析将TPC-1细胞(1×106)进行慢病毒rLv-hFoxM1转染,将已转染的TPC-1细胞放入培养基,孵育24 h,然后用无酚红的无血清细胞冻存培养基(RPMI)+1%FBS+20 mmol/L草氨酸钠代替培养基,持续孵育3天。每天收集标本,用比色测定葡萄糖试剂盒(BioVision)测定培养基中葡萄糖的浓度(生物视觉),并根据原始总量进行间接定量计算出葡萄糖消耗量,最后根据细胞数量进行标准化。同样根据乳酸测定试剂盒的说明书(Sigma)进行操作,测定乳酸产量。
1.7 糖酵解途径关键酶测定取对数期细胞接种于6孔板中,待细胞贴壁铺满后进行干预处理,分别提取TPC-1-control组和TPC-1-shRNA-hFoxM1组总蛋白,用BCA法测定蛋白总浓度后,用Western blot法测定糖酵解途径关键酶己糖激酶1(hexokinase isoform 1, HK1)、己糖激酶2 (hexokinase isoform 2, HK2)及葡萄糖转运体蛋白1(glucose transporter 1, Glut1)含量变化。
1.8 统计学方法采用GraphPad Prism 5.0统计学软件对数据进行分析。用One-way ANOVA检验比较两组细胞中FoxM1基因及蛋白水平的表达差异。以P < 0.05为差异有统计学意义。
2 结果 2.1 pLVX-shRNA2-puro-hFoxM1-1慢病毒包装将筛选后干扰效率最佳的重组质粒pLVX-shRNA2-puro-hFoxM1-1导入293T细胞,产生了高滴度含目的基因的慢病毒(简称慢病毒rLv-hFoxM1),测定rLV-hFoxM1滴度为:1.0×108 TU/ml。
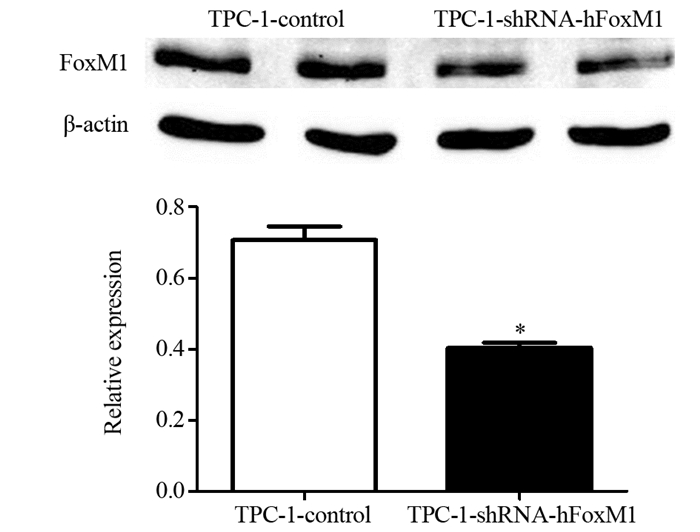
2.2 慢病毒rLv-hFoxM1转染TPC-1细胞后检测FoxM1蛋白表达Western blot检测结果显示,相比TPC-1-control组,TPC-1-shRNA-hFoxM1组中,FoxM1蛋白的表达水平明显降低,见图 1。
|
| *: P=0.041, compared with TPC-1-control group 图 1 慢病毒rLv-hFoxM1干扰的TPC-1细胞中FoxM1蛋白的表达 Figure 1 FoxM1 expression in TPC-1 cells after rLv-hFoxM1 transfection |
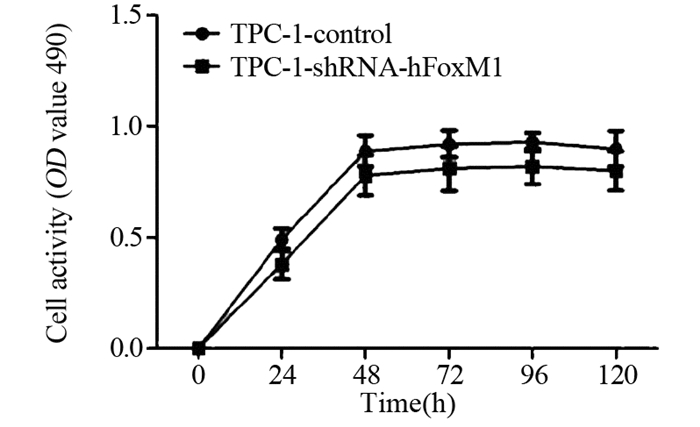
用MTT法测定细胞OD值,结果显示,同步化之后24、48、72、96、120 h,与同一时间点对照组(TPC-1-control)相比,慢病毒rLv-hFoxM1干扰的TPC-1细胞(TPC-1-shRNA-hFoxM1组)OD值显著降低(P=0.036),表明降低FoxM1基因表达可抑制TPC-1细胞的活性,见图 2。
|
| 图 2 MTT法检测降低FoxM1基因表达对TPC-1细胞活性的影响 Figure 2 Effect of decreased FoxM1 gene expression on TPC-1 cell activity detected by MTT |
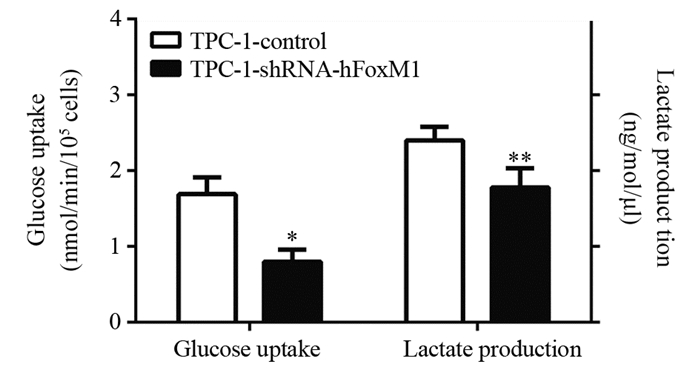
将TPC-1细胞(1×106)进行慢病毒rLv-hFoxM1转染,测定培养基中葡萄糖的浓度及乳酸产量,发现抑制FoxM1基因后,其葡萄糖摄取降低,且同时乳酸生成也相应减少,见图 3。
|
| *: P=0.026, **: P=0.034, compared with TPC-1-control group 图 3 抑制FoxM1基因后对葡萄糖摄取及乳酸生成的影响 Figure 3 Effect of decreased FoxM1 gene expression on glucose uptake and lactic acid production |
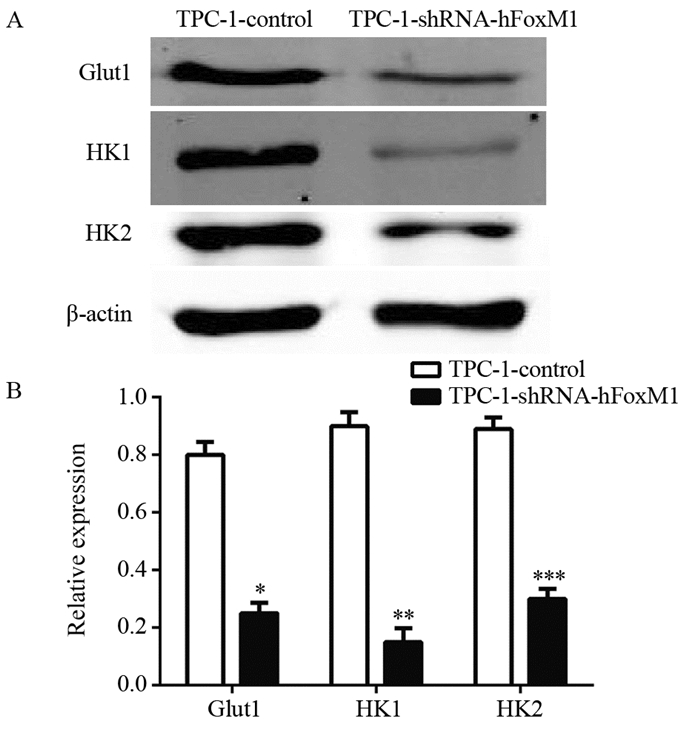
提取TPC1-control组和TPC-1-shRNA-hFoxM1组细胞总蛋白,BCA法测定蛋白总浓度后,用Western blot法测定葡萄糖转运蛋白(Glut1)及糖酵解途径关键酶,发现抑制FoxM1基因后,其葡萄糖转运蛋白(Glut1)、己糖激酶1(HK1)和己糖激酶(HK2)含量明显降低,表明糖酵解途径受到抑制,见图 4。
|
| *: P=0.006, **: P=0.005, ***: P=0.008, compared with TPC-1-control group 图 4 抑制FoxM1基因后葡萄糖转运蛋白及糖酵解途径关键酶的测定 Figure 4 Determination of glucose transporter and key enzymes of glycolysis pathway after inhibition of FoxM1 gene expression |
目前对于调控甲状腺乳头状癌的关键分子研究一直是本领域热点,对于预防治疗术后转移有着较高的转化意义。大量研究证实FoxM1参与肿瘤细胞的增殖、血管生成、侵袭和转移,FoxM1表达增加与肿瘤患者的临床分型差、预后差有显著相关性[7-10]。FoxM1基因在甲状腺癌中的作用研究较少,Ahmed等研究发现中东地区甲状腺乳头状癌患者中FoxM1基因高度表达,表明FoxM1异常表达与甲状腺乳头状癌的发生有关,且在高侵袭性的甲状腺乳头状癌中比其他类型的甲状腺乳头状癌更加明显,这提示FoxM1基因参与肿瘤的侵袭转移[11-12]。我们的前期研究也发现,在甲状腺乳头状癌细胞系TPC-1中,用hFoxM1-RNA干扰FoxM1基因表达后,TPC-1细胞的侵袭、迁移能力明显下降,说明FoxM1基因与甲状腺癌的侵袭转移有关[13]。
另一方面,FoxM1基因参与调控甲状腺癌的侵袭转移的具体机制并不清楚。肿瘤细胞需要大量的葡萄糖来满足能量的需要,肿瘤细胞中大部分葡萄糖通过糖酵解途径代谢,Lynch等提出代谢途径的改变可促进肿瘤发生发展[14-15]。Warburg教授团队首次发现在氧气充足的条件下,恶性肿瘤细胞主要采用无氧糖酵解途径方式提供生命活动所需的能量,而不是以生成能量更多的三羧酸循环途径,这种异常的能量产生利用方式被称为沃伯格效应[2],这代谢方式的改变被认为是恶性肿瘤的重要特征之一[3-5]。最新研究显示,在多种恶性肿瘤中,糖酵解水平与肿瘤细胞的侵袭转移能力存在密切关系。胰腺癌中原发灶及不同部位的转移灶中,糖酵解代谢相关的基因水平均有不同程度的升高,并且在转移灶升高更为明显[16-19]。同样,甲状腺乳头状癌细胞系BCPAP和TPC1中发现乳酸水平明显增强,且临床研究中发现甲状腺癌发生转移的患者其乳酸水平更进一步增强[20-21]。
有研究发现FoxM1基因通过调控糖酵解途径参与肿瘤的增殖分化以及转移。FoxM1可以使肿瘤细胞在低氧环境下存活,降低FoxM1表达将使缺氧的肿瘤细胞增殖能力受损[22]。在间充质干细胞中,ERK/FoxM1通路的激活可以防止高糖诱导的干细胞衰老,也证明了FoxM1可以调控细胞的糖代谢[23]。最近的研究表明在原发性肝细胞癌中,FoxM1通过增强高表达葡萄糖转运体-1(GLUT1)来增强糖酵解途径[24]; 在上皮性卵巢癌中发现肿瘤组织中GLUT1和己糖激酶(HK)高度表达,与FoxM1基因上调具有高度相关性,提示FoxM1基因很有可能参与调控糖酵解途径[25]。在胰腺癌中也发现FoxM1基因通过增强乳酸脱氢酶的表达来增强沃伯格效应[26]。以上研究均表明FoxM1基因与糖酵解途径存在密切联系。在本研究中,使用甲状腺乳头状癌TPC1细胞系,抑制其FoxM1基因表达后细胞的葡萄糖摄取明显降低,且同时发现乳酸生成也相应减少,这表明了FoxM1基因很可能参与糖酵解途径的调控,但具体调控机制不明。因此我们继续抑制FoxM1基因表达,发现其葡萄糖转运蛋白含量下降,同时糖酵解关键酶己糖激酶1(HK1)和己糖激酶(HK2)含量也明显降低,这充分说明FoxM1参与了甲状腺癌TPC1糖酵解途径。
综上,FoxM1基因与甲状腺癌的增殖分化以及侵袭转移密切相关,而且很有可能通过糖酵解途径来实现。但FoxM1基因如何通过糖酵解途径来调控肿瘤的侵袭转移还需进一步的研究,这一研究也将是对甲状腺癌侵袭转移机制的一个补充。
作者贡献
袁浩:实验实施及论文撰写
李永平、蒋晓飞:数据收集、统计分析及论文修改
徐卫燕:实验实施
陈进宏、闵志均:实验指导
| [1] | 丛舒, 方利文, 包鹤龄, 等. 1990年与2013年中国人群甲状腺癌疾病负担分析[J]. 中华流行病学杂志, 2016, 37(6): 773–7. [ Cong S, Fang LW, Bao HL, et al. Disease burden of thyroid cancer in the Chinese population, in 1990 and 2013[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2016, 37(6): 773–7. DOI:10.3760/cma.j.issn.0254-6450.2016.06.006 ] |
| [2] | Koppenol WH, Bounds PL, Dang CV. Otto Warburg' s contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer, 2011, 11(5): 325–37. DOI:10.1038/nrc3038 |
| [3] | Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation[J]. Science, 2009, 324(5930): 1029–33. DOI:10.1126/science.1160809 |
| [4] | Ying H, Kimmelman AC, Lyssiotis CA, et al. Oncogenic Kras maintains pancreatic tumorsthrough regulation of anabolic glucose metabolism[J]. Cell, 2012, 149(3): 656–70. DOI:10.1016/j.cell.2012.01.058 |
| [5] | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646–74. DOI:10.1016/j.cell.2011.02.013 |
| [6] | 袁浩, 闵志均, 陈进宏, 等. 甲状腺乳头状癌TPC-1细胞中FoxM1的表达对Ras及CDK1的影响[J]. 中国普外基础与临床杂志, 2016, 23(2): 172–6. [ Yuan H, Min ZJ, Chen JH, et al. Influence of FoxM1 expression on Ras and CDK1 expressions in thyroid papillary carcinoma TPC-1 cells[J]. Zhongguo Pu Wai Ji Chu Yu Lin Chuang Za Zhi, 2016, 23(2): 172–6. ] |
| [7] | Millour J, Constantinidou D, Stavropoulou AV, et al. FOXM1 is a transcriptional target of ERalpha and has a critical role in breast cancer endocrine sensitivity and resistance[J]. Oncogene, 2010, 29(20): 2983–95. DOI:10.1038/onc.2010.47 |
| [8] | Madureira PA, Varshochi R, Constantinidou D, et al. The Forkhead box M1 protein regulates the transcription of the estrogen receptor alpha in breast cancer cells[J]. J Biol Chem, 2006, 281(35): 25167–76. DOI:10.1074/jbc.M603906200 |
| [9] | Li Q, Zhang N, Jia Z, et al. Critical role and regulation of transcription factor FoxM1 in human gastric cancer angiogenesis and progression[J]. Cancer Res, 2009, 69(8): 3501–9. DOI:10.1158/0008-5472.CAN-08-3045 |
| [10] | Pandit B, Halasi M, Gartel AL. p53 negatively regulates expression of FoxM1[J]. Cell Cycle, 2009, 8(20): 3425–7. DOI:10.4161/cc.8.20.9628 |
| [11] | Ahmed M, Uddin S, Hussain AR, et al. FoxM1 and its association with matrix metalloproteinases (MMP) signaling pathway in papillary thyroid carcinoma[J]. J Clin Endocrinol Metab, 2012, 97(1): E1–E13. DOI:10.1210/jc.2011-1506 |
| [12] | Bellelli R, Castellone MD, Garcia-Rostan G, et al. FOXM1 is a molecular determinant of the mitogenic and invasive phenotype of anaplastic thyroid carcinoma[J]. Endocr Relat Cancer, 2012, 19(5): 695–710. DOI:10.1530/ERC-12-0031 |
| [13] | 袁浩, 闵志均, 陈进宏, 等. FoxMl基因表达与甲状腺乳头状癌TPC-1细胞活性及侵袭性关系的研究[J]. 中华内分泌外科杂志, 2014, 8(1): 33–7. [ Yuan H, Min ZJ, Chen JH, et al. Correlation of FoxM1 with the activity and invasiveness ofpapillary thyroid carcinoma cell TPC-1[J]. Zhonghua Nei Fen Mi Wai Ke Za Zhi, 2014, 8(1): 33–7. DOI:10.3760/cma.j.issn.1674-6090.2014.01.012 ] |
| [14] | Lynch TP, Ferrer CM, Jackson SR, et al. Critical role of OLinkedβ-N-acetylglucosamine transferase in prostate cancer invasion, angiogenesis, and metastasis[J]. J Biol Chem, 2012, 287(14): 11070–81. DOI:10.1074/jbc.M111.302547 |
| [15] | Xia LM, Huang WJ, Wang B, et al. Transcriptional up- regulation of FoxM1 in response to hypoxia is mediated by HIF-1[J]. J Cell Biochem, 2009, 106(2): 247–56. DOI:10.1002/jcb.v106:2 |
| [16] | Brizel DM, Schroeder T, Scher RL, et al. Elevated tumor lactate concentrations predict for an increased risk of metastases in head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2001, 51(2): 349–53. DOI:10.1016/S0360-3016(01)01630-3 |
| [17] | Walenta S, Wetterling M, Lehrke M, et al. High lactate levels predict likelihood of metastases, tumor recurrence, and restricted patient survival in human cervical cancers[J]. Cancer Res, 2000, 60(4): 916–21. |
| [18] | Martinez-Outschoorn UE, Prisco M, Ertel A, et al. Ketones and lactate increase cancer cell "stemness, " driving recurrence, metastasis and poor clinical outcome in breast cancer: achieving personalized medicine via Metabolo-Genomics[J]. Cell Cycle, 2011, 10(8): 1271–86. DOI:10.4161/cc.10.8.15330 |
| [19] | Chaika NV, Yu F, Purohit V, et al. Differential expression of metabolic genes in tumor and stromal components of primary and metastatic loci in pancreatic adenocarcinoma[J]. PLoS One, 2012, 7(3): e32996. DOI:10.1371/journal.pone.0032996 |
| [20] | Coelho RG, Cazarin JM, Cavalcanti de Albuquerque JP, et al. Differential glycolytic profile and Warburg effect in papillary thyroid carcinoma cell lines[J]. Oncol Rep, 2016, 36(6): 3673–81. DOI:10.3892/or.2016.5142 |
| [21] | Kim BH, Kim SJ, Kim K, et al. High metabolic tumor volume and total lesion glycolysis are associated with lateral lymph node metastasis in patients with incidentally detected thyroid carcinoma[J]. Ann Nucl Med, 2015, 29(8): 721–9. DOI:10.1007/s12149-015-0994-2 |
| [22] | Park HJ, Carr JR, Wang Z, et al. FoxM1, a critical regulator of oxidative stress during oncogenesis[J]. EMBO J, 2009, 28(19): 2908–18. DOI:10.1038/emboj.2009.239 |
| [23] | Xu J, Huang Z, Lin L, et al. miRNA-130b is required for the ERK/FOXM1 pathway activation-mediated protective effects of isosorbide dinitrate against mesenchymal stem cell senescence induced by high glucose[J]. Int J Mol Med, 2015, 35(1): 59–71. DOI:10.3892/ijmm.2014.1985 |
| [24] | Shang R, Pu M, Li Y, et al. FOXM1 regulates glycolysis in hepatocellular carcinoma by transactivating glucose transporter 1 expression[J]. Oncol Rep, 2017, 37(4): 2261–9. DOI:10.3892/or.2017.5472 |
| [25] | Wang Y, Yun Y, Wu B, et al. FOXM1 promotes reprogramming of glucose metabolism in epithelial ovarian cancer cells via activation of GLUT1 and HK2 transcription[J]. Oncotarget, 2016, 7(30): 47985–97. |
| [26] | Cui J, Shi M, Xie D, et al. FOXM1 promotes the warburg effect and pancreatic cancer progression via transactivation of LDHA expression[J]. Clin Cancer Res, 2014, 20(10): 2595–606. DOI:10.1158/1078-0432.CCR-13-2407 |
 2019, Vol. 46
2019, Vol. 46


