文章信息
- 抗肿瘤治疗所致心脏疾病的研究进展
- Progress in Anticancer Therapy-related Cardiac Diseases
- 肿瘤防治研究, 2018, 45(11): 831-836
- Cancer Research on Prevention and Treatment, 2018, 45(11): 831-836
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0993
- 收稿日期: 2018-07-20
- 修回日期: 2018-10-09
随着肿瘤学领域诊疗水平的不断提高,肿瘤所致患者死亡率随之下降,抗肿瘤治疗中导致的其他器官功能损伤,尤其是心脏损伤成为影响患者生存的一个主要因素[1]。手术、放疗、内科治疗(化疗、靶向治疗、免疫治疗)等综合治疗仍是现代肿瘤治疗的趋势,常规全身化疗、靶向治疗及胸部放疗可增加心脏损伤的风险,其发生与多种因素相关[2-3],如药物种类、剂量、周期数、累积剂量、给药方案和途径、与有心脏毒性药物联合应用,合并放疗、基础心血管疾病史及纵隔放疗史等。为了更好地认识抗肿瘤治疗所致心脏疾病,本文综述了目前抗肿瘤治疗所致心脏疾病的相关研究,用以指导临床实践。
1 抗肿瘤治疗所致心脏疾病发病机制 1.1 药物相关性心脏损伤药物全身化疗在恶性肿瘤综合治疗中得到广泛应用,对控制病情发展、延长生存期有重要作用,但化疗药物对机体也会产生毒性。心肌细胞再生能力有限,受损后可出现近期和远期不良反应,影响患者生活质量、预后,严重者威胁其生命,已被越来越多的肿瘤科、心血管专科医师所重视。根据药物所致心脏损伤是否可逆,分为不可逆心脏损伤和可逆心脏损伤。
蒽环类及其衍生物、抗代谢类、抗微管类、烷化剂、铂类等传统细胞毒药物可随累积剂量的增加,对心脏造成不可逆损伤,具体发病机制尚不明确,目前研究显示蒽环类药物可通过抑制线粒体和肌质网酶活性产生心肌毒性,使其出现坏死或凋亡,导致心功能不全[4]。使用此类药物抗肿瘤治疗出现心脏毒性的危险因素[5-6]主要包括:药物累积剂量、女性、年龄(> 65岁或 < 18岁)、肾功能不全、联合或存在心脏照射治疗、药物联合治疗(烷化剂、抗微管类、生物制剂)及治疗前合并心脏疾病。
生物制剂如免疫和靶向治疗药物同样潜在心脏毒性,但与细胞毒药物不同,生物制剂所致心脏毒性多为可逆损伤,多数可在及时干预(如停药、加用心脏保护药物、调整抗肿瘤方案等)后部分或完全缓解[7]。使用人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)抑制剂可能出现潜在心脏可逆性损伤,是因为改变了心肌收缩蛋白和线粒体的结构和功能,较少引起心肌细胞死亡[8]。血管内皮生长因子(vascular endothelial growth factor, VEGF)抑制剂可通过内皮损伤、血管收缩及重构、炎性反应等机制增加高血压、心力衰竭等疾病发生风险[9]。具体药物及风险因素[10-11]详见表 1。

|
据统计,约50%的恶性肿瘤患者需要接受放射治疗[12]。放射线在作用于肿瘤组织同时,不可避免的会对放射野内及周围正常组织造成损伤,心脏经照射后可出现弥漫性心肌或心包纤维化、心包炎、冠状动脉及瓣膜疾病,称为放疗相关性心脏病(radiation-related heart disease, RRHD)。RRHD发病机制至今尚不完全明确,可能与炎性反应迁延所致心肌及血管壁纤维化、内皮损伤致微循环障碍、动脉粥样硬化及血栓形成等多种因素综合作用相关[13-14]。放疗相关性心脏病的潜在危险因素有:年轻时接受放疗、大分割(提高每次放疗剂量同时减少次数的放疗)或高剂量放疗(每次放疗剂量高于常规20 cGy的放疗)、心脏受照射的体积大、合并应用心脏毒性药物、合并吸烟、内分泌紊乱、肥胖、动脉粥样硬化和遗传等危险因素,其中心脏的照射剂量、照射体积和放疗技术是直接的相关因素[15-16]。
2 抗肿瘤治疗所致心脏疾病发病情况 2.1 细胞毒化疗药物相关心脏疾病阿霉素(多柔比星)是最早进入临床应用的蒽环类抗肿瘤药物,其心脏毒性反应程度与累积剂量有关[17]。阿霉素使用剂量为500~550 mg/m2时,心脏毒性发生率为7%~26%,剂量超过550 mg/m2时,心脏毒性发生率明显增加,主要表现为左室功能障碍、心衰。表阿霉素(表柔比星)累积剂量超过900 mg/m2时,心衰发病率最高为11.4%,因此其最大治疗量多推荐为900 mg/m2。柔红霉素累积剂量 > 90 mg/m2时心衰发病率为5%~18%,表明剂量越大心衰发病率就越高。
手足综合征作为氟尿嘧啶类药物的常见不良反应,被临床医师重视,其心脏毒性则常被忽视。为评估中国肿瘤患者使用氟尿嘧啶类药物治疗时心脏不良事件的发生率及其风险因素,陈功教授[18]牵头在中国人群中开展了一项源于氟尿嘧啶类药物心脏不良事件的前瞻性观察研究。结果显示,国人应用氟尿嘧啶类药物化疗后心脏毒性事件总发生率为30.6%,口服剂型卡培他滨片组患者心脏毒性事件发生率明显高于注射用5-Fu组(33.8% vs. 25%, P=0.0042),其中心律失常发生率为20.87%,缺血性改变发生率为19.92%,心衰3.8%,心肌梗死1.14%。对于治疗前合并心脏疾病的患者,应用氟尿嘧啶类药物化疗、维持治疗是出现心脏毒性的高危因素。该研究提示肿瘤医师应用氟尿嘧啶类药物的同时,应重视可能出现的心脏毒性,尤其对高危患者要密切监测。
抗微管化疗药物中,多西紫杉醇导致心衰的发生率约为2.3%~8%[19],紫杉醇相对较低,但可导致心肌缺血、心肌梗死,一项研究显示紫杉醇治疗患者中约5%出现了心肌缺血症状[20], 主要心脏毒性反应(76%)是窦性心动过缓。随访50例紫杉醇治疗后患者近30月后发现,其平均心脏射血分数(EF)为48%,低于平均值60%,其中20%患者出现1~2级心脏毒性反应[21],表明此类药物应用后也需密切监测其可能出现的心脏毒性反应。烷化剂药物如环磷酰胺、氮芥、甲烷磺酸酯类、亚硝脲类等,同样潜在心脏毒性。接受环磷酰胺化疗的患者会出现左心功能衰竭、心包炎或心肌炎。
2.2 分子靶向治疗相关心脏疾病曲妥珠单抗主要用于HER2过表达的乳腺癌患者,是目前报道的分子靶向药物中心脏毒性较大的药物。一项曲妥珠单抗联合细胞毒药物(阿霉素联合环磷酰胺方案)治疗HER2过表达的晚期乳腺癌的研究中,27%的患者出现心功能不全[22]。其他乳腺癌相关研究中,曲妥珠单抗治疗后,有症状的心力衰竭发生率为2%~4%,心功能不全的发生率为3%~19%[23-24]。一项纳入58个研究、近29 000名女性乳腺癌患者的荟萃分析[25]显示,曲妥珠单抗治疗合并心脏毒性的发病率随药物使用时间的延长而呈上升趋势;且在联合紫杉醇类、蒽环类药物化疗组、高龄组、合并代谢性基础疾病患者组发病率较高。
贝伐珠单抗是一种抗VEGF重组单克隆抗体,因可阻断其配体与受体结合抑制肿瘤血管生成,被广泛应用于治疗转移性结直肠癌、肺癌、肾癌等恶性肿瘤。值得注意的是,本药品处方信息中明确标明,其心血管不良事件(心肌梗死、心绞痛等)的发生率为4.4%。Chen等[9]对4 617例患者的荟萃分析显示,使用高剂量贝伐珠单抗治疗组(5 mg/(kg.w))心肌缺血发生风险高于低剂量组(2.5 mg/(kg.w)),相对风险为2.14 vs. 4.81。
IPASS试验[26]结果开启了非小细胞肺癌领域分子靶向治疗时代,以吉非替尼为代表的表皮生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)使携带敏感突变基因的肺腺癌患者生存期得到延长。此后,针对不同肿瘤的分子靶向治疗药物也层出不穷。舒尼替尼是一种口服小分子多靶点TKI,具有抑制肿瘤血管生成和抗肿瘤生长的多重作用,常用于治疗肾癌和胃肠间质瘤。在胃肠间质瘤患者Ⅰ/Ⅱ期的研究表明,心血管不良事件的发生率约为11%,充血性心力衰竭发生率为8%,28%患者出现左室射血分数减低至10%,19%患者左室射血分数减低超过15%。舒尼替尼还可导致血压升高,其中47%患者出现2级以上高血压(> 150/100 mmHg)[27],其治疗所致全级别或3级以上高血压的发生率分别为23.4%和5.7%。近期报道的应用安罗替尼作为3线方案治疗非小细胞肺癌临床试验研究中,约一半患者出现高血压(55%),3~4级高血压发生率为10%[28]。
2.3 免疫治疗相关心脏疾病近几年,免疫药物在全球抗肿瘤治疗如火如荼的开展,取得了令人瞩目的研究成果,同时其产生的不良反应尤其是心脏毒性也引起了研究者的关注。在黑色素瘤免疫治疗研究中,心肌纤维化、左室心功能不全、应激性心肌病、迟发性免疫相关性心肌炎、心脏传导阻滞等心脏毒性均曾被报道[29-30]。对既往接受免疫治疗的20 594例患者研究数据统计发现[31],药物相关心肌炎发生率为0.09%,此外,纳武单抗和伊匹单抗联合应用时心肌炎发生率较单用前者频繁(0.27% vs. 0.06%)。
2016年欧洲心脏病协会总结了常见抗肿瘤药物出现左心室功能障碍的发生率[2, 32-33],见表 2,临床医生应密切关注相关药物可能出现的心脏毒性,避免发生严重不良事件。
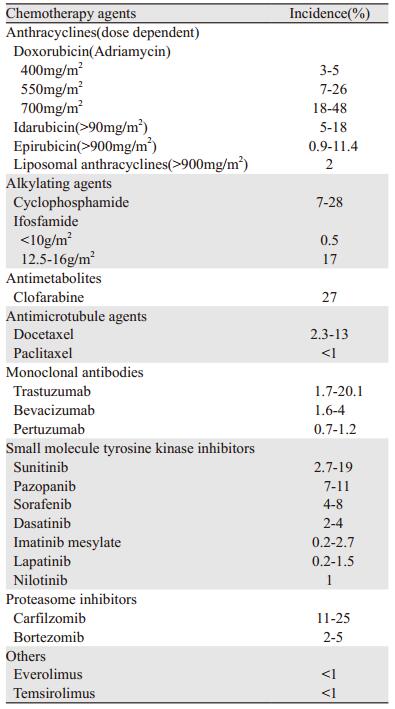
|
放疗所致的心脏毒性反应属于晚期并发症,一般在放疗10~20年后出现,可表现为心肌病、心脏瓣膜病、心包疾病、传导异常和冠状动脉狭窄等。研究显示,放疗后发展为相关心脏毒性的平均时间长短不一,心肌病最长为510.5 d,心功能障碍最短为78 d。缺血性心肌病106 d,心力衰竭240 d,传导异常281 d[34-35]。胸部恶性肿瘤放疗10年后,心血管疾病成为癌症患者死亡的独立危险因素。
在合并心脏疾病的恶性肿瘤长期生存的患者中,有2%~5%的患者最终死于心脏损伤性疾病而非原发疾病,而心肌梗死则是这些患者的主要死亡原因[36]。心脏主要位于人体的胸腔左侧,与右侧乳腺癌相比,左侧乳腺癌放疗后的心脏损伤要大于右侧。瑞典的一项55 000例乳腺癌放疗后心脏毒性损伤报告[37]指出,在接受乳腺癌放疗后的10年时统计,左侧乳腺癌因心血管原因死亡的风险是右侧的1.10倍,其中缺血性心肌病发生率达1.13倍。
3 抗肿瘤治疗所致心脏毒性的生物标志物抗肿瘤药物直接或间接作用于心脏,可造成心肌细胞损伤和生化改变(包括酶诱导或抑制代谢通路改变)。心脏生物标志物是反映心脏电生理活动改变、结构或功能改变后可被测定的指标,包括蛋白类、酶类或者激素等。目前肌钙蛋白和脑钠肽是反映急性冠状综合征和心力衰竭的两个最重要的心脏生物标志物,也常用于监测抗肿瘤治疗中患者心脏功能。
肌钙蛋白(cardiac troponin, cTn)特别是肌钙蛋白I(cTnI)和肌钙蛋白T(cTnT)具有心肌特异性,正常人体血清中二者含量较低,心肌细胞受损破坏时,二者会快速释放入血,因其敏感度和特异性较好,在临床工作中广泛应用于诊断心肌受损。肌钙蛋白在化疗相关心血管疾病的应用已在动物模型中得到证实,在对蒽环类药物化疗患者研究中发现cTn升高早于左室射血分数的改变。Cardinale等[38]对204名接受大剂量蒽环类药物化疗患者均监测其TnI及左室射血分数水平,32%患者TnI升高(> 0.4 ng/ml),化疗结束后7月,TnI升高组左室射血分数下降发生率明显高于无升高组。对703例乳腺癌、淋巴瘤等患者进行20月随访发现[39],化疗后72 h内和化疗结束后1月内持续TnI升高(> 0.08 ng/ml),与短暂或无升高组相比,升高组心脏毒性发生率明显升高,主要表现为心源性猝死、急性肺水肿、心衰、无症状左室射血分数下降 > 25%及严重的心律失常。与蒽环类化疗药物相比,cTn在监测肿瘤靶向治疗心脏毒性方面的效果并不显著。在接受Ⅰ期试验的转移性实体肿瘤分子靶向治疗的90例患者中,11%患者TnI升高,但与临床心脏事件无关[40]。在放疗相关的心脏毒性方面,因临床研究样本量较小,随访时间短等原因,尚且不足以估计长期的临床结果。同时也缺少儿童肿瘤患者治疗方面相关数据分析,故cTn未被作为生化标志物监测肿瘤治疗心血管疾病的指标。
脑钠肽(brain natriuretic peptide, BNP),及N-末端氨基酸片段NT-proBNP,由心室释放,反映心室负荷、心肌顺应性,也常被应用于监测抗肿瘤治疗相关心脏毒性。已有研究证实,二者是比超声心动图更敏感的指标。De等[41]一项前瞻性研究提示NT-proBNP在化疗结束后的多个时间点明显升高,均发生在左室射血分数下降前。NT-proBNP升高对化疗后1年患者因心脏损伤导致的死亡率有预测价值[41],持续升高与左室收缩、舒张功能障碍的发生密切相关。对109例肉瘤、淋巴瘤等使用蒽环类药物化疗的患者在每周期化疗前后规律行BNP监测,结果显示,出现心脏事件(无症状左室功能障碍、心力衰竭、心律失常、急性冠状动脉综合征及心源性猝死)的患者中,BNP水平在蒽环类药物化疗前后均明显升高,继续随访中发现此类患者左室射血分数均较低[42]。胸部放射治疗的患者BNP升高,可能在左室射血分数下降前反映早期心脏毒性。左侧乳腺癌患者在放疗后6月的NT-proBNP水平显著高于无放疗组,增加剂量的心脏照射同样与BNP升高程度有相关性[43-44]。与cTn类似,BNP对靶向治疗患者心脏毒性监测效果尚不明确。一项对转移性肾细胞癌患者接受舒尼替尼治疗研究显示[45],左室功能障碍发生风险在第一个周期最高,左室射血分数出现下降,经过相应治疗可较前好转,但整个治疗过程中,平均BNP水平与基线无明显变化。BNP水平监测抗肿瘤治疗的心血管疾病仍需要更多的研究来证实。
除肌钙蛋白、脑钠肽外,以下生物标志物也有望成为抗肿瘤相关心血管疾病的潜在预测因子。
髓过氧物酶(myeloperoxidase, MPO)被认为是氧化应激的标志物,由中性粒细胞在炎症和氧化应激期间释放[46],而过量氧自由基的产生被认为是蒽环类药物心脏毒性发病机制的关键[47]。78例接受阿霉素和曲妥珠单抗治疗15月的乳腺癌患者中,早期MPO水平升高(3月内)与心脏毒性发生风险相关[46]。作者对这部分患者继续随访显示,3月后MPO升高仍对心脏毒性产生的风险有预测作用[48]。
MicroRNA是基因表达调控中起重要作用的非编码RNA分子,参与多种细胞表达,包括心血管系统。有研究提示microRNA可作为抗肿瘤治疗相关心脏疾病的监测标志物。阿霉素可上调大鼠模型新生心肌细胞miR-146a表达[49],33例蒽环类药物化疗后患儿的血浆中miR-26、miR-499升高与药物剂量、肌钙蛋白升高水平呈正相关[50]。但在阿霉素心脏毒性研究中,miR-208a结果令人失望[51]。尽管目前microRNA在评估抗肿瘤治疗心血管疾病方面的作用尚不明确,但其具有以下特点:存在于多种体液中,标本获取途径更容易;对温度和pH值要求不严格;半衰期长;可以使用不同的检测方法测定[52],故应继续开展更多的相关研究。
氧化应激影响机体免疫应答系统。与化疗前相比,持续接受蒽环类药物治疗的患者,其外周单个核细胞(peripheral blood mononuclear cells, PMBC)中的DNA碱基氧化明显增加[53],这种改变可被基因表达谱验证。Todorova等[54]对阿霉素心脏毒性的大鼠模型研究发现,PMBC基因表达谱与大鼠心肌组织非常相似,二者均可参与氧化应激反应,提示检测PMBC的改变可能反映心肌组织变化。后续在阿霉素化疗后出现心脏毒性的乳腺癌患者中观察到特异性的基因表达谱,在左室功能无变化的患者则不存在[55],提示检测PMBC可能对化疗后心脏毒性的监测有一定指导意义,但仍需更多的研究验证。
4 总结综上所述,随着肿瘤学治疗领域的不断进步,肿瘤患者生存期得到延长,抗肿瘤治疗相关心脏毒性事件发生率在增加,但具体发生机制仍不明确。基于现有循证医学证据,相关指南[56]对肿瘤治疗相关心脏毒性疾病提出了具体干预意见,主要为:遵循相应疾病的现行临床指南,用最小创伤的检查和治疗手段,最大限度地维持患者血流动力学稳定,提高或保护心脏功能,控制症状。治疗方面,指南推荐可应用血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体拮抗剂及β受体阻滞剂等可改善患者长期预后的药物;外科手术等有创治疗需谨慎选择。预防策略也要重视,抗肿瘤治疗前应详细询问患者既往心脏疾病病史,完善相关指标基线检查,必要时请心血管医师共同评估患者治疗中可能出现心脏毒性的发生率;制定抗肿瘤治疗药物或放疗方案时,降低药物性心脏毒性发生率,避免应用多种心脏毒性药物,调整放疗技术及加强照射保护;治疗前、中、后密切监测患者心功能相关指标,早发现,早干预治疗,避免对患者造成严重后果。
| [1] | Dent S, Liu P, Brezden-Masley C, et al. Cancer and cardiovascular disease: the complex labyrinth[J]. J Oncol, 2015, 2015: 516450. |
| [2] | Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with Doxorubicin:a retrospective analysis of three trials[J]. Cancer, 2003, 97(11): 2869–79. DOI:10.1002/(ISSN)1097-0142 |
| [3] | Singal PK, Iliskovic N. Doxornbicin-induced cardiomyopathy[J]. N Engl J Med, 1998, 339(13): 900–5. DOI:10.1056/NEJM199809243391307 |
| [4] | Geisberg CA, Sawyer DB. Mechanisms of anthracycline cardiotoxicity and strategies to decrease cardiac damage[J]. Curr Hypertens Rep, 2010, 12(6): 404–10. DOI:10.1007/s11906-010-0146-y |
| [5] | Herrmann J, Lerman A, Sandhu NP, et al. Evaluation and management of patients with heart disease and cancer: cardio-oncology[J]. Mayo Clin Proc, 2014, 89(9): 1287–306. DOI:10.1016/j.mayocp.2014.05.013 |
| [6] | Chow EJ, Chen Y, Kremer LC, et al. Individual prediction of heart failure among childhood cancer survivors[J]. J Clin Oncol, 2015, 33(5): 394–402. DOI:10.1200/JCO.2014.56.1373 |
| [7] | Suter TM, Ewer MS. Cancer drugs and the heart: importance and management[J]. Eur Heart J, 2013, 34(15): 1102–11. DOI:10.1093/eurheartj/ehs181 |
| [8] | Arai M, Tomaru K, Takizawa T, et al. Sarcoplasmic reticulum genes are selectively down-regulated in cardiomyopathy produced by doxorubicin in rabbits[J]. J Mol Cell Cardiol, 1998, 30(2): 243–54. DOI:10.1006/jmcc.1997.0588 |
| [9] | Chen XL, Lei YH, Liu CF, et al. Angiogenesis inhibitor bevacizumab increases the risk of ischemic heart disease associated with chemotherapy: a meta-analysis[J]. PLoS One, 2013, 8(6): e66721. DOI:10.1371/journal.pone.0066721 |
| [10] | Fuchs CS, Tomasek J, Yong CJ, et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebocontrolled, phase 3 trial[J]. Lancet, 2014, 383(9911): 31–9. DOI:10.1016/S0140-6736(13)61719-5 |
| [11] | Wilke H, Muro K, Van Cutsem E, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(11): 1224–35. DOI:10.1016/S1470-2045(14)70420-6 |
| [12] | Iliescu CA, Grines CL, Herrmann J, et al. SCAI Expert consensus statement: Evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory (endorsed by the cardiological society of india, and sociedad Latino Americana de Cardiologıa intervencionista)[J]. Catheter Cardiovasc Interv, 2016, 87(5): E202–23. DOI:10.1002/ccd.26379 |
| [13] | Carver JR, Shapiro CL, Ng A, et al. American Society of Clinical Oncology clinical evidence review on the ongoing care of adult cancer survivors: cardiac and pulmonary late effects[J]. J Clin Oncol, 2007, 25(25): 3991–4008. DOI:10.1200/JCO.2007.10.9777 |
| [14] | Darby SC, Cuter DJ, Boerma M, et al. Radiation-related heart disease: current knowledge and future prospects[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3): 656–65. DOI:10.1016/j.ijrobp.2009.09.064 |
| [15] | Shimizu Y, Kodama K, Nishi N, et al. Radiation exposure and circulatory disease risk: Hiroshima and Nagasaki atomic bomb survivor data, 1950-2003[J]. BMJ, 2010, 340: B5349. DOI:10.1136/bmj.b5349 |
| [16] | Mackay B, Ewer MS, Carasco CH. Asesment of anthracycline cardiomyopathy by endomyocardial biopsy[J]. Uhrastrnct Pathol, 1994, 18(1-2): 203–11. |
| [17] | 中国临床肿瘤学会, 中华医学会血液学分会. 蒽环类药物心脏毒性防治指南(2013年版)[J]. 临床肿瘤学杂志, 2013, 18(10): 925–34. [ CSCO, CMA. Guidelines for the prevention and treatment of anthracycline induced cardiac toxicity[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2013, 18(10): 925–34. DOI:10.3969/j.issn.1009-0460.2013.10.014 ] |
| [18] | Peng J, Dong C, Wang C, et al. Cardiotoxicity of 5-fluorouracil and capecitabine in Chinese patients: a prospective study[J]. Cancer Commun (Lond), 2018, 38(1): 22. DOI:10.1186/s40880-018-0292-1 |
| [19] | Gharib MI, Burnett AK. Chemotherapy-induced cardiotoxicity: current practice and prospects of prophylaxis[J]. Eur J Heart Fail, 2002, 4(3): 235–42. |
| [20] | Rowinsky EK, McGuire WP, Guarnieri T, et al. Cardiac disturbances during the administration of taxol[J]. J Clin Oncol, 1991, 9(9): 1704–12. DOI:10.1200/JCO.1991.9.9.1704 |
| [21] | Osman M, Elkady M. A Prospective Study to Evaluate the Effect of Paclitaxel on Cardiac Ejection Fraction[J]. Breast Care (Basel), 2017, 12(4): 255–9. DOI:10.1159/000471759 |
| [22] | Slamon DJ, Leyland-Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2[J]. N Engl J Med, 2001, 344(11): 783–92. DOI:10.1056/NEJM200103153441101 |
| [23] | Slamon D, Eiermann W, Robert N, et al. Adjuvant trastuzumab in HER2-positive breast cancer[J]. N Engl J Med, 2011, 365(14): 1273–83. DOI:10.1056/NEJMoa0910383 |
| [24] | Suter TM, Procter M, van Veldhuisen DJ, et al. Trastuzumab-associated cardiac adverse effects in the Herceptin Adjuvant trial[J]. J Clin Oncol, 2007, 25(25): 3859–65. DOI:10.1200/JCO.2006.09.1611 |
| [25] | Mantarro S, Rossi M, Bonifazi M, et al. Risk of severe cardiotoxicity following treatment with trastuzumab: a meta-analysis of randomized and cohort studies of 29, 000 women with breast cancer[J]. Intern Emerg Med, 2016, 11(1): 123–40. DOI:10.1007/s11739-015-1362-x |
| [26] | Wu YL, Chu DT, Han B, et al. Phase Ⅲ, randomized, open-label, first-line study in Asia of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer: evaluation of patients recruited from mainland China[J]. Asia Pac J Clin Oncol, 2012, 8(3): 232–43. DOI:10.1111/ajco.2012.8.issue-3 |
| [27] | Chu TF, Rupnick MA, Kerkela R, et al. Cardiotoxicity associated with tyrosine kinase inhibitor sunitinib[J]. Lancet, 2007, 370(9604): 2011–9. DOI:10.1016/S0140-6736(07)61865-0 |
| [28] | Han B, Li K, Zhao Y, et al. Anlotinib as a third-line therapy in patients with refractory advanced non-small-cell lung cancer: a multicentre, randomised phase Ⅱ trial (ALTER0302)[J]. Br J Cancer, 2018, 118(5): 654–61. DOI:10.1038/bjc.2017.478 |
| [29] | Geisler BP, Raad RA, Esaian D, et al. Apical ballooning and cardiomyopathy in a melanoma patient treated with ipilimumab: a case of takotsubo-like syndrome[J]. J Immunother Cancer, 2015, 3: 4. DOI:10.1186/s40425-015-0048-2 |
| [30] | Roth ME, Muluneh B, Jensen BC, et al. Left ventricular dysfunction after treatment with ipilimumab for metastatic melanoma[J]. Am J Ther, 2016, 23(6): e1925–8. DOI:10.1097/MJT.0000000000000430 |
| [31] | Johnson DB, Balko JM, Compton ML, et al. Fulminant myocarditis with combination immune checkpoint blockade[J]. N Engl J Med, 2016, 375(18): 1749–55. DOI:10.1056/NEJMoa1609214 |
| [32] | Todaro MC, Oreto L, Qamar R, et al. Cardioncology: state of the heart[J]. Int J Cardiol, 2013, 168(2): 680–7. DOI:10.1016/j.ijcard.2013.03.133 |
| [33] | Herrmann J, Lerman A, Sandhu NP, et al. Evaluation and management of patients with heart disease and cancer: cardio-oncology[J]. Mayo Clin Proc, 2014, 89(9): 1287–306. DOI:10.1016/j.mayocp.2014.05.013 |
| [34] | Seemann I, te Poele JA, Song JY, et al. Radiation and anthracycline-induced cardiac toxicity and the influence of ErbB 2 blocking agents[J]. Breast Cancer Res Treat, 2013, 141(3): 385–95. DOI:10.1007/s10549-013-2707-7 |
| [35] | van der Pal HJ, van Dalen EC, van Delder E, et al. High risk of symptomatic cardiac events in childhood cancer survivors[J]. J Clin Oncol, 2012, 30(13): 1429–37. DOI:10.1200/JCO.2010.33.4730 |
| [36] | Gustavsson A, Osterman B, Caralin-Stifhl E. A systematic overview of radiation therapy effects in non-Hodgkin's lymphoma[J]. Acta Oncol, 2003, 42(5-6): 605–19. DOI:10.1080/02841860310014435 |
| [37] | Rutqvist LE, Rose C, Cavallin-StaIl E. A systematic overview of radiation therapy effects in breast cancer[J]. Acta Oncol, 2003, 42(5-6): 532–45. DOI:10.1080/02841860310014444 |
| [38] | Cardinale D, Sandri MT, Martinoni A, et al. Left ventricular dysfunction predicted by early troponin I release after high-dose chemotherapy[J]. J Am Coll Cardiol, 2000, 36(2): 517–22. DOI:10.1016/S0735-1097(00)00748-8 |
| [39] | Cardinale D, Sandri MT, Colombo A, et al. Prognostic value of troponin I in cardiac risk stratification of cancer patients undergoing high-dose chemotherapy[J]. Circulation, 2004, 109(22): 2749–54. DOI:10.1161/01.CIR.0000130926.51766.CC |
| [40] | Ederhy S, Massard C, Dufaitre G, et al. Frequency and management of troponin I elevation in patients treated with molecular targeted therapies in phase Ⅰ trials[J]. Investig New Drugs, 2012, 30(2): 611–5. DOI:10.1007/s10637-010-9546-8 |
| [41] | De Iuliis F, Salerno G, Taglieri L, et al. Serum biomarkers evaluation to predict chemotherapy-induced cardiotoxicity in breast cancer patients[J]. Tumour Biol, 2016, 37(3): 3379–87. DOI:10.1007/s13277-015-4183-7 |
| [42] | Lenihan DJ, Stevens PL, Massey M, et al. The utility of point-of-care biomarkers to detect cardiotoxicity during anthracycline chemotherapy: a feasibility study[J]. J Card Fail, 2016, 22(6): 433–8. DOI:10.1016/j.cardfail.2016.04.003 |
| [43] | D'Errico MP, Grimaldi L, Petruzzelli MF, et al. N-terminal pro-B-type natriuretic peptide plasma levels as a potential biomarker for cardiac damage after radiotherapy in patients with left-sided breast cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 82(2): e239–46. DOI:10.1016/j.ijrobp.2011.03.058 |
| [44] | D'Errico MP, Petruzzelli MF, Gianicolo EA, et al. Kinetics of B-type natriuretic peptide plasma levels in patients with left-sided breast cancer treated with radiation therapy: results after one-year follow-up[J]. Int J Radiat Biol, 2015, 91(10): 804–9. DOI:10.3109/09553002.2015.1027421 |
| [45] | Narayan V, Keefe S, Haas N, et al. Prospective evaluation of Sunitinib-induced cardiotoxicity in patients with metastatic renal cell carcinoma[J]. Clin Cancer Res, 2017, 23(14): 3601–9. DOI:10.1158/1078-0432.CCR-16-2869 |
| [46] | Ky B, Putt M, Sawaya H, et al. Early increases in multiple biomarkers predict subsequent cardiotoxicity in patients with breast cancer treated with doxorubicin, taxanes, and trastuzumab[J]. J Am Coll Cardiol, 2014, 63(8): 809–16. DOI:10.1016/j.jacc.2013.10.061 |
| [47] | Vejpongsa P, Yeh ET. Prevention of anthracyclineinduced cardiotoxicity: challenges and opportunities[J]. J Am Coll Cardiol, 2014, 64(9): 938–45. DOI:10.1016/j.jacc.2014.06.1167 |
| [48] | Putt M, Hahn VS, Januzzi JL, et al. Longitudinal changes in multiple biomarkers are associated with cardiotoxicity in breast cancer patients treated with doxorubicin, Taxanes, and Trastuzumab[J]. Clin Chem, 2015, 61(9): 1164–72. DOI:10.1373/clinchem.2015.241232 |
| [49] | Horie T, Ono K, Nishi H, et al. Acute doxorubicin cardiotoxicity is associated with miR-146a-induced inhibition of the neuregulin-ErbB pathway[J]. Cardiovasc Res, 2010, 87(4): 656–64. DOI:10.1093/cvr/cvq148 |
| [50] | Leger KJ, Leonard D, Nielson D, et al. Circulating microRNAs: potential markers of cardiotoxicity in children and young adults treated with anthracycline chemotherapy[J]. J Am Heart Assoc, 2017, 6(4): pii: e004653. |
| [51] | Oliveira-Carvalho V, Ferreira LR, Bocchi EA. Circulating mir-208a fails as a biomarker of doxorubicin-induced cardiotoxicity in breast cancer patients[J]. J Appl Toxicol, 2015, 35(9): 1071–2. DOI:10.1002/jat.v35.9 |
| [52] | Ruggeri C, Gioffre S, Achilli F, et al. Role of microRNAs in doxorubicin induced cardiotoxicity: an overview of preclinical models and cancer patients[J]. Heart Fail Rev, 2018, 23(1): 109–22. |
| [53] | Doroshow JH, Synold TW, Somlo G, et al. Oxidative DNA base modifications in peripheral blood mononuclear cells of patients treated with high-dose infusional doxorubicin[J]. Blood, 2001, 97(9): 2839–45. DOI:10.1182/blood.V97.9.2839 |
| [54] | Todorova VK, Beggs ML, Delongchamp RR, et al. Transcriptome profiling of peripheral blood cells identifies potential biomarkers for doxorubicin cardiotoxicity in a rat model[J]. PLoS One, 2012, 7(11): e48398. DOI:10.1371/journal.pone.0048398 |
| [55] | Todorova VK, Makhoul I, Siegel ER, et al. Biomarkers for Presymptomatic doxorubicin-induced cardiotoxicity in breast Cancer patients[J]. PLoS One, 2016, 11(8): e0160224. DOI:10.1371/journal.pone.0160224 |
| [56] | Zamorano JL, Lancellotti P, Rodriguez Muñoz D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2016, 37(36): 2768–801. DOI:10.1093/eurheartj/ehw211 |
 2018, Vol. 45
2018, Vol. 45


