文章信息
- 口腔鳞癌MicroRNA-150表达及其与肿瘤相关巨噬细胞的相关性
- Relationship Between Expression of MicroRNA-150 and Tumor-associated Macrophages in Oral Squamous Cell Carcinoma
- 肿瘤防治研究, 2018, 45(12): 996-999
- Cancer Research on Prevention and Treatment, 2018, 45(12): 996-999
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0931
- 收稿日期: 2018-07-10
- 修回日期: 2018-10-09
2. 063000 唐山,唐山职业技术学院口腔系;
3. 050000 石家庄,河北医科大学第二医院口腔内科;
4. 063210 唐山,华北理工大学公共卫生学院
2. Depatement of Stomatology, Tangshan Vocational and Technical College, Tangshan 063000, China;
3. Department of Oral Medicine, The Second Hospital of Hebei Medical University, Shijiazhuang 050000, China;
4. School of Public Health, North China University of Science and Technology, Tangshan 063210, China
口腔鳞癌(oral squamous cell carcinoma, OSCC)是一种最常见的口腔恶性肿瘤,约占全身恶性肿瘤发生率的5%,具有颈部淋巴结转移及周围组织局部浸润生长的特点[1],且与口腔微生物的感染有关[2]。口腔癌相关巨噬细胞(tumor-associated macrophages, TAMs)是口腔鳞癌间质中最为常见的炎性反应细胞[3]。肿瘤细胞可通过分泌细胞因子,诱导静息的巨噬细胞(M0)向M2巨噬细胞(抑制免疫反应、促进肿瘤微血管形成)的表型转化,阻止M1巨噬细胞的产生(杀伤肿瘤细胞和微生物的效应细胞),促进肿瘤的发生发展[4]。
课题组前期研究发现,在口腔鳞癌组织中IFN-γ+巨噬细胞浸润减少,可能参与免疫监测功能的改变和口腔鳞癌的发生[5],但是免疫抑制相关细胞因子IL-10在口腔鳞癌巨噬细胞中的表达是否发生变化未见相关报道。微小RNA(microRNA, miRNA)是一种内源性非编码小分子RNA,在决定TAM的功能状态和分化表型中发挥重要作用,有可能成为肿瘤微环境干预的新靶点。本研究拟通过基因筛查和共定位检测口腔鳞癌组织中miR-150的表达和IL-10+TAMs的浸润情况,并分析miR-150和炎性反应因子的表达及相关性,为其早期诊断生物标志物和新的治疗靶点发现提供实验依据。
1 资料与方法 1.1 病例资料选取2013年1月—2017年9月河北医科大学第二医院45例经病理证实的口腔鳞癌患者,38例正常口腔黏膜组织。其中男22例、女23例;年龄41~76(55.64±11.14)岁;TNM分期:Ⅰ期和Ⅱ期患者共24例、Ⅲ期和Ⅳ期患者共21例。
1.2 实验方法 1.2.1 标本选取方法选择患者肿瘤病灶部位的口腔部黏膜作为标本组织,同时取正常口腔黏膜为对照标本组织,两组标本均在采集完成后,迅速用0.9%氯化钠溶液清洗血渍并转移至液氮罐中保存。
1.2.2 芯片组织标本用于分析基因差异表达的3例口腔鳞癌组织及3例口腔正常组织,按TRIzol试剂盒说明书提取总RNA,交由天津麦基生物有限责任公司进行人类全基因组表达谱芯片(Affymetrix)分析。
1.2.3 miRNA的提取及检测按照miRNA提取分离试剂盒(美国,OMEGA公司)说明书进行组织中总miRNA提取,反转录后参考罗氏实时定量PCR试剂盒,20 μl总反应体系:2×Mix预混料10.0 μl,自备引物0.4 μl,RT反应产物2.0 μl,反向引物0.4 μl,补水7.2 μl在ABI7500型PCR仪上进行miRNA定量检测。选用miRNA-16作为内参基因,循环参数设定:95℃ 5 min活化Taq酶,95℃ 15 s,60℃ 1 min,进行35个循环,采用相对定量法计算miRNA的相对表达量F=2-ΔCT,Δct=ctmiRNA-150-ctmiRNA-16,其中ct为每个反应管内的荧光信号到达设定的阈值时所经历的循环数。本研究OSCC与对照组中miR-150相对表达水平比较采用2-ΔΔCT法。
1.2.4 免疫双荧光共定位检测IL-10表达和TAMs浸润情况[6]组织切片脱蜡浸水后行高压抗原修复,山羊血清封闭,应用鼠抗人多克隆抗体anti-CD68(1:50稀释)和兔抗人单克隆抗体IL-10(1:50稀释)混合稀释液4℃孵育过夜,Fluorescein标记的抗鼠二抗(anti-CD68,1:100稀释,绿色)和Rhodamine标记的抗兔二抗(1:200稀释,红色)稀释液室温共孵育45 min,DAPI染核。细胞核呈蓝色,IL-10和CD68共表达显黄色。荧光显微镜下观察口腔鳞癌组织中TAM浸润情况及IL-10+TAM荧光强度,采用Image Pro-Plus 6.0定量分析IL-10+TAM水平。
1.2.5 ELISA检测口腔鳞癌组织中IL-10及TNF-α含量根据试剂盒说明书步骤检测不同病理口腔组织中IL-10和TNF-α的含量。
1.3 统计学方法数据采用SPSS13.0统计软件进行处理。计量资料采用x±s表示,两组间数据比较行t检验;计数资料采用例(百分率)表示,行χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 芯片筛查和qRT-PCR验证miR-150在口腔鳞癌组织中的表达检测3例口腔鳞癌组织和3例正常口腔组织miRNA的表达谱芯片结果显示:与正常口腔组织比较,miR-652、miR-let-7e、miR-532、miR-574、miR-663、miR-103、miR-708、miR-181、miR-362、miR-21、miR-155、miR-150、miR-185、miR-455和miR-497在口腔鳞癌组织中表达上调,其中miR-455表达上调7.1倍,miR-150表达上调6.4倍,miR-155表达上调6.6倍(P < 0.01)。qRT-PCR验证结果表明:与对照组比较,口腔鳞癌组织中miR-455表达上调3.1倍、miR-150表达上调4.4倍和miR-155表达上调3.8倍(P < 0.01),见图 1。
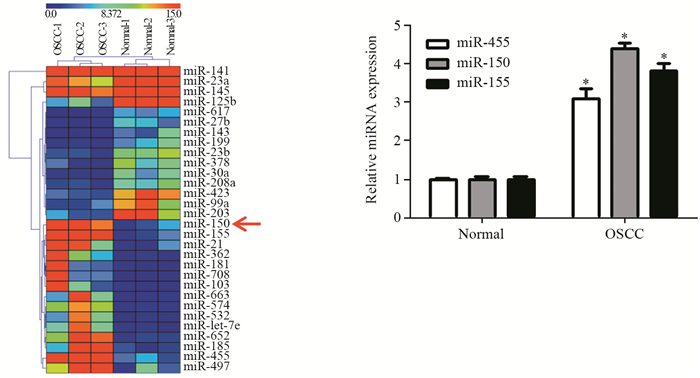
|
| *: P < 0.05, compared with normal group 图 1 正常口腔组织与口腔鳞癌组织miRNA表达谱及qRT-PCR结果 Figure 1 qRT-PCR result and miRNA expression in normal oral mucosa and oral squamous cell carcinoma(OSCC) tissues |
免疫双荧光染色结果显示:与正常口腔组织比较,口腔鳞癌组织中CD68+巨噬细胞浸润数增加(呈现绿色)和IL-10蛋白表达均升高(呈现红色),并且IL-10+CD68+巨噬细胞浸润同样显著增加(呈现黄色),比较差异均有统计学意义(P < 0.05),见图 2、表 1。Spearman秩相关系数检验结果显示口腔鳞癌组中miR-150表达与IL-10+TAM呈正相关(r=0.523, P < 0.05)。
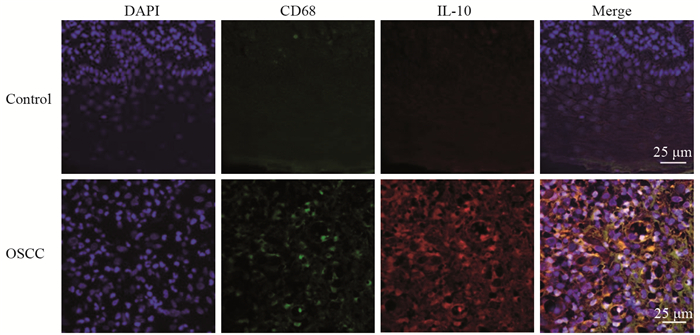
|
| Blue: the nucleus was stained with DAPI; Green: the positive expression of CD68; Red: the positive expression of IL-10; yellow: the positive expression of IL-10 +TAMs 图 2 口腔鳞癌组织中TAM浸润情况及IL-10+TAMs荧光强度 Figure 2 Infiltration of tumor-associated macrophages (TAMs) in OSCC tissues and fluorescence intensity of IL-10+TAMs |
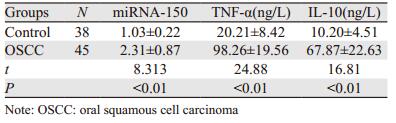
|
口腔鳞癌组织中miR-150表达水平上调2.3倍(P < 0.01),说明miRNA-150在OSCC组表达异常活跃,可作为口腔鳞癌诊断的参考指标。在OSCC组中TNF-α和IL-10水平均显著高于正常对照组,差异有统计学意义(P < 0.01),见表 1。血浆中miR-150表达与TNF-α和IL-10的表达均呈正相关(r=0.384, P=0.004和r=0.372, P=0.001)。说明miRNA-150在口腔鳞癌组中表达与炎性反应相关。
2.4 口腔鳞癌组织中miR-150表达与口腔鳞癌临床病理参数的关系口腔鳞癌组织中miR-150表达水平与性别和年龄无关(P > 0.05),但与临床病理分期、分化程度以及淋巴结转移有关(P < 0.05),见表 2。
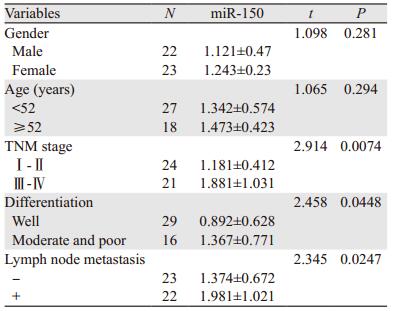
|
TAMs是参与免疫系统调节数量最多的肿瘤间质细胞,在肿瘤免疫抑制,促进恶性肿瘤生长、发展中起到重要作用,其机制主要是TAMs通过释放一系列促进肿瘤生长和免疫抑制因子(例如IL-10)帮助肿瘤细胞逃脱机体的免疫监测[7]。多篇研究报道了TAMs浸润与多种癌症不良预后相关[8-11],近年来研究报道表明,特异性miRNA在调节TAM极化及其功能表型中发挥重要作用,有望成为肿瘤靶向诊治的分子靶点。本研究结果表明:在口腔鳞癌组织中,miR-150表达升高,巨噬细胞浸润增加且与IL-10的表达呈正相关,提示,miR-150表达可能与TAMs的浸润及肿瘤的发生发展相关。这与Squadrito等[12]研究报道一致,巨噬细胞中miR-155、miR-125a/b能够促进M1型分化并增强炎性反应信号,而miR-146a、miR-21、miR-187、miR-147等能够促进M2型分化并抑制炎性反应信号。另外,OSCC组织中TNF-α和IL-10的表达均升高的结果表明,尽管CD68+IL-10+细胞(M2型)在OSCC组织中的浸润数增加预示miRNA150在M2型表型转化中发挥重要作用,但是M1型炎症因子TNF-α表达同样升高,说明在OSCC发生发展过程中,不是单一的miR-150发挥巨噬细胞的M2表型转换和免疫抑制状态调控,同样存在其他miRNA或分子对巨噬细胞M1型转换和免疫促进的调控,提示OSCC的免疫微环境变化是一个M1/M2型共存、促进和抑制炎性反应共同作用的结果,其复杂的免疫分子机制仍需深入探讨。
TAMs与肿瘤的关系报道日渐增多。Jung等[13]发现MCF-7细胞中TAMs源IL-10依赖激活下游STAT3-NGAL信号轴促进肿瘤细胞的生长。Vahl等在肺癌中的研究和Bolpetti等在宫颈癌的研究结果同样表明:IL-10是由病灶区的TAMs产生[8-9]。Vahl等[8]的研究结果表明:肺癌组织源分离的高纯度TAMs高表达IL-10和cathepsin B,并且IL-10的表达与肿瘤分期、大小、淋巴结转移、淋巴管侵袭和肿瘤组织低分化相关,提示TAMs表型可作为潜在的肿瘤临床病理特征。本研究结果显示,高表达TAMs源IL-10的口腔鳞癌患者与肿瘤分化程度、淋巴结转移和病理分期相关,提示TAM及其分泌的IL-10与口腔鳞癌不良预后可能相关,已有国外研究报道表明IL-10是乳腺癌的危险指标和预后的影响因子[14],而本研究结果提示miR-150或其调控的TAMs表型转换可能是OSCC潜在的分子治疗靶点,这也间接反映了miR-150和TAMs源IL-10的表达升高可能与口腔鳞癌的不良预后有关。Morandi等[15]研究报道IL-10并不与转移性神经性母细胞瘤的临床结果相关,因此仍需进一步通过随访研究证实TAMs源IL-10表达是否与口腔鳞癌不良预后之间的关系。
TAMs源分子功能的另外一个特点是细胞外基质降解,进而促使肿瘤细胞的迁移侵袭。国外研究报道肺癌组织中TAMs源组织蛋白酶cathepsin B和cathepsin S的表达升高促进肿瘤的发展和不良预后[8]。从本研究的已有结果不难看出,TAMs源IL-10可能在抑制肿瘤的免疫监测以及微生物感染清除方面发挥更重要的作用,这可能是促进口腔鳞癌发生、发展更为重要的原因。
综上所述,在口腔鳞癌组织中,miR-150通过TAMs产生大量的IL-10可能通过多种机制如:转变炎性反应类型为TH2型、逃脱免疫监测、抗炎和组织重塑功能,进而促进肿瘤的发展。因此,miR-150调节IL-10和TAMs在口腔鳞癌生长、转移中的机制得到明确,这将是一个新的抗癌治疗靶向。
| [1] | Eckert AW, Wickenhauser C, Salins PC, et al. Clinical relevance of the tumor microenvironment and immune escape of oral squamous cell carcinoma[J]. J Transl Med, 2016, 14: 85. DOI:10.1186/s12967-016-0828-6 |
| [2] | Moscicki AB, Schiffman M, Burchell A, et al. Updating the natural history of human papillomavirus and anogenital cancers[J]. Vaccine, 2012, 30(Suppl 5): F24–33. |
| [3] | He KF, Zhang L, Huang CF, et al. CD163+ tumor-associated macrophages correlated with poor prognosis and cancer stem cells in oral squamous cell carcinoma[J]. Biomed Res Int, 2014, 2014: 838632. |
| [4] | Fukuda K, Koabyashi A, Watabe K. The role of tumor-associated macrophage in tumor progression[J]. Front Biosci (Schol Ed), 2012, 4: 787–98. |
| [5] | Tian S, Jiang C, Liu X, et al. Hypermethylation of IFN-γ in oral cancer tissues[J]. Clinical Oral Investig, 2017, 21(8): 2535–42. DOI:10.1007/s00784-017-2052-z |
| [6] | 张琪, 马冬, 常凌雅, 等. 白介素10、E26转录因子1和肿瘤相关巨噬细胞在宫颈癌中的表达研究[J]. 中国全科医学, 2016, 19(27): 3306–10. [ Zhang Q, Ma D, Chang LY, et al. Expression of Interleukin-10, E26 Transformation Factor-1 and Tumor-associated Macrophages in Cervical Cancer[J]. Zhongguo Quan Ke Yi Xue, 2016, 19(27): 3306–10. DOI:10.3969/j.issn.1007-9572.2016.27.010 ] |
| [7] | Yang Y, Cheng S, Liang G, et al. Celastrol inhibits cancer metastasis by suppressing M2-like polarization of macrophages[J]. Biochem Biophys Res Commun, 2018, 503(2): 414–9. DOI:10.1016/j.bbrc.2018.03.224 |
| [8] | Vahl JM, Friedrich J, Mittler S, et al. Interleukin-10-regulated tumour tolerance in non-small cell lung cancer[J]. Br J Cancer, 2017, 117(11): 1644–55. DOI:10.1038/bjc.2017.336 |
| [9] | Bolpetti A, Silva JS, Villa LL, et al. Interleukin-10 production by tumor infiltrating macrophages plays a role in Human Papillomavirus 16 tumor growth[J]. BMC Immunol, 2010, 11: 27. DOI:10.1186/1471-2172-11-27 |
| [10] | Batchu RB, Gruzdyn OV, Mahmud EM, et al. Inhibition of Interleukin-10 in the tumor microenvironment can restore mesothelin chimeric antigen receptor T cell activity in pancreatic cancer in vitro[J]. Surgery, 2018, 163(3): 627–32. DOI:10.1016/j.surg.2017.10.056 |
| [11] | Madeddu C, Gramignano G, Kotsonis P, et al. Microenvironmental M1 tumor-associated macrophage polarization influences cancer-related anemia in advanced ovarian cancer: key role of Interleukin-6[J]. Haematologica, 2018, 103(9): e388–91. DOI:10.3324/haematol.2018.191551 |
| [12] | Squadrito ML, Etzrodt M, De Palma M, et al. MicroRNA-mediated control of macrophages and its implications for cancer[J]. Trends in Immunol, 2013, 34(7): 350–9. DOI:10.1016/j.it.2013.02.003 |
| [13] | Jung M, Weigert A, Tausendschön M, et al. Interleukin-10-Induced Neutrophil Gelatinase-Associated Lipocalin Production in Macrophages with Consequences for Tumor Growth[J]. Mol Cell Biol, 2012, 32(19): 3938–48. DOI:10.1128/MCB.00413-12 |
| [14] | Hamidullah, Changkija B, Konwar R. Role of interleukin-10 in breast cancer[J]. Breast Cancer Res Treat, 2012, 133(1): 11–21. |
| [15] | Morandi F, Croce M, Cangemi G, et al. IL-10 and ARG-1 Concentrations in Bone Marrow and Peripheral Blood of Metastatic Neuroblastoma Patients Do Not Associate with Clinical Outcome[J]. J Immunology Res, 2015, 2015: 718975–84. |
 2018, Vol. 45
2018, Vol. 45


