文章信息
- 烟酰胺磷酸核糖基转移酶在结肠癌中的表达、功能及生物信息学分析
- Expression, Function and Bioinformatic Analysis of Nicotinamide Phosphoribosyl Transferase in Colon Cancer
- 肿瘤防治研究, 2018, 45(12): 991-995
- Cancer Research on Prevention and Treatment, 2018, 45(12): 991-995
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0928
- 收稿日期: 2018-07-09
- 修回日期: 2018-09-10
结肠癌是世界上男性常见的第三大肿瘤,女性常见的第二大肿瘤[1],是所有肿瘤类型中第四大致死原因[2]。尽管在近20年内对结肠癌的筛查、诊断以及治疗方法上取得不错的进展,但早期患者5年生存率仅为69%,晚期患者5年生存率降为12%[3]。因此需要新型有效的治疗方法来提高患者的生存率。烟酰胺腺嘌呤二核苷酸(NAD+)在细胞氧化还原中起到核心作用,也是多种细胞生物学过程必需的第二信使[4]。烟酰胺磷酸核糖基转移酶(NAMPT)是催化NAD+合成的限速酶,已经证实在多种恶性肿瘤如乳腺癌、前列腺癌、胃癌、甲状腺癌、结肠癌以及血液系统肿瘤中高表达[5]。由于肿瘤细胞对NAD+的高需求,抑制NAMPT表达可显著抑制肿瘤细胞增殖,因此,NAMPT被认为是抗肿瘤治疗的分子靶点[6]。本研究通过组织标本及TCGA数据库证实NAMPT在癌组织中高表达并通过细胞系证实沉默NAMPT后细胞增殖能力减弱。同时,运用生物学信息对NAMPT的理化性质、蛋白结构及生物学功能进行预测分析,以期对结肠癌的诊疗提供新的思路。
1 材料与方法 1.1 材料人结肠癌细胞系SW480购于美国模式培养物集存库(ATCC);NAMPT及对照的siRNA购于广州市瑞博生物科技有限公司;组织标本选自2017年4月—2018年4月鄂州市中心医院手术切除的结肠癌及其癌旁组织46例;从TCGA数据库获取结肠癌患者数据;NAMPT及内参GAPDH抗体购于武汉三鹰有限公司;NAMPT上游引物AATGTTCTCTTCACGGTGGAAAA,下游引物ACTGTGATTGGATACCAGGACT及GAPDH上游引物GAGCGAGATCCCTCCAAAAT,下游引物ACTGTGATTGGATACCAGGACT由武汉擎科创新生物科技有限公司合成;四季青胎牛血清及RPMI 1640培养液、TRIzol总RNA提取试剂、反转录试剂盒购于武汉拜意尔生物有限公司;CCK8试剂盒购于索莱宝科技有限公司;UniProt网站(http://www.uniprot.org/)获取NAMPT序列登录号(人P43490)及对应的氨基酸序列。
1.2 方法 1.2.1 qPCR法检测结肠癌患者组织中NAMPT mRNA的表达从TCGA数据库下载结肠癌患者RNA-Seq基因信息,比较正常组织及肿瘤组织mRNA表达差异,同时比较同一患者癌组织与癌旁组织mRNA差异。
收集我院手术切除结肠癌患者癌与癌旁组织标本;利用TRIzol试剂行总RNA提取(NANODROP 2000测定浓度及纯度),并将样品反转录为cDNA,利用SYBR Green PCR mix在ABI StepOne Plus中进行qPCR,条件:95℃ 5 min;95℃ 10 s,60℃ 20 s,72℃ 15 s共40个循环。mRNA的表达用GAPDH校准。用2-ΔΔCt法计算基因相对表达量。
1.2.2 siRNA转染结肠癌SW480细胞系于37℃、5%CO2培养箱中,用含10%RPMI1640培养液培养细胞。按说明书转染细胞:分别用无胎牛血清RPMI1640培养液稀释siRNA及Entranster-R4000,充分混匀两种稀释溶液,室温静置15 min。将混匀液体加入含细胞的培养液中,充分混匀后培养24 h,收集细胞并提取蛋白,应用Western blot技术验证蛋白沉默效果:配10%SDS-丙烯酰胺胶,电泳80 V 30 min,120 V 90 min,转印蛋白至活化的PVDF膜,90 V 90 min。TBST漂洗5 min×3次,5%脱脂牛奶封闭1 h,一抗孵育过夜,TBST漂洗5 min×3次后用辣根过氧化物酶标记的二抗孵育2 h,TBST漂洗5 min×3次后加ECL液显影。
1.2.3 CCK8测定结肠癌SW480细胞增殖和活力利用NAMPT-siRNA干扰SW480中NAMPT表达后,接种细胞于96孔板,每孔2 000个细胞,每组设置4个复孔。应用CCK8在不同时间段(0、24、48、72、96 h)检测细胞的增殖能力,转染NC-siRNA的SW480作为对照组,利用酶标仪(TECAN,Infinitef50)在450 nm处测吸光度OD值。
1.2.4 NAMPT生物信息学分析利用在线软件ProtParam(https://web.expasy.org/protparam/)分析NAMPT的主要理化性质:氨基酸组成、分子式及分子质量、平均疏水值、等电点、不稳定系数等;ProtScale(https://web.expasy.org/protscale/)分析NAMPT亲/疏水性;Jpred4.0(http://www.compbio.dundee.ac.uk/jpred4/)分析NAMPT的二级结构;SWISS-MODEL(https://swissmodel.expasy.org/)分析NAMPT的三级结构;ScanProsite(https://prosite.expasy.org/)分析NAMPT的功能结构域;NCBI(https://www.ncbi.nlm.nih.gov/cdd/?term=)分析NAMPT的保守结构域;Genecards(http://www.genecards.org/)预测NAMPT细胞定位;String(https://string-db.org/cgi/input.pl)分析与NAMPT相互作用蛋白及生物学功能。
1.3 统计学方法采用GraphPad Prism6软件分析TCGA及实验数据,比较采用两独立样本t检验;qPCR结果及TCGA数据库中结肠癌与正常标本数据以均数±标准差表示;P < 0.05差异有统计意义。
2 结果 2.1 结肠癌及癌旁组织中NAMPT的表达情况数据库共检测到286例结肠癌及41例癌旁组织mRNA表达的信息,其中匹配癌与癌旁病例数为25例;结果证实与正常的结肠组织比较,癌组织中NAMPT水平显著升高,差异具有统计学意义(P=0.0014, P=0.0418),见图 1A。利用本院组织标本,采用qPCR技术对46对组织标本行基因表达检测,结果显示:结肠癌组织中NAMPT水平显著高于癌旁正常组织(P < 0.0001),见图 1B,结果进一步证实TCGA数据库基因表达。

|
| 图 1 NAMPT基因在TCGA数据库(A)及我院结肠癌组织中(B)的表达 Figure 1 The expression of NAMPT in TCGA database(A) and colon tumor tissues(B) |
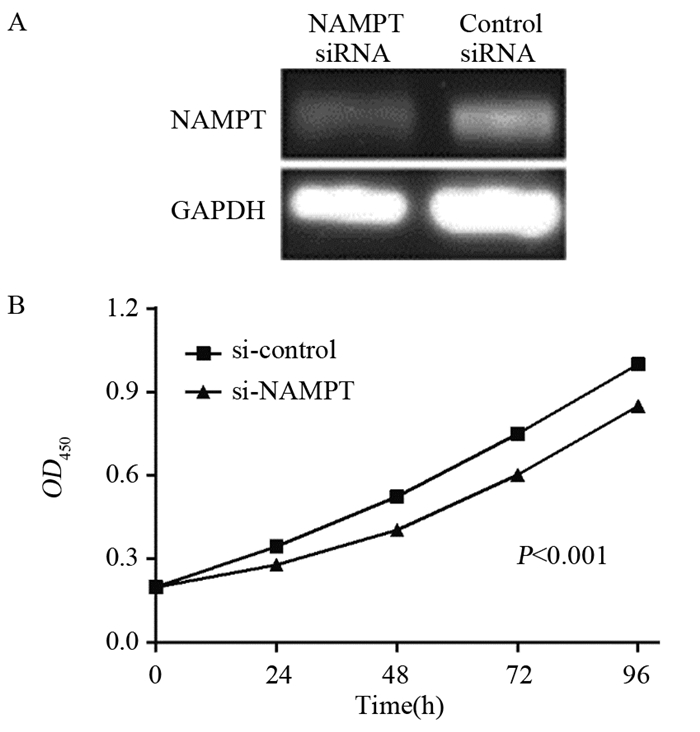
Western blot检测结果显示:沉默NAMPT后,结肠癌细胞系SW480表达NAMPT明显降低,见图 2A;同时,CCK8结果显示:与对照组相比较,沉默NAMPT后,SW480细胞增殖活力明显降低,差异具有显著意义(P < 0.001),见图 2B。
|
| 图 2 siRNA沉默SW480细胞后Western blot检测细胞NAMPT的表达(A)和CCK8法验证SW480细胞增殖情况(B) Figure 2 NAMPT exprtssion(A) and proliferation ability(B) of SW480 cells transfected with NAMPT siRNA and control siRNA detected by Western blot and CCK8, respectively |
利用ProtParam在线软件对NAMPT蛋白分析,其氨基酸组分分布见表 1。分析NAMPT理化性质显示:NAMPT蛋白由491个氨基酸组成,相对分子质量55 521.16 Da,蛋白总原子数7 835个,预测分子式C2518H3910N654O745S8。其带正电荷氨基酸略多于带负电荷氨基酸,理论等电点6.69,不稳定系数为35.48,在哺乳动物体内半衰期为30 h,其疏水性指数平均值为-0.429,脂肪族指数为86.31,为不稳定酸性亲水性蛋白质。进一步利用ProtScale对NAMPT的亲/疏水性进行分析。该蛋白最大亲水区域位点在44号位(Score=-3.133), 最大疏水区域位点在325号位(Score=1.833),其疏水指数平均值为-0.429,与ProtParam在线软件预测结果一致,为亲水性蛋白,在细胞中可能处于水溶状态。
利用Jpred4.0软件对NAMPT二级结构进行预测,其二级结构有14个α螺旋,17个β折叠;其中参与α螺旋氨基酸有190个(占比38.70%),参与β折叠氨基酸有85个(占比17.31%)。同时利用软件对NAMPT三级结构进行预测,结果GMQE评分0.97(接近1表示准确性高),见图 3。进一步对NAMPT功能结构域和保守结构域进一步分析,预测结果显示NAMPT并无功能结构域,其仅有一个保守结构域,见图 4。

|
| 图 3 人NAMPT三级结构预测(来源SWISS-MODEL数据库) Figure 3 Tertiary structure prediction of NAMPT (from SWISS-MODEL Database) |

|
| 图 4 人NAMPT结构域预测(来源PubMed数据库) Figure 4 Structural domain prediction of NAMPT (from PubMed Database) |
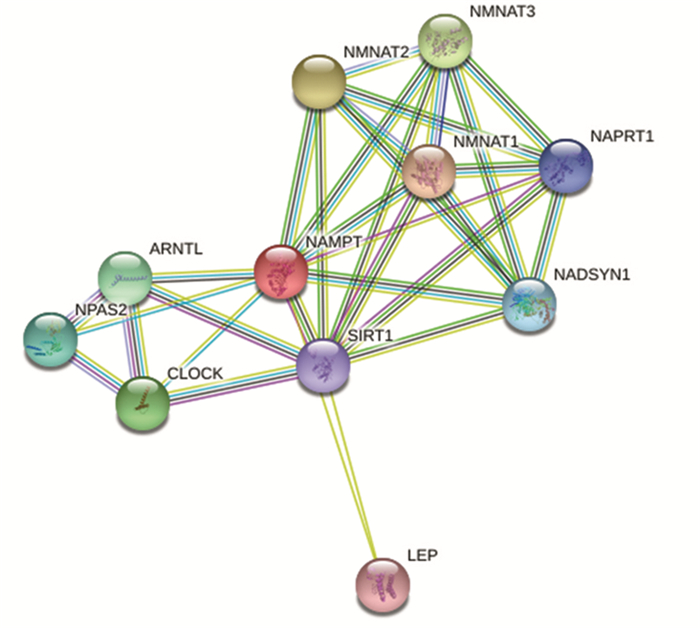
利用Genecards对NAMPT蛋白亚细胞定位预测分析可知:NAMPT蛋白在细胞外、细胞核以及胞质中均有大量表达,此外,在线粒体、过氧化物酶体、质膜、细胞骨架以及内质网也有分布,见图 5。这表明NAMPT可能是分泌型蛋白,可参与细胞间或细胞内重要的生物学功能。同时利用String数据库得到蛋白质相互作用网络图,见图 6,其中与NAMPT可能发生作用的蛋白主要是SIRT1、ARNTL、NPAS2、CLOCK和LEP等,生物过程(GO)提示其参与的生物学活动主要包括参与NAD+生物合成、昼夜节律、应激、代谢反应及衰老等,进一步证实其在肿瘤生物学发生发展中扮演的重要角色。

|
| 图 5 NAMPT亚细胞定位(来源Genecards数据库) Figure 5 Sub-cellular localization of NAMPT (from Genecards Database) |
|
| 图 6 NAMPT相互作用蛋白(来源String数据库) Figure 6 Protein-protein interaction of NAMPT (from String Database) |
目前针对结肠癌的治疗主要包括手术、分子靶向治疗、免疫治疗、过继细胞疗法、疫苗治疗、溶瘤病毒治疗等,其中部分治疗尚处于临床前期试验[3]。近年,许多新型的分子靶向药物取得了较大的进展,如伊马替尼治疗胃肠道间质瘤[7],利妥昔单抗治疗血液系统肿瘤[8],表皮生长因子受体治疗非小细胞肺癌[9],赫塞汀治疗乳腺癌[10]等。烟酰胺腺嘌呤二核苷酸(NAD+)在细胞氧化还原中起到核心作用,也是多种细胞生物学过程必须的第二信使[4]。已经证实NAMPT与肿瘤有密切的联系,其表达高低与肿瘤治疗、患者不良预后相关。相比在正常组织中,NAMPT在结肠癌[11]、卵巢癌[12]、前列腺癌[13]等组织中高表达。在胃癌[14]、子宫内膜癌[15]NAMPT高表达也提示患者不良预后。
我们的工作也证实NAMPT在结肠癌组织中高表达。在结肠癌细胞系SW480中,沉默NAMPT导致细胞增殖能力减弱。对于哺乳动物来说,NAMPT对NAD+的生物合成至关重要。在肿瘤治疗中,通过抑制剂抑制NAMPT活性作用于NAD+可导致肿瘤细胞减少糖酵解、核苷酸合成和ATP生成[16],这使得针对NAMPT的研究具有很强的转化应用前景,针对其靶位的研究成为理想中的抗肿瘤方向。当前针对NAMPT的两种抑制剂FK866以及CHS828已进入临床试验,但由于导致患者血小板减少而限制其临床应用[17-18]。这说明我们对NAMPT的理化性质及功能研究的还不够深入。
NAMPT在肿瘤治疗中展现了较好的应用前景,本研究利用生物信息学方法及qPCR技术证实NAMPT在结肠癌组织中高表达,并证实高表达NAMPT在肿瘤生长增殖中起到重要作用。利用生物信息学方法对NAMPT的理化性质及生物学功能进行研究,初步推测其在结肠恶性肿瘤发生中的重要作用,通过其抑制剂针对肿瘤细胞的代谢,为我们进一步针对结肠癌患者抗肿瘤治疗提供新思路。
| [1] | Lucena-Cacace A, Otero-Albiol D, Jimenez-Garcia MP, et al. NAMPT Is a Potent Oncogene in Colon Cancer Progression that Modulates Cancer Stem Cell Properties and Resistance to Therapy through Sirt1 and PARP[J]. Clin Cancer Res, 2018, 24(5): 1202–15. DOI:10.1158/1078-0432.CCR-17-2575 |
| [2] | Chen L, Wang S, Wang Y, et al. IL-6 influences the polarization of macrophages and the formation and growth of colorectal tumor[J]. Oncotarget, 2018, 9(25): 17443–54. |
| [3] | Veenstra CM, Krauss JC. Emerging Systemic Therapies for Colorectal Cancer[J]. Clin Colon Rectal Surg, 2018, 31(3): 179–91. DOI:10.1055/s-0037-1602238 |
| [4] | Galluzzi L, Kepp O, Vander Heiden MG, et al. Metabolic targets for cancer therapy[J]. Nat Rev Drug Discov, 2013, 12(11): 829–46. DOI:10.1038/nrd4145 |
| [5] | Vora M, Ansari J, Shanti RM, et al. Increased Nicotinamide Phosphoribosyltransferase in Rhabdomyosarcomas and Leiomyosarcomas Compared to Skeletal and Smooth Muscle Tissue[J]. Anticancer Res, 2016, 36(2): 503–7. |
| [6] | Chen W, Dong G, Wu Y, et al. Dual NAMPT/HDAC Inhibitors as a New Strategy for Multitargeting Antitumor Drug Discovery[J]. ACS Med Chem Lett, 2017, 9(1): 34–8. |
| [7] | Nakano K, Takahashi S. Current Molecular Targeted Therapies for Bone and Soft Tissue Sarcomas[J]. Int J Mol Sci, 2018, 19(3): pii: E739. DOI:10.3390/ijms19030739 |
| [8] | Salles G, Barrett M, Foà R, et al. Rituximab in B-Cell Hematologic Malignancies: A Review of 20 Years of Clinical Experience[J]. Adv Ther, 2017, 34(10): 2232–73. DOI:10.1007/s12325-017-0612-x |
| [9] | Rotow J, Bivona TG. Understanding and targeting resistance mechanisms in NSCLC[J]. Nat Rev Cancer, 2017, 17(11): 637–58. DOI:10.1038/nrc.2017.84 |
| [10] | Parakh S, Gan HK, Parslow AC, et al. Evolution of anti-HER2 therapies for cancer treatment[J]. Cancer Treat Rev, 2017, 59: 1–21. DOI:10.1016/j.ctrv.2017.06.005 |
| [11] | Van Beijnum JR, Moerkerk PT, Gerbers AJ, et al. Target validation for genomics using peptide-specific phage antibodies: a study of five gene products overexpressed in colorectal cancer[J]. Int J Cancer, 2002, 101(2): 118–27. DOI:10.1002/ijc.v101:2 |
| [12] | Shackelford RE, Bui MM, Coppola D, et al. Over-expression of nicotinamide phosphoribosyltransferase in ovarian cancers[J]. Int J Clin Exp Pathol, 2010, 3(5): 522–7. |
| [13] | Wang B, Hasan MK, Alvarado E, et al. NAMPT overexpression in prostate cancer and its contribution to tumor cell survival and stress response[J]. Oncogene, 2011, 30(8): 907–21. DOI:10.1038/onc.2010.468 |
| [14] | Bi TQ, Che XM, Liao XH, et al. Overexpression of Nampt in gastric cancer and chemopotentiating effects of the Nampt inhibitor FK866 in combination with fluorouracil[J]. Oncol Rep, 2011, 26(5): 1251–7. |
| [15] | Tian W, Zhu Y, Wang Y, et al. Visfatin, a potential biomarker and prognostic factor for endometrial cancer[J]. Gynecol Oncol, 2013, 129(3): 505–12. DOI:10.1016/j.ygyno.2013.02.022 |
| [16] | Roulston A, Shore GC. New strategies to maximize therapeutic opportunities for NAMPT inhibitors in oncology[J]. Mol Cell Oncol, 2015, 3(1): e1052180. |
| [17] | Holen K, Saltz LB, Hollywood E, et al. The pharmacokinetics, toxicities, and biologic effects of FK866, a nicotinamide adenine dinucleotide biosynthesis inhibitor[J]. Invest New Drugs, 2008, 26(1): 45–51. DOI:10.1007/s10637-007-9083-2 |
| [18] | von Heideman A, Berglund A, Larsson R, et al. Safety and efficacy of NAD depleting cancer drugs: results of a phase Ⅰ clinical trial of CHS 828 and overview of published data[J]. Cancer Chemother Pharmacol, 2010, 65(6): 1165–72. DOI:10.1007/s00280-009-1125-3 |
 2018, Vol. 45
2018, Vol. 45



