文章信息
- 阿帕替尼联合替吉奥治疗鼻咽癌1例报道
- Apatinib Combined with S-1 for Nasopharyngeal Carcinoma: One Case Report
- 肿瘤防治研究, 2018, 45(9): 707-709
- Cancer Research on Prevention and Treatment, 2018, 45(9): 707-709
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0749
- 收稿日期: 2018-06-05
- 修回日期: 2018-06-20
鼻咽癌是常见的头颈部恶性肿瘤之一,局部/区域复发和远处转移是鼻咽癌最常见的失败原因,约15%~30%经过根治性治疗后的鼻咽癌患者出现远处转移[1]。我院治疗了1例铂类耐药远处转移的鼻咽癌患者多线接受阿帕替尼联合替吉奥治疗后,效果良好,现报道如下。
1 临床资料患者,男,49岁,2016年2月28日因发现右颈部肿物7月余于当地医院就诊,行穿刺细胞学提示:右颈部淋巴结转移性癌。鼻咽部CT示:鼻咽部右侧壁病变,考虑多为肿瘤,并双颈部淋巴结增大。于2016年3月3日行鼻咽镜活检示:鼻咽部非角化型分化性癌,免疫组织化学:p63(+)、CK5/6(+)、CK7(-)、Ki67(20%)、EBV(+)、PCK(+)、Vimentin(-)、CD34(-)。2016年3月11日患者转诊我院,入院后查鼻咽MRI示:(1)鼻咽癌,累及右侧咽旁间隙、右侧翼突及口咽;(2)两侧咽后及上颈部多发淋巴结转移,颈部Ⅰ区多发小淋巴结肿。颈部MRI示:鼻咽癌,累及右侧口咽,两侧咽后,右侧颈部Ⅱ、Ⅲ、Ⅳ区、左侧Ⅱ区多发淋巴结转移,两侧颈部多发小淋巴结肿。经各项检查后明确诊断:鼻咽癌T3N3M0ⅣA期。2016年3月16日—4月12日予“雷替曲塞+顺铂”诱导化疗2周期,疗效评价PR。2016年4月26日—6月14日行同步放化疗(雷替曲塞+顺铂同步化疗2周期;鼻咽放疗DT 73.5Gy/33F),疗效评价PR。2016年7月19日复查鼻咽部及颈部肿瘤消退。胸部CT示:两肺多发小结节,较前增多增大。2016年7月21日—8月19日予“吉西他滨+奈达铂”辅助化疗2周期。2016年12月7日胸部CT示:两肺多发结节,较前增大、增多,考虑为转移瘤,疗效评价PD。2016年12月14日—3月6日予“紫杉醇+氟尿嘧啶+奈达铂”化疗4周期。肺部CT示:“肺转移瘤”化疗后,两肺多发小结节,较前无明显变化,疗效评价SD。2017年3月22日—6月3日予口服“希罗达”单药维持化疗2周期。2017年6月15日肺部CT示:“肺转移瘤”化疗后两肺见多发结节影,较前(2017年3月27日)增大、变实。经科室讨论,建议患者入组华中科技大学同济医学院附属同济医院PD-1临床试验。2017年6月26日—10月23日在华中科技大学同济医学院附属同济医院行PD-1 8周期治疗,复查胸部CT发现,肺部转移灶较前增大,遂退组。于2017年11月3日再次行胸部CT示:两肺多发转移瘤较前增大、增多;两肺门及纵隔多发淋巴结转移,较前增多增大。2017年11月8日—12月7日行DP方案(多西他赛+顺铂)联合恩度化疗2周期。2017年11月30日复查胸部CT示:“肺转移瘤”化疗后,两肺多发转移瘤部分较前缩小;两肺门及纵隔淋巴结无明显变化。疗效评价SD。于2017年12月21日继续行第3周期DP方案联合恩度化疗,2018年1月17日复查胸部CT示:“肺转移瘤”化疗后,两肺多发转移瘤部分较前稍显增大;两肺门及纵隔淋巴结无明显变化。CT提示肺部转移病灶稳定,于2018年1月19日行第4周期DP+恩度方案化疗。2018年3月12日复查胸部CT示:“肺转移瘤”化疗后,两肺多发转移瘤较前增大;两肺门及纵隔淋巴结无明显变化。患者多程治疗后病情进展,于2018年3月13日开始行“替吉奥60 mg 2次/天+艾坦250 mg 1次/天”联合治疗,未见明显治疗不良反应,将艾坦加量至500 mg隔日一次。2018年4月24日复查胸部CT示:双肺多发转移瘤较前缩小;两肺门及纵隔多发淋巴结转移较前缩小,评价疗效虽未达到CR,但病灶基本消退,缓解比较明显,疗效达到PR,见图 1~2。之后患者出现手足综合征,表现为四肢出现皮疹,伴疼痛及水泡,不良反应分级为3级(美国国立癌症研究所NCI分级标准4.0版),将艾坦减量至250 mg 1次/天,并予激素、维生素B6、局部药物涂擦等对症处理后,患者上述症状明显改善,无其他明显不良反应。目前仍口服“替吉奥60 mg 2次/天+艾坦250 mg 1次/天”治疗中。
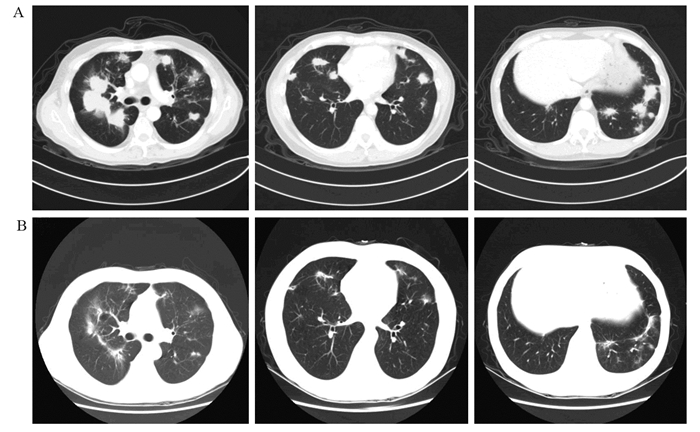
|
| A: multiple images before treatment; B: multiple images after treatment 图 1 阿帕替尼联合替吉奥多线治疗后双肺转移灶缩小(轴位) Figure 1 Pulmonary metastasis were smaller after multiline treatment combined apatinib with S-1(axial view) |
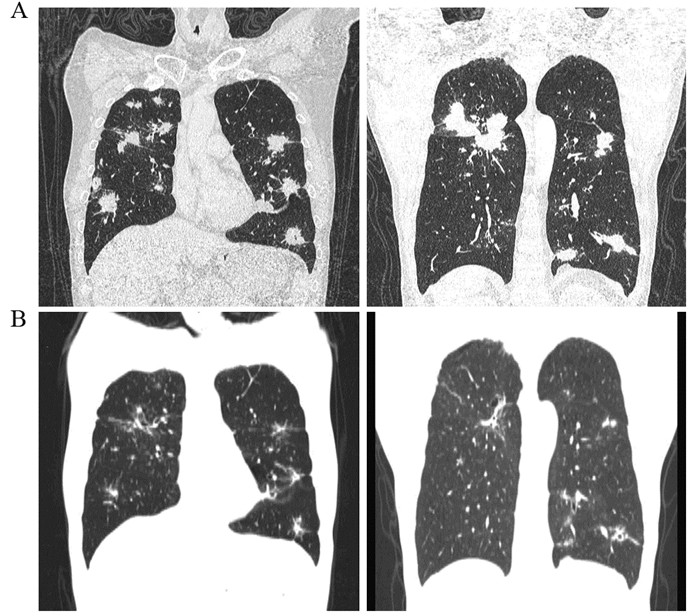
|
| A: multiple images before treatment; B: multiple images after treatment 图 2 阿帕替尼联合替吉奥多线治疗后双肺转移灶缩小(冠状位) Figure 2 Pulmonary metastasis were smaller after multiline treatment combined apatinib with S-1 (coronal position) |
本例患者初诊为局部晚期鼻咽癌,经雷替曲塞+顺铂化疗及雷替曲塞+顺铂同步放化疗后鼻咽原发灶及颈部区域淋巴结明显退缩,但患者放化疗后出现双肺转移(鼻咽原发灶及颈部区域淋巴结未提示复发),属于远处转移的晚期鼻咽癌患者,根据转移性鼻咽癌专家共识,主要治疗方式采用化疗及靶向治疗。
患者出现远处转移后,先后使用GP、TPF、希罗达、DP+恩度等多线方案治疗,但疗效欠佳。目前研究表明免疫检查点PD-1单克隆抗体(Pembroblizumab)在复发转移鼻咽中的治疗安全,客观缓解率为25.9%[2]。患者参加PD-1临床试验,最终因疗效欠佳退组。而对于以铂类为基础的化疗失败后的复发转移的鼻咽癌患者,S-1单药化疗被认为是一种安全且有效的治疗选择[3]。
新生血管形成是恶性肿瘤发生、发展过程中的关键步骤,其中,阻断血管内皮生长因子(vascular endothelia growth factor, VEGF)及其受体介导的信号转导通路,是抗血管生成靶向治疗的关键环节[4]。鼻咽癌组织高表达表皮生长因子受体(epidermal growth factor receptor, EGFR)和血管内皮细胞生长因子受体(vascular endothelial growth factor receptor, VEGFR),针对EGFR或VEGFR的靶向治疗成为鼻咽癌的治疗选择。恩度是一种人源化广谱的抗血管生成药物,近年来的研究显示,恩度泛靶点抗血管生成作用主要通过下调VEGF及VEGFR表达来发挥抗血管生成作用,其他非常明确的靶点包括低氧诱导因子(HIF)、成纤维细胞生长因子(FGF)、金属蛋白酶(MMP)、整合素(integrin)等,最终通过抑制血管内皮的生长来抑制肿瘤血管的生成。但本例患者使用恩度后疗效欠佳。阿帕替尼是由我国自主研发的一种新型的小分子酪氨酸受体激酶抑制剂,能通过与血管内皮细胞生长因子受体-2(VEGFR-2)高选择性地结合且抑制其功能,从而抑制肿瘤血管的生成,有效抑制血管内皮细胞的增殖、迁移以及血管生成,发挥抗肿瘤作用[5]。目前已被国家食品药品监督管理总局(CFDA)批准上市,用于晚期胃腺癌或胃-食管结合部腺癌三线或三线以上的治疗。研究证实,阿帕替尼对晚期胃癌、非小细胞肺癌、乳腺癌等均有明显疗效,可显著延长患者总生存期(overall survival, OS)[6]。有研究[7]报道,阿帕替尼能一定程度逆转多药耐药。
虽然既往阿帕替尼对鼻咽癌的疗效尚不明确,但近年来国内多家医院相继开展了单中心、单臂、开放性的甲磺酸阿帕替尼联合化疗针对晚期头颈癌的临床研究,显示出比较好的治疗效果。陆颖等开展的阿帕替尼非一线治疗复发/转移性头颈鳞癌前瞻、开放性、多中心临床研究和胡晓桦等开展的甲磺酸阿帕替尼片二线治疗晚期鼻咽癌患者的临床研究目前正在研究中,我们期待这些试验得到一些好的结果。本例患者出现5次疾病进展,曾接受5种化疗方案、PD-1临床试验、恩度靶向治疗。鼻咽癌多线治疗后病情再次进展,已无标准治疗方案,根据患者个人情况,结合目前临床的研究报道,我们选择了阿帕替尼联合替吉奥的联合治疗方案,并初步观察疗效及不良反应。结果发现,在用药1月后,胸部CT显示肺部转移灶明显缩小,疗效佳,评价疗效PR。关于阿帕替尼的不良反应,Li等[8]研究报道,常见的不良反应多为高血压、蛋白尿、手足综合征、骨髓抑制,这些不良反应大部分为轻度或中度且可以控制。本例患者虽然出现3级手足综合征,但经阿帕替尼减量及积极处理后患者症状改善,不良反应可控,目前仍使用上述方案维持。另外,Li等[9]关于阿帕替尼治疗晚期胃癌Ⅳ期临床研究中典型不良反应的疗效相关性研究表明:手足皮肤反应的发生是阿帕替尼治疗晚期胃癌独立的OS预测因素,发生高血压、蛋白尿、手足皮肤反应的患者用药时长较长。本例患者使用阿帕替尼后出现手足综合征,我们所观察的疗效与Li等[9]报告结果相符。
虽然本例患者使用阿帕替尼和替吉奥联合治疗近期疗效佳,但治疗过程无法进一步明确说明是二者其中之一还是共同作用的结果。根据以往以铂类为基础的化疗失败后的复发转移鼻咽癌使用替吉奥的相关文献,单纯使用替吉奥口服化疗一个周期就出现肿瘤明显缩小的病例非常少见,所以我们考虑在本例患者疗效中阿帕替尼可能起到了一个更为重要的作用。
综上所述,阿帕替尼联合替吉奥多线治疗晚期转移性鼻咽非角化型分化性癌有一定疗效,值得进一步扩大样本量来证实,为临床提供一种有效的治疗方案。
| [1] | Lee AW, Ma BB, Ng WT, et al. Management of nasopharyngeal carcinoma:current practice and future perspective[J]. J Clin Oncol, 2015, 33(29): 3356–64. DOI:10.1200/JCO.2015.60.9347 |
| [2] | Hsu C, Lee SH, Ejadi S, et al. Safety and antitumor activity of pembrolizumab in patients with programmed death-ligand 1-positive nasopharyngeal carcinoma: results of the KEYNOTE-028 study[J]. J Clin Oncol, 2017, 35(36): 405–6. |
| [3] | Peng PJ, Cheng H, Ou XQ, et al. Safey and efficacy of S-1 chemotherapy in recurrent and metastatic nasopharyngeal carcinoma patients after failure of platinum-based chemotherapy: multi-institutional rethospective analysis[J]. Drug Des Devel Ther, 2014, 8: 1083–7. |
| [4] | Folkman J. Antiangiogenesis in cancer therapy-endostatin and its mechanisms of action[J]. Expt Cell Res, 2006, 312(5): 594–607. DOI:10.1016/j.yexcr.2005.11.015 |
| [5] | Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102(7): 1374–80. DOI:10.1111/cas.2011.102.issue-7 |
| [6] | Zhang H. Apatinib for molecular targeted therapy in tumor[J]. Drug Des Devel Ther, 2015, 9: 6075–81. |
| [7] | Mi YJ, Liang YJ, Huang HB, et al. Apatinib (YN968D1) reverses multidrug resistance by inhibiting the efflux function of multiple ATP-binding cassette transporters[J]. Cancer Res, 2010, 70(20): 7981–91. DOI:10.1158/0008-5472.CAN-10-0111 |
| [8] | Li J, Zhao X, Chen L, et al. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10: 529. DOI:10.1186/1471-2407-10-529 |
| [9] | Li J, Deng WY, Wen L, et al. Association of proteinuria, hypertension, and hand-foot-skin reaction with efficacy of apatinib in gastric cancer: results from the post-marketing study (Ahead-G201)[J]. J Chin Oncol, 2018, 36(suppl4): 73. |
 2018, Vol. 45
2018, Vol. 45


