文章信息
- 弥漫大B细胞淋巴瘤中Ki67表达与18F-FDG PET/CT SUVmax的相关性及二者在疗效评估中的应用
- Correlation Between Ki67 Expression and 18F-FDG PET/CT SUVmax in Patient with Diffuse Large B-cell Lymphoma and Their Application in Therapeutic Effect Evaluation
- 肿瘤防治研究, 2018, 45(12): 1004-1008
- Cancer Research on Prevention and Treatment, 2018, 45(12): 1004-1008
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0652
- 收稿日期: 2018-05-16
- 修回日期: 2018-06-22
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)是一组以弥漫性浸润的大B淋巴细胞为病理特点的非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)。DLBCL是成人淋巴瘤中最常见的一种类型,约占我国DLBCL患者总数的34.97%[1],且发病率逐年上升。DLBCL是一组在临床表现、组织形态和预后的多个方面具有明显异质性的淋巴系统恶性肿瘤,因此近年来其预后相关因素成为研究热点。肿瘤增殖性抗原(Ki67)为一种细胞核抗原,仅在增殖细胞核中表达,其单克隆抗体能标记G1后期、S期、G2期和M期细胞核,而G0期和G1早期细胞核不被标记,是目前应用最广泛的反映细胞增殖活性的标志物之一。18F-FDG PET/CT显像技术是目前诊断淋巴瘤最有效的影像诊断方法,但目前对于淋巴瘤的PET/CT影像报道多限于肿瘤分期和疗效评价方面。目前很多研究报道Ki67可以很好的预测淋巴瘤临床行为和判断预后[2-4],但PET/CT显像DLBCL病灶18F-FDG摄取程度与Ki67表达之间相关性报道却较少。我们回顾性分析55例初治的DLBCL患者的临床资料,以评价Ki67表达与18F-FDG摄取程度之间的关系,并讨论Ki67、18F-FDG PET/CT标准化摄取值(SUVmax)和DLBCL患者化疗效果之间的关系。
1 资料与方法 1.1 临床资料选取2014年1月—2015年12月在我院首诊初治患者60例。所有患者均经过病理活检,确诊为DLBCL,病理诊断参照2008年血液淋巴瘤诊断标准,并有免疫组织化学Ki67酶标染色报告。所有患者化疗前行18F-FDG PET/CT显像,初始化疗方案为R-CHOP(利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松);化疗3~4周期(4~6周)后行PET/CT显像评估疗效;全疗程化疗结束后6~24月,行PET/CT显像监测复发和随访,化疗结束前每例患者显像次数≥3次,55例患者共行218次扫描。排除标准:(1)淋巴瘤病灶已切除,PET/CT未发现阳性病灶;(2)同时并发其他恶性肿瘤;(3)临床资料不完整。其中2例患者术后显像未探查到淋巴瘤病灶,1例同时并发肺癌,2例失访,均予以剔除。剩余55例患者临床及随访资料完备,进行回顾性分析,其中男27例,女28例,年龄27~77岁,中位年龄56.8岁。随访时间从首次PET/CT或病理确诊时间开始,随访截至2018年4月31日,随访时间≥6月。
1.2 PET/CT图像采集18F-FDG由广东原子高科同位素医药有限公司提供,放化纯度 > 95%。所有受检者禁食6 h以上,空腹血糖不高于10.0 mmol/L,化疗后显像患者空腹血糖不高于8.0 mmol/L。按照5.18 MBq/kg计算剂量并静脉注射,平静休息60~90 min,显像前排尿,取仰卧位,扫描范围从颅顶至股骨上段。PET/CT设备为Philips Gemini Ⅱ,配备2排螺旋CT,PET系统视野中心空间分辨率为4.8 mm,CT扫描条件120 KV,200 Ma,0.75秒/转,层厚7.5 mm,螺距1.0。PET图像以全身3D采集,9~10个床位,3分钟/床位,轴向视野180 mm,相邻床位间重叠50%。PET数据采用三维行处理最大似然算法(3D-RAMLA)重建,并用CT数据进行非均匀衰减校正。
1.3 PET/CT图像分析所有PET/CT图像均由2名有诊断经验的核医学医师共同阅片。应用感兴趣区(ROI)技术测量SUVmax,如果PET/CT显像阳性,选取摄取最高部位的SUVmax,如果PET/CT阴性,选择治疗前FDG高代谢部位测量SUVmax。2009年第1次中期PET淋巴瘤国际工作会议推荐Deauville 5分法(5-PS),有2项研究肯定Deauville 5分法用于化疗后评估的可重复性及预后价值[5]。Deauville 5分法(5-PS)标准[5],病灶摄取FDG程度和纵隔血池、肝本底比较,1分为无摄取,2分为摄取程度低于纵隔,3分为介于纵隔和肝本底之间,4分为高于肝本底(小于3倍),5分为明显高于肝本底(大于3倍)或出现新病灶。参考Lugano分类[6],将化疗中期和化疗结束后随访阶段的PET/CT结果分为3个等级:(1)5分法评分为4~5分,与基线比较,FDG摄取程度无明显变化甚至上升,PET/CT示无代谢反应(no metabolic response, NMR)或疾病代谢进展(progressive metabolic disease, PMD),考虑为治疗无效或疾病进展;(2)5分法评分为4~5分,与基线比较,FDG摄取程度下降,PET/CT示部分代谢反应(partial metabolic response, PMR),考虑为部分缓解或病变残留;(3)5分法评分为1~3分,PET/CT示完全代谢反应(complete metabolic response, CMR),考虑为完全缓解。依据5分法评分,全疗程化疗结束后随访过程中PET/CT评估为PMR或NMR甚至PMD,则提示为疗效差或复发,若PET/CT评估为CMR,则提示为疗效好或治愈。
1.4 免疫组织化学按照Ki67表达程度,将结果分为5级:1级(10%~20%)、2级(≥20%~40%)、3级(≥40%~60%)、4级(≥60%~80%)、5级(≥80%~100%)。
1.5 统计学方法采用SPSS21.0进行统计分析,DLBCL病灶SUVmax用均值±标准差(x±s)显示,Ki67表达程度用四分位数(QL,QU)表示;病灶SUVmax与Ki67表达、SUVmax与化疗疗效之间的相关性采用Spearman相关分析,并计算出相关系数r,P < 0.05为差异有统计学意义。Logistic回归分析,观察性别、年龄、病灶SUVmax、Ki67表达程度是否是化疗疗效的独立影响因素。
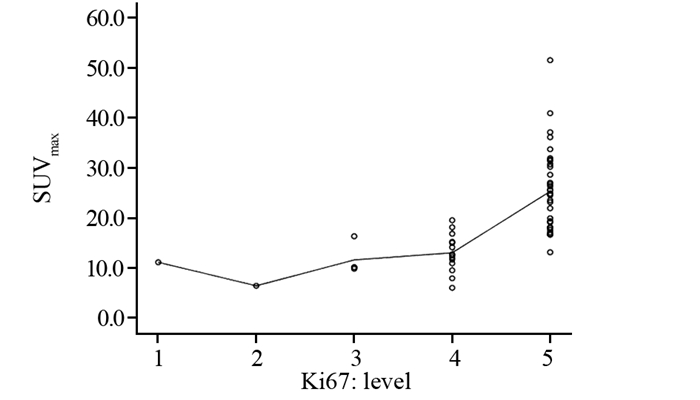
2 结果 2.1 SUVmax和ki67的相关性DLBCL患者病灶SUVmax和Ki67表达程度呈显著正相关(r=0.762, P=0.000),见图 1。
|
| DLBCL: diffuse large B cell lymphoma 图 1 DLBCL病灶SUVmax和Ki67的相关性 Figure 1 Correlation between DLBCL SUVmax and Ki67 expression |
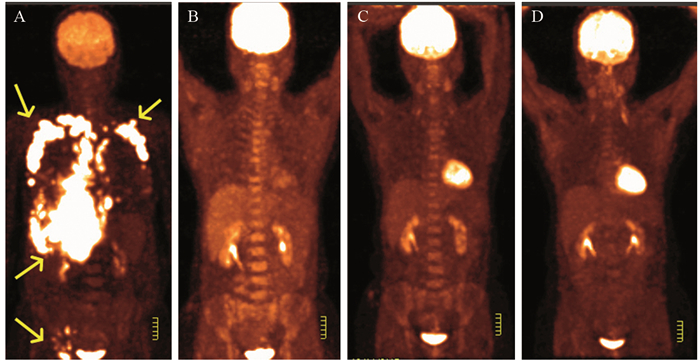
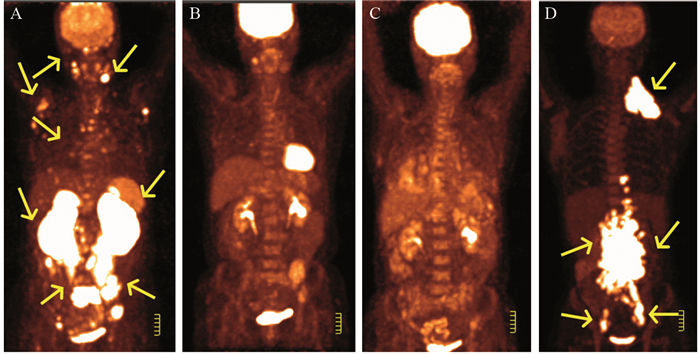
DLBCL患者化疗结束至病例随访时间结束,PET/CT显像评估疗效后,31例患者治疗后评估为CMR,列入疗效好一组,见图 2;20例患者为NMR或PMD,4例患者PMR,把以上患者列入疗效差一组,见图 3。疗效好的一组SUVmax=22.1±8.4,疗效差的一组SUVmax=18.6±10.3。DLBCL治疗疗效和病灶SUVmax无显著相关性(r=0.248, P=0.068);患者Ki67表达的四分位数(QL, QU)=(61.2, 90.0),四分位间距=28.8;Logistic回归分析,患者性别、年龄、病灶SUVmax、Ki67表达程度都不是影响治疗疗效的独立因素(P=0.262),见表 1。
|
| A: before chemotherapy, chest lesion SUVmax31.9, Ki67 50% by axillary lymph node biopsy; Yellow arrows showed axillary lymph nodes, abdominal lymph nodes and inguinal lymph nodes with hypermetabolism; B: After six courses of chemotherapy, lesions were smaller, hypermetabolism lesions disappeared; C and D: no recurrence occurred one or two years after chemotherapy 图 2 DLBCL患者化疗后完全代谢反应 Figure 2 Complete metabolic response(CMR) in DLBCL patients after chemotherapy |
|
| A: before chemotherapy, left kidney lesion SUVmax38.2, Ki67 90% by inguinal lymph node biopsy; Yellow arrows showed submandibular lymph nodes, spleen, kidney and pelvic lymph nodes with hypermetabolism; B: After four courses of chemotherapy, lesions were smaller, most hypermetabolism lesions disappeared; C: One year after chemotherapy, hypermetabolism lesion disappeared; D: Twenty months after chemotherapy, DLBCL relapsed; Yellow arrows showed clavicular lymph nodes, retroperitoneal lymph nodes, pelvic lymph nodes and inguinal lymph nodes with hypermetabolism again 图 3 DLBCL患者化疗后疾病代谢进展 Figure 3 Progressive metabolic disease(PMD) in DLBCL patients after chemotherapy |

|
淋巴瘤分为非霍奇金淋巴瘤(NHL)和霍奇金淋巴瘤(HL),DLBCL从属于NHL,为高度侵袭性淋巴瘤。DLBCL患者的病情常表现为迅速进展型,并常伴有局部或全身症状,大部分患者在疾病确诊时处于临床分期Ⅲ期或Ⅳ期[7]。病灶局限的早期患者,通过联合治疗,疾病可达到治愈,但进展期患者,疗效则显著降低,因此DLBCL患者早期正确的诊断和分期对于提高治愈率尤为重要。
3.1 Ki67抗原表达在DLBCL疗效评估中的价值Ki67作为一种反映细胞增殖水平的核抗原,其阳性指数的高低可以指导周期特异性化疗药物的选择[8]。国内外已有大量关于Ki67抗原表达与DLBCL预后、治疗效果等关系的研究。大部分研究认为,Ki67高表达与DLBCL恶性程度高、预后差密切相关,吴红卫等[9]对58例进行CHOP/RCHOP方案化疗的初诊DLBCL患者进行了研究,结果表明Ki67抗原高表达的患者,化疗效果差,预后欠佳,Ki67抗原低表达的患者,化疗效果好,预后较好。Li等[10]通过对118例新发并应用RCHOP方案治疗的DLBCL进行研究,结果表明,在总生存期及无疾病进展期方面,Ki67抗原高表达组要明显低于Ki67抗原低表达组,但这种研究结果仍存在争议。Yan等[11]对336例应用CHOP/RCHOP方案化疗的DLBCL患者的多个免疫组织化学指标(MYC、Bcl-2、Bcl-6及Ki67)和预后关系分析,结果发现Ki67不影响预后。另外,Hasselblom等[12]通过对199例DLBCL患者进行研究,表明Ki67低表达对无进展生存期(PFS)和总生存期(OS)有显著不良影响。本研究结果显示Ki67表达程度不是影响治疗疗效的独立因素。分析原因,可能与本组病例数偏少,随访时间偏短有关,而且大部分病例Ki67都呈明显高表达,Ki67低表达的病例偏少,而Ki67表达程度又因病理科医师阅片而有所差异。
目前,虽然Ki67表达与DLBCL的关系尚有争议,但大部分研究表明,Ki67抗原高表达与DLBCL预后差、治疗效果不佳有关。其在DLBCL中的作用已被重视并被列为NCCN指南的检查项目。但如何利用Ki67抗原的表达情况来指导DLBCL治疗的研究还非常少,需要临床工作者在实践中摸索,以进一步利于DLBCL的个性化治疗。
3.2 SUVmax在DLBCL疗效评估中的意义MyLam等[13]回顾性分析了430例DLBCL患者化疗后2~16周内行PET/CT复查结果,显示治疗后PET/CT结果阳性的患者2年PFS率及OS率均明显低于治疗后PET/CT结果阴性或不确定的患者,治疗后PET/CT的结果可预测患者的预后,且阳性结果提示患者预后不良。Xie等[14]认为SUVmax和无疾病进展生存期(progression free survival, PFS)呈负相关。应志涛等[15]认为DLBCL患者规范一线治疗后PET/CT阴性及轻度代谢患者的预后相对较好,而治疗后PET/CT阳性患者预后相对较差。朱璐婷[16]认为最大标准摄取值减少率(△SUVmax)可以作为DLBCL患者预后的独立影响因素,但△SUVmax最佳界值点各文献报道不一,成像协议、投照条件及阅片医师一致性可能对该值存在影响[17]。本研究结果,SUVmax值高低不是影响化疗效果的独立因素。分析原因,可能是PET/CT检查没有全部在活检或手术之前进行,活检和手术可能造成肿瘤负荷最大的或最明显的病灶被清除,影响了SUVmax;其次,临床实际工作中很难强制在活检或手术前进行PET/CT检查,但是尽量延长PET/CT检查与手术的间隔,减少人为误差,可以更准确地预测疾病的结果。目前,SUVmax作为反映FDG代谢程度的一种半定量方法,本身受到显像时间、剂量和血糖水平等多重因素影响,且DLBCL患者大部分是多个病灶,本研究结果和文献报告不一致还可能和靶病灶的选择有关。目前多灶性DLBCL如何选取靶病灶,尚无统一的标准。临床实际工作中无法保证在SUVmax最显著的部位活检,因此测量靶病灶和活检部位不一致也会导致研究结果差异,影响疗效评估。
虽然本组病例病灶SUVmax和DLBCL患者化疗疗效间无相关性,但Deauville 5分法在DLBCL全疗程疗效评估的广泛使用已经获得了一致认可[18]。使用Deauville 5分法是基于测量病灶、肝脏、纵隔的SUVmax,而得到相对准确的疗效评估。Fuertes等[17]利用5-PS法分析中期PET/CT结果,得分 < 3分的患者5年无进展生存率(PFS)和总体生存率(OS)分别为79%和92%,得分≥4分的患者5年PFS率和OS率均为50%,且两者差异均有统计学意义(P=0.02和P=0.0003)。
3.3 Ki67抗原表达和SUVmax的关联由于恶性肿瘤细胞增殖活性增加,核抗原和蛋白质代谢增加,恶性肿瘤细胞需要更多的葡萄糖提供能量,因此恶性肿瘤细胞对FDG摄取就会增加,从而导致SUVmax摄取升高,因此很多文献报道Ki67表达程度和SUVmax水平呈显著正相关[19]。本文研究结果与文献报道结果相同,说明SUVmax也能间接反映病灶的增殖性。但梁颖[20]报道了47例DLBCL患者全身病灶SUVmax(BmSUVmax)、活检部位SUVmax(BxSUVmax)和Ki67表达无相关性。分析二者无相关性原因可能与多数患者于活检后行PET/CT有关。还有可能是选择的靶病灶SUVmax并不一定是DLBCL活检的部位,因此靶病灶Ki67表达程度并不能真实的反映出来。Shou等[21]认为,与BmSUVmax或BxSUVmax相比,活检部位SUV平均值(BxSUVave)应与Ki67表达有更好的相关性。
综上所述,本研究认为Ki67表达程度和SUVmax具有显著正相关,该结果和大部分文献相同。但Ki67表达程度和SUVmax都不能作为DLBCL化疗疗效的独立影响因素,这个结果和大部分文献结果不同,可能是由于病例数少、随访时间短、活检部位和测量SUVmax靶病灶不一致等因素导致,还需要在相关方面加以改进。然而相关的研究仍然存在分歧,但在DLBCL治疗期间和治疗结束后随访阶段,使用18F-FDG PET/CT评估疗效对患者的获益程度不言而喻。
| [1] | Li XQ, Li GD, GAO ZF, et al. Distribution pattern of lymphoma subtypes in China: A nationwide multicenter study of 10002 cases[J]. J Diagn Concepts Pract, 2012, 11(2): 111–5. |
| [2] | Li ZM, Huang JJ, Xia Y, et al. High Ki-67 expression in diffuse large B-cell lymphoma patients with non-germinal center subtype indicates limited survival benefit from R-CHOP therapy[J]. Eur J Haematol, 2012, 88(6): 510–7. DOI:10.1111/ejh.2012.88.issue-6 |
| [3] | Gaudio F, Giordano A, Perrone T, et al. High Ki67 index and bulky disease remain significant adverse prognostic factors in patients with diffuse large B cell lymphoma before and after the introduction of rituximab[J]. Acta Haematol, 2011, 126(1): 44–51. DOI:10.1159/000324206 |
| [4] | 李少玲, 付骞千, 张甜甜, 等. 原发性胃肠道非霍奇金淋巴瘤的临床特征及预后因素分析[J]. 肿瘤防治研究, 2017, 44(1): 28–33. [ Li SL, Fu QQ, Zhang TT, et al. Clinical features and prognostic factors of primary gastrointestinal Non-Hodgkin's lymphoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(1): 28–33. DOI:10.3971/j.issn.1000-8578.2017.01.006 ] |
| [5] | Meignan M, Gallamini A, Meignan M, et al. Report on tile First International Workshop on Interim-PET-Scan in Lymphoma[J]. Leuk Lymphoma, 2009, 50(8): 1257–60. DOI:10.1080/10428190903040048 |
| [6] | Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma:The Lugano classification[J]. J Clin Oncol, 2014, 32(27): 3059–68. DOI:10.1200/JCO.2013.54.8800 |
| [7] | Herrmann K, Buck AK, Schuster T, et al. Predictive value of initial 18F-FLT uptake in patients with aggressive non-Hodgkin lymphoma receiving R-CHOP treatment[J]. J Nucl Med, 2011, 52(5): 690–6. DOI:10.2967/jnumed.110.084566 |
| [8] | Xuan CN, WW Lee, Amin AM, et al. Tumor burden assessed by the maximum standardized uptake value and greatest diameter on FDG-PET predicts prognosis in untreated diffuse large-cell lymphoma[J]. Nucl Med Mol Imaging, 2010, 44(1): 39–44. |
| [9] | 吴红卫, 黄蓉飞, 戴小珍. Ki-67蛋白表达在弥漫大B细胞淋巴瘤预后判断中的意义[J]. 四川医学, 2014, 35(6): 692–4. [ Wu HW, Huang RF, Dai XZ. Prognostic Value of Ki-67 Protein Expressions in Patienties with Diffuse Large B-cell Lymphoma[J]. Sichuan Yi Xue, 2014, 35(6): 692–4. ] |
| [10] | Li ZM, Huang JJ, Xia Y, et al. High Ki-67 expression in diffuse large B-cell lymphoma patients with non-germinal center subtype indicates limited survival benefit from R-CHOP therapy[J]. Eur J Haematol, 2012, 88(6): 510–7. DOI:10.1111/ejh.2012.88.issue-6 |
| [11] | Yan LX, Liu YH, Luo DL, et al. MYC expression in concert with BCL-2 and BCL-6 expression predicts outcome in Chinese patients with diffuse large B-cell lymphoma[J]. PLoS One, 2014, 9(8): e104068. DOI:10.1371/journal.pone.0104068 |
| [12] | Hasselblom S, Ridell B, Sigurdardottir M, et al. Low rather than high Ki-67 protein expression is an adverse prognostic factor in diffuse large B-cell lymphoma[J]. Leuk Lymphoma, 2008, 49(8): 1501–9. DOI:10.1080/10428190802140055 |
| [13] | MyLam KJ, El-Galaly TC, Hutchings M, et al. Prognostic impact of Clinician-based interpretation of F-fluorodeoxyglucose positron emission tomography/computed tomography reports obtained in patients with newly diagnosed diffuse large B-cell lymphoma[J]. Leuk Lymphoma, 2014, 55(7): 1563–9. DOI:10.3109/10428194.2013.850165 |
| [14] | Xie M, Wu K, Liu Y, et al. Predictive value of F-18 FDG PET/CT quantization parameters in diffuse large B cell lymphoma: a metaanalysis with 702 participants[J]. Med Oncol, 2015, 32(1): 446. DOI:10.1007/s12032-014-0446-1 |
| [15] | 应志涛, 王雪娟, 宋玉琴, 等. 弥漫大B细胞淋巴瘤患者规范治疗后行18F-FDG PET/CT检查的预后意义[J]. 中华血液学杂志, 2012, 33(10): 810–3. [ Ying ZT, Wang XJ, Song YQ, et al. Prognostic value of 18F-FDG PET/CT after first-line treatment in patients with diffuse large B-cell lymphoma[J]. Zhonghua Xue Ye Xue Za Zhi, 2012, 33(10): 810–3. DOI:10.3760/cma.j.issn.0253-2727.2012.10.005 ] |
| [16] | 朱璐婷, 岑溪南, 欧晋平, 等. 中期18F-FDG PET/CT显像不同评价方法对弥漫大B细胞淋巴瘤患者预后判断价值[J]. 中国实验血液学杂志, 2017, 25(2): 431–7. [ Zhu LT, Cen XN, Ou JP, et al. Values of different evaluation criteria of interim 18f-fdg pet/ct scan for prediction of prognosis in patients with DLBCL[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2017, 25(2): 431–7. ] |
| [17] | Fuertes S, Setoain X, Lopez-Guillermo A, et al. Interim FDG PET/CT as a prognostic factor in diffuse large B-cell lymphoma[J]. Eur J Nucl Med Mol Imaging, 2013, 40(4): 496–504. DOI:10.1007/s00259-012-2320-8 |
| [18] | Barrinton SF, Mikhaeel NG, Kostakoglu L, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the Intemational Conference on Malignant Lymphomas Imaging Working Group[J]. J Clin Oncol, 2014, 32(27): 3048–58. DOI:10.1200/JCO.2013.53.5229 |
| [19] | 张建华, 王荣福, 范岩, 等. 18F-FDG PET/CT评价初诊非霍奇金淋巴瘤代谢活性及其与免疫表型的相关性[J]. 中华医学杂志, 2014, 94(33): 2576–9. [ Zhang JH, Wang RF, Fan Y, et al. Metabolic activity measured by 18F-FDG PET/CT in newly diagnosed patients with non-Hodgkin lymphoma: correlation with immunophenotype[J]. Zhonghua Yi Xue Za Zhi, 2014, 94(33): 2576–9. DOI:10.3760/cma.j.issn.0376-2491.2014.33.006 ] |
| [20] | 梁颖, 吴宁, 方艳, 等. 侵袭性淋巴瘤18F标记的氟代脱氧葡萄糖摄取程度与Ki-67表达的相关性[J]. 中华肿瘤学杂志, 2013, 35(5): 356–60. [ Liang Y, Wu N, Fang Y, et al. Correlation of 18F-FDG uptake with tumor-proliferating antigen Ki-67 expression in aggressive lymphoma[J]. Zhonghua Zhong Liu Xue Za Zhi, 2013, 35(5): 356–60. ] |
| [21] | Shou Y, Lu J, Chen T, et a1. Correlation of fluorodeoxyglucose uptake and tumor-proliferating antigen Ki67 in lymphomas[J]. J Cancer Res Ther, 2012, 8(1): 96–102. DOI:10.4103/0973-1482.95182 |
 2018, Vol. 45
2018, Vol. 45


