文章信息
- 肿瘤的光遗传学治疗
- Optogenetics Therapy of Human Cancers
- 肿瘤防治研究, 2018, 45(12): 1023-1026
- Cancer Research on Prevention and Treatment, 2018, 45(12): 1023-1026
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0642
- 收稿日期: 2018-04-09
- 修回日期: 2018-08-22
2. 730050 兰州,兰州军区兰州总医院眼科
2. Department of Ophthalmology, Lanzhou General Hospital of Lanzhou Military Region, Lanzhou 730050, China
光遗传学(optogenetics)技术最早由Boyden和Deisseroth于2005年提出,他们应用慢病毒载体结合光将通道视紫红质蛋白(channelrhodopsin-2, ChR2)转染到神经元中,操纵神经元活性[1]。光遗传学的应用领域早已超越神经科学,其在肿瘤治疗中的作用也初见端倪。本文系统综述光遗传学在肿瘤治疗中的作用机制及未来方向。
1 光遗传学发展简史光遗传学应用遗传学和光的方法刺激和控制生物组织中特定细胞的功能。自从2005年报道用蓝光照射视蛋白精准控制神经活性以来,光遗传学已经成为一门崭新的学科。应用传统的物理、化学或转基因方法来影响神经回路的行为控制面临诸多挑战,因为这些方法缺乏对细胞的精准调控,光遗传学技术克服了这种局限[2]。生物体内存在一类可以感受光刺激并产生光效应的视蛋白,光遗传学的发展史就是不同视蛋白的发现史。细菌视紫红质蛋白(bacteriorhodopsin)是光驱动的质子泵和膜转运蛋白[3],是最早发现的视蛋白之一。从我国西藏盐湖发现的嗜盐菌中提取的正古紫质(archaerhodopsin)也属于此类视蛋白。
光控离子通道ChR2是光遗传学的主要工具,2003年它首次从莱茵衣藻(Chlamydomonas reinhardtii)中被提取出来的。ChR2通过调节植物鞭毛功能使单细胞藻类能够寻找周围的光,从而藻类实现光合作用并存活。这种植物行为反应已经被研究了150多年。近年来,通过改变ChR2的离子、结构、动力和波谱,这种视蛋白的功能重新被认识并广泛用于光遗传学技术[4]。Volkov等[5]应用X射线衍射分析技术成功地解析出ChR2蛋白的结构。Govorunova等[6]首先在藻类中发现了光控负离子通道视蛋白,它通过光控氯离子转导使神经元沉默,提供了更加敏感和高效的膜超极化工具。最近研究发现,藻类中阳离子转导的ChR2较盐视紫红质蛋白(halorhodopsin)或细菌视紫红质蛋白更加同源。Sineshchekov等[7]分析了红藻阳离子转导的ChR2中光流和光化学之间的转换。研究发现,红藻阳离子转导的ChR2具有细菌视紫红质蛋白样的机制调控阳离子电导。Ca2+释放通道可以非侵入性的调节Ca2+信号,具有快速可逆性和超时空分辨率[8],而光敏通道蛋白CoChR添加一个红藻氨酸受体KA2残基组成的soCoChR可以集中在神经细胞的细胞体中,避免了轴突和树突对周边神经细胞的干扰。另外,soCoChR与双光子计算机生成全息技术的结合成功提高了现有光遗传学技术的精确度,实现了对单个神经元的光敏操作,并将响应时间压缩至1毫秒内[9]。非ChR2包括一种称之为磁系统的光遗传学工具,后者通过Tiam1和PIP3信号转导来控制细胞膜动力学[10]。
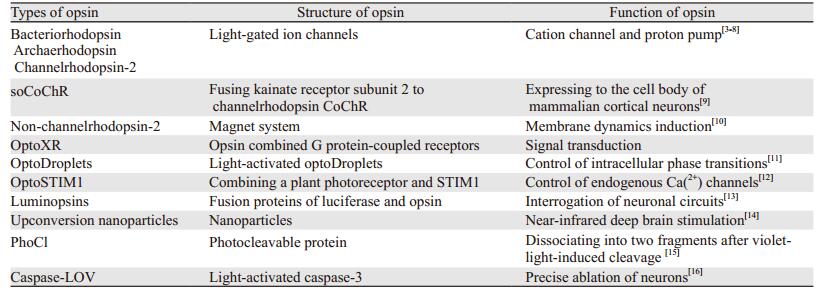
结合型视蛋白是近年来新兴起的光遗传学工具,包括视蛋白结合G蛋白偶联受体的optoXR、视蛋白结合SNAP和CLIP蛋白标记构建的光控代谢型谷氨酸受体、光激活蛋白滴、植物光受体联合STIM1以及光遗传学探针和荧光素酶融合产生的融合蛋白luminopsins等[11-13]。可见光不能穿透深部脑组织,因此限制了光遗传学的应用。Chen等[14]应用上转换纳米颗粒吸收穿透脑组织的近红外光并发射不同波长的可见光,从而激活大脑不同区域的神经元和记忆细胞。这种上转换纳米颗粒可以作为经颅近红外光的光遗传学激动剂,用于非侵入性神经元的精准调控。光裂解蛋白在蓝紫光作用下可以分离为两个片段,从而解除被锁定靶蛋白的抑制功能。光裂解蛋白用于控制光激活的Cre重组酶、Ga14转录因子和一个病毒蛋白酶,开启Pannexin-1的大孔径离子通道[15]。光激活的Caspase-3可以通过诱导细胞凋亡实现对细胞的时空调控[16]。表 1概括了常见视蛋白的种类、结构和主要功能。
Ingles-Prieto等[17]研发出了光激活的受体酪氨酸激酶,控制肿瘤细胞增殖、上皮间质转化、血管生成和肿瘤进展。光遗传学治疗肿瘤的作用机制主要包括操纵神经元活动、解除免疫抑制、改变细胞内外电压、控制细胞力、调控信号转导、遗传和表观遗传调节以及筛选抗肿瘤药物。
2.1 操纵神经元活动最近的研究发现去神经能够抑制肿瘤生长和转移,提示神经依赖在肿瘤发生发展中的作用。肿瘤神经生物学开启了肿瘤整合治疗的一扇新窗口[18]。神经元可以激活脑、皮肤、前列腺、胰腺和胃等肿瘤的生长,调节肿瘤微环境和干细胞活性,因此神经调节是一个新兴的肿瘤研究领域[19]。光遗传学利用光照射细胞快速启动或终止目的基因表达,从而操纵神经元活动[20]。将光敏蛋白引入小鼠大脑皮层,然后植入人类高级别胶质瘤细胞,发现光激活肿瘤附近的神经元促进了肿瘤的增殖和生长[21]。融合蛋白体外底物存在时通过生物光激活神经元,体内除了物理光还可由生物光控制神经元活性,使光遗传学在肿瘤治疗的临床应用成为可能[13]。
2.2 解除免疫抑制光遗传学技术精准遥控免疫反应已经取得了长足进步,这包括通过光激活的趋化因子受体和钙离子释放激活通道调节淋巴细胞迁移、炎性小体激活、树突状细胞成熟和抗肿瘤免疫。非侵入性光敏上转换纳米颗粒进一步提高了光对活生物体免疫信号网络的精准调控和临床应用[22]。Xu等[23]报道了一种光激活的趋化因子CXC受体4(Photoactivatable-chemokine C-X-C motif receptor 4, PA-CXCR4)控制T细胞迁移。PA-CXCR4在505 nm光照下转导细胞内CXCR4信号,诱导T细胞极化和迁移。研究显示,光照下的黑色素瘤可以有效地招募表达PA-CXCR4的靶向肿瘤的细胞毒性T细胞,提高过继性T细胞免疫治疗的临床效果,显著抑制黑色素瘤生长。He等[24]报道了非侵入性光激活钙离子通道Opto-CRAC可以选择性控制Ca2+流动和Ca2+反应相关基因表达,从而调节非兴奋性细胞的功能,包括T淋巴细胞、巨噬细胞核树突状细胞等。当联合上转换纳米颗粒,激活光谱从可见光转变为近红外光,从而实现Ca2+信号通路的无线激活和光遗传学的免疫炎性反应调节。三磷酸肌醇蛋白和调节性T细胞可以抑制细胞毒性T淋巴细胞的杀伤功能,而抑制三磷酸肌醇蛋白能导致T细胞受体依赖的细胞内Ca2+浓度降低。转染了通道蛋白基因的细胞毒性T淋巴细胞在接受光照后,Ca2+从细胞外流入细胞内,自然解除了调节性T细胞的抑制[25]。
2.3 改变细胞内外电压正常细胞的细胞内部较外部保持着更大的负电压,打开或关闭细胞膜中的离子通道能够导致细胞去极化或极化。Chernet等[26]将编码突变RAS癌基因的RNA注射液注射入非洲爪蟾胚胎细胞,其中已知这种突变RAS癌基因导致类似癌症的生长。研究人员也激活了一种蓝光激活的正电压离子通道ChR2D156A,或者一种绿光激活的古紫质蛋白。无论激活ChR2D156A还是激活古紫质蛋白,都会让胚胎细胞从肿瘤的去极化状态转化为正常的更加负性的极化状态,从而显著降低肿瘤发生率。由植物光受体联合Ca2+释放通道调节剂STIM1构成的OptoSTIM1可以激活Ca2+释放通道,操纵不同生物系统内Ca2+水平[12]。
2.4 控制细胞力Dagliyan等[27]应用光敏调控活细胞中不同蛋白质活性,这种光敏域成为“变构开关”。光敏域插入运动信号蛋白(激酶、鸟苷三磷酸酶或鸟嘌呤交换因子)控制信号蛋白活态和非活态构象之间的转换,同时调节活细胞的动力学。收缩力是细胞迁移、分裂和肿瘤侵袭的执行者。Valon等[28]报道了光遗传学工具精准上调和下调收缩力,该工具应用CRY2/CIBN光控系统控制亚细胞内RhoA激活。研究者将RhoA激活剂ARHGEF11的催化区域整合CRY2-mCherry(optoGEF-RhoA),并通过基因工程技术连接CIBN至细胞质膜或线粒体膜。移位至胞膜的optoGEF-RhoA引起细胞牵引力、张力和组织压力增加,而移位至线粒体膜的作用相反。另外,一种光控的蛋白二聚体化学诱导剂也能操控检查点信号和分子“马达”活性[29]。
2.5 调控信号转导信号转导是细胞的基本功能,以往的信号转导研究更多依赖药理抑制、RNA干扰和蛋白调控等。应用非ChR2光遗传学工具可以控制不同的信号转导功能,例如细胞胞膜动力、钙离子信号、脂质信号和凋亡[30]。另外,传统的化学刺激可以实现声音信号转导,但在时空方面不能实现转导,光遗传学技术可以实现对代谢酶的精准调控。Zhao等[31]利用光遗传学技术调控酵母从光诱导的生长期向黑暗诱导的生产期转变,从而控制线粒体异丁醇通路,从葡萄糖中生产出更多的异丁醇和2-甲基-1-丁醇。
2.6 调节基因和表观遗传核质转运是真核细胞蛋白调控的主要机制。Niopek等[32]建立了光控的核蛋白转出技术精准调控核蛋白的转出,实现光对人类抑癌基因p53转录活性的控制。Reis等[33]报道了称之为“表观遗传的光控基因调节”技术,该技术通过可见光控制组蛋白乙酰化实现高通量的基因表观遗传调节。
2.7 控制蛋白激酶活性光可以抑制、激活或维持细胞信号通路和细胞事件、控制基因遗传和表观遗传并调节细胞命运和转化,因此将彻底改变肿瘤药物的研究和发现[34]。Inglés-Prieto等[35]利用光遗传学方法筛选小分子蛋白酶抑制剂,这种方法不需要化学活化剂并减少了合成步骤。一种称之为光激酶的光遗传学方法利用光激活或抑制不同的蛋白激酶,这种光遗传学调节可以快速、可逆并非侵入地控制蛋白激酶活性,从而筛选蛋白激酶抑制剂[36]。另外,光调控肿瘤驱动基因的突变,从而影响分子靶向药物的疗效和应用。
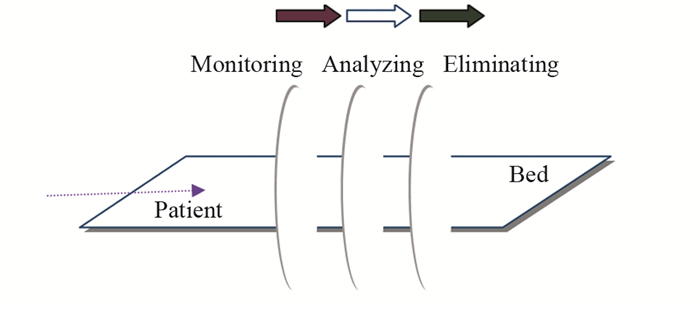
3 肿瘤光遗传学治疗的未来方向科学技术的发展将使肿瘤能像结核一样被治愈。未来不仅能实时监控人体中的随机突变,还能精准免疫清除人体的突变细胞,甚至通过光刺激改变肿瘤细胞行为,这一切都使肿瘤的治疗变得简单,见图 1。
|
| 图 1 未来将设计一种肿瘤光诊疗仪器通过光对人体肿瘤细胞实施监控、分析和清除的功能 Figure 1 A new optogenetic tool allows monitoring, analyzing and eliminating human cancer cells with light |
现在,光遗传学不仅作为一个研究工具,更多用在包括肿瘤在内的多种疾病诊断和治疗。肿瘤的光遗传学已经用于控制肿瘤发生[26]、诱导肿瘤细胞凋亡[14]和肿瘤免疫治疗[25],肿瘤的光遗传学治疗前途光明。
| [1] | Boyden ES, Zhang F, Bamberg E, et al. Millisecond-timescale, genetically targeted optical control of neural activity[J]. Nat Neurosci, 2005, 8(9): 1263–8. DOI:10.1038/nn1525 |
| [2] | Kushibiki T, Ishihara M. Application of Optogenetics in Gene Therapy[J]. Curr Gene Ther, 2018, 18(1): 40–4. DOI:10.2174/1566523218666180302163814 |
| [3] | Nango E, Royant A, Kubo M, et al. A three-dimensional movie of structural changes in bacteriorhodopsin[J]. Science, 2016, 354(6319): 1552–7. DOI:10.1126/science.aah3497 |
| [4] | Deisseroth K, Hegemann P. The form and function of channelrhodopsin[J]. Science, 2017, 357(6356): pii: eaan5544. DOI:10.1126/science.aan5544 |
| [5] | Volkov O, Kovalev K, Polovinkin V, et al. Structural insights into ion conduction by channelrhodopsin 2[J]. Science, 2017, 358(6366): pii: eaan8862. DOI:10.1126/science.aan8862 |
| [6] | Govorunova EG, Sineshchekov OA, Janz R, et al. NEUROSCIENCE. Natural light-gated anion channels:A family of microbial rhodopsins for advanced optogenetics[J]. Science, 2015, 349(6248): 647–50. DOI:10.1126/science.aaa7484 |
| [7] | Sineshchekov OA, Govorunova EG, Li H, et al. Bacteriorhodopsin-like channelrhodopsins: Alternative mechanism for control of cation conductance[J]. Proc Natl Acad Sci U S A, 2017, 114(45): E9512–9. DOI:10.1073/pnas.1710702114 |
| [8] | Ma G, Wen S, He L, et al. Optogenetic toolkit for precise control of calcium signaling[J]. Cell Calcium, 2017, 64: 36–46. DOI:10.1016/j.ceca.2017.01.004 |
| [9] | Shemesh OA, Tanese D, Zampini V, et al. Temporally precise single-cell-resolution optogenetics[J]. Nat Neurosci, 2017, 20(12): 1796–806. DOI:10.1038/s41593-017-0018-8 |
| [10] | Ueda Y, Sato M. Cell membrane dynamics induction using optogenetic tools[J]. Biochem Biophys Res Commun, 2017: pii: S0006-291X(17)32269-6. |
| [11] | Shin Y, Berry J, Pannucci N, et al. Spatiotemporal Control of Intracellular Phase Transitions Using Light-Activated optoDroplets[J]. Cell, 2017, 168(1-2): 159–71. DOI:10.1016/j.cell.2016.11.054 |
| [12] | Kyung T, Lee S, Kim JE, et al. Optogenetic control of endogenous Ca(2+) channels in vivo[J]. Nat Biotechnol, 2015, 33(10): 1092–6. DOI:10.1038/nbt.3350 |
| [13] | Berglund K, Clissold K, Li HE, et al. Luminopsins integrate opto- and chemogenetics by using physical and biological light sources for opsin activation[J]. Proc Natl Acad Sci U S A, 2016, 113(3): E358–67. DOI:10.1073/pnas.1510899113 |
| [14] | Chen S, Weitemier AZ, Zeng X, et al. Near-infrared deep brain stimulation via upconversion nanoparticle-mediated optogenetics[J]. Science, 2018, 359(6376): 679–84. DOI:10.1126/science.aaq1144 |
| [15] | Zhang W, Lohman AW, Zhuravlova Y, et al. Optogenetic control with a photocleavable protein, PhoCl[J]. Nat Methods, 2017, 14(4): 391–4. DOI:10.1038/nmeth.4222 |
| [16] | Smart AD, Pache RA, Thomsen ND, et al. Engineering a light-activated caspase-3 for precise ablation of neurons in vivo[J]. Proc Natl Acad Sci U S A, 2017, 114(39): E8174–83. DOI:10.1073/pnas.1705064114 |
| [17] | Ingles-Prieto A, Reichhart E, Schelch K, et al. The optogenetic promise for oncology: Episode I[J]. Mol Cell Oncol, 2014, 1(4): e964045. DOI:10.4161/23723548.2014.964045 |
| [18] | Boilly B, Faulkner S, Jobling P, et al. Nerve Dependence: From Regeneration to Cancer[J]. Cancer Cell, 2017, 31(3): 342–54. DOI:10.1016/j.ccell.2017.02.005 |
| [19] | Venkatesh H, Monje M. Neuronal Activity in Ontogeny and Oncol-ogy[J]. Trends Cancer, 2017, 3(2): 89–112. DOI:10.1016/j.trecan.2016.12.008 |
| [20] | 张百红, 岳红云. 大脑对肿瘤发生和发展的影响[J]. 肿瘤, 2016, 36(10): 1183–6. [ Zhang BH, Yue HY. Effects of brain on oncogenesis and development[J]. Zhong Liu, 2016, 36(10): 1183–6. ] |
| [21] | Venkatesh HS, Johung TB, Caretti V, et al. Neuronal Activity Promotes Glioma Growth through Neuroligin-3 Secretion[J]. Cell, 2015, 161(4): 803–16. DOI:10.1016/j.cell.2015.04.012 |
| [22] | Tan P, He L, Han G, et al. Optogenetic Immunomodulation: Shedding Light on Antitumor Immunity[J]. Trends Biotechnol, 2017, 35(3): 215–26. DOI:10.1016/j.tibtech.2016.09.002 |
| [23] | Xu Y, Hyun YM, Lim K, et al. Optogenetic control of chemokine receptor signal and T-cell migration[J]. Proc Natl Acad Sci U S A, 2014, 111(17): 6371–6. DOI:10.1073/pnas.1319296111 |
| [24] | He L, Zhang Y, Ma G, et al. Near-infrared photoactivatable control of Ca(2+) signaling and optogenetic immunomodulation[J]. Elife, 2015, 4: pii: e10024. DOI:10.7554/eLife.10024 |
| [25] | Kim KD, Bae S, Capece T, et al. Targeted calcium influx boosts cytotoxic T lymphocyte function in the tumourmicroenvironment[J]. Nat Commun, 2017, 8: 15365. DOI:10.1038/ncomms15365 |
| [26] | Chernet BT, Adams DS, Lobikin M, et al. Use of genetically encoded, light-gated ion translocators to control tumorigenesis[J]. Oncotarget, 2016, 7(15): 19575–88. |
| [27] | Dagliyan O, Tarnawski M, Chu PH, et al. Engineering extrinsic disorder to control protein activity in living cells[J]. Science, 2016, 354(6318): 1441–4. DOI:10.1126/science.aah3404 |
| [28] | Valon L, Marín-Llauradó A, Wyatt T, et al. Optogenetic control of cellular forces and mechanotransduction[J]. Nat Commun, 2017, 8: 14396. DOI:10.1038/ncomms14396 |
| [29] | Zhang H, Aonbangkhen C, Tarasovetc EV, et al. Optogenetic control of kinetochore function[J]. Nat Chem Biol, 2017, 13(10): 1096–101. DOI:10.1038/nchembio.2456 |
| [30] | Ueda Y, Sato M. Induction of signal transduction using non-channelrhodopsin-type optogenetic tools[J]. Chembiochem, 2018, 19(12): 1217–31. DOI:10.1002/cbic.v19.12 |
| [31] | Zhao EM, Zhang Y, Mehl J, et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production[J]. Nature, 2018, 555(7698): 683–7. DOI:10.1038/nature26141 |
| [32] | Niopek D, Wehler P, Roensch J, et al. Optogenetic control of nuclear protein export[J]. Nat Commun, 2016, 7: 10624. DOI:10.1038/ncomms10624 |
| [33] | Reis SA, Ghosh B, Hendricks JA, et al. Light-controlled modulation of gene expression by chemical optoepigenetic probes[J]. Nat Chem Biol, 2016, 12(5): 317–23. DOI:10.1038/nchembio.2042 |
| [34] | Kiełbus M, Czapiński J, Odrzywolski A, et al. Optogenetics in cancer drug discovery[J]. Expert Opin Drug Discov, 2018, 13(5): 459–72. DOI:10.1080/17460441.2018.1437138 |
| [35] | Inglés-Prieto Á, Reichhart E, Muellner MK, et al. Light-assisted small-molecule screening against protein kinases[J]. Nat Chem Biol, 2015, 11(12): 952–4. DOI:10.1038/nchembio.1933 |
| [36] | Leopold AV, Chernov KG, Verkhusha VV. Optogenetically controlled protein kinases for regulation of cellular signaling[J]. Chem Soc Rev, 2018, 47(7): 2454–84. DOI:10.1039/C7CS00404D |
 2018, Vol. 45
2018, Vol. 45