文章信息
- KIF3A在不同病变胃组织及淋巴结转移灶中的表达及其与胃腺癌转移和预后的关系
- Expression of KIF3A in Different Gastric Mucosal Lesions, Metastatic Lymph Nodes and Its Relationship with Metastasis and Prognosis of Gastric Adenocarcinoma
- 肿瘤防治研究, 2018, 45(12): 985-990
- Cancer Research on Prevention and Treatment, 2018, 45(12): 985-990
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0627
- 收稿日期: 2018-07-09
- 修回日期: 2018-08-23
2. 266003 青岛,青岛大学附属医院病理科
2. Department of Pathology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China
胃癌是常见的恶性肿瘤之一,其发病率在全球位居第四位,死亡率仅次于肺癌、肝癌[1-2]。大多数的胃癌为腺癌[3],在我国胃癌是癌性相关死亡的第二大原因[4]。近年来,尽管胃癌的治疗手段有所提高,但胃癌患者的预后仍较差,主要由于胃癌的侵袭转移能力较强,多数患者发现时已处于晚期[3, 5-6]。目前胃癌发生转移的机制尚不十分明确,因此,探讨胃癌侵袭转移及预后的有效标志物具有重要的临床意义。
驱动蛋白超家族蛋白(KIFs)是一类微管动力蛋白,其头部具有ATP酶的活性,利用水解ATP产生的能量沿着微管运动,参与多种细胞过程[7-8]。KIF3A是驱动蛋白2的亚基,属于微管正端导向的马达蛋白[7, 9]。有研究报道,KIF3A与前列腺癌、髓母细胞瘤、非小细胞肺癌及甲状腺癌的发生、发展有关[10-13];但是关于KIF3A对胃腺癌的影响目前尚未见报道。本研究主要通过检测KIF3A在不同病变胃组织、胃腺癌及淋巴结转移灶中的表达情况,分析其与胃腺癌临床病理特征的关系及对生存预后的影响,旨在探讨KIF3A对胃腺癌侵袭转移及预后的意义。
1 资料与方法 1.1 临床资料收集2012年青岛大学附属医院病理科手术切除的胃腺癌标本118例(19例早期胃腺癌,99例进展期胃腺癌),包括胃腺癌及其癌旁相对正常组织(距肿瘤边缘≥5 cm)及其中的39例进展期胃腺癌相应转移淋巴结组织。收集99例慢性胃炎、12例低级别上皮内瘤变、12例高级别上皮内瘤变的标本。所有胃腺癌患者术前均未进行任何放化疗,且临床病理资料完整。对所有胃腺癌患者定期进行生存随访,随访时间截至2017年12月31日,90例(进展期胃癌)有完整的随访资料,其中41例患者死亡,34例患者发生了术后转移复发。所有切片均经两名病理医师复诊。本实验经青岛大学附属医院伦理委员会批准。
1.2 实验方法 1.2.1 组织芯片制作由两位病理医师对所有蜡块进行复片,显微镜下选取典型区域并标记,用细针对受体蜡块进行打孔,孔径为1.5 mm,在供体蜡块标记的相应部位采集组织芯,将其移至受体蜡块的孔中,53℃融合后,4 μm连续切片。组织芯片经HE染色后,再由病理医师确认。
1.2.2 免疫组织化学法采用PV6000法进行免疫组织化学检测,所有石蜡包埋组织,切片(4 μm)经脱蜡、水化过程后,灭活内源性过氧化物酶,微波热修复法进行抗原修复(EDTA, pH8.0),滴加KIF3A抗体(英国Abcam公司,ab11259),稀释浓度1:200, 37℃ 2 h,滴加二抗(PV-6000购于北京中杉金桥生物技术有限公司),37℃ 30 min,DAB显色,苏木精对比染色。以PBS缓冲液代替一抗作为阴性对照,已知阳性表达的前列腺癌组织作为阳性对照。
1.3 免疫组织化学结果判读标准KIF3A蛋白的阳性表达为细胞质、细胞核呈黄色或棕黄色。判读方法和标准参考[10, 14]按细胞着色强度和阳性细胞百分比进行计分,按着色强度计分:无着色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分。KIF3A染色得分=着色强度得分×阳性细胞百分比,< 2分为低表达,≥2分为高表达。
1.4 统计学方法所有数据均采用SPSS23.0软件进行统计学分析。KIF3A在不同病变组织中的表达采用Wilcoxon秩和检验和Kruskal-Wallis秩和检验法;KIF3A的表达与临床病理特征的关系采用χ2检验的统计学方法;生存分析采用Kaplan-Meier生存分析法,Log rank检验;独立预后因素采用Cox回归模型分析。P < 0.05为差异有统计学意义。
2 结果 2.1 KIF3A在胃腺癌组织中的表达免疫组织化学结果显示,在胃腺癌及癌旁相对正常组织中KIF3A主要在细胞质中表达,且在胃腺癌组织中可见核中表达,见图 1。118例胃腺癌组织中,51例呈高表达,67例呈低表达;而相应癌旁组织中,24例呈高表达,94例呈低表达。KIF3A在胃腺癌及癌旁相对正常组织中的表达差异具有统计学意义(P=0.001),见表 1。

|
| A, C: gastric adenocarcinoma tissues; B, D: adjacent normal tissues (A, B: HE staining; C, D: IHC staining) (×200) 图 1 KIF3A在胃腺癌与癌旁相对正常组织中的表达 Figure 1 Expression of KIF3A in gastric adenocarcinoma and adjacent normal tissues |

|
在99例慢性胃炎组织中,16例高表达,12例低级别上皮内瘤变与12例高级别上皮内瘤变组织中分别为8例、9例呈高表达,KIF3A在低级别上皮内瘤变、高级别上皮内瘤变中的表达均高于慢性胃炎(P < 0.01);而胃腺癌与低级别上皮内瘤变、高级别上皮内瘤变中KIF3A表达的差异并无统计学意义(P > 0.05),见图 2F~I、表 2。
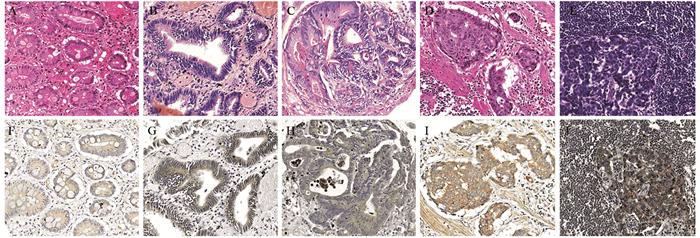
|
| A, F: chronic gastritis; B, G: low-grade intraepithelial neoplasia; C, H: high-grade intraepithelial neoplasia; D, I: stomach adenocarcinoma; E, J: lymph node metastasis of advanced gastric adenocarcinoma (A, B, C, D, E: HE staining; F, G, H, I, J: IHC staining) (×200) 图 2 KIF3A在不同病变胃组织及转移淋巴结中的表达 Figure 2 Expression of KIF3A in different gastric lesions and lymph node metastasis |
39例进展期胃腺癌组织中,24例呈高表达,而其相应淋巴结转移灶中,31例呈高表达,KIF3A在进展期胃腺癌原发灶与相应淋巴结转移灶中的表达差异具有统计学意义(P=0.004),见图 2I~J、表 3。
|
通过分析发现TNM分期为Ⅲ~Ⅳ期胃腺癌组织中的高表达率明显高于Ⅰ~Ⅱ期患者(56.52% vs. 26.67%, P < 0.01);淋巴结转移、脉管侵犯的胃腺癌组织中的高表达率分别高于无淋巴结转移、无脉管侵犯患者(55.41% vs. 24%; 62.50% vs. 40.30%, P < 0.05),而其表达水平与患者的性别、年龄、分化程度、肿瘤大小、浸润深度无关(P > 0.05),见表 4。

|
对90例有随访资料的进展期胃腺癌患者进行生存分析,发现KIF3A高表达患者的术后总体生存时间与无病生存时间较低表达者更短(P < 0.01),见图 3A~B,高表达组的中位总体生存时间为26月、中位无病生存时间为23月,低表达组的中位总体生存时间为60月、中位无病生存时间为60月。另外,TNM分期为Ⅲ、Ⅳ期的患者中,KIF3A表达水平越高总体生存时间越短(P < 0.01),见图 3C,高表达组的中位总体生存时间为23月,低表达组的中位总体生存时间为60月;在淋巴结转移的进展期胃腺癌患者中,KIF3A高表达患者的术后的总体生存时间明显低于低表达组(P < 0.01),见图 3D,高表达组的中位总体生存时间为24.5月,低表达组的中位总体生存时间为60月。KIF3A的阳性表达部位影响患者的总体生存时间,仅细胞质阳性患者的总体生存时间较细胞质及细胞核均阳性表达者更长(P < 0.05),见图 3E,细胞质及细胞核都阳性表达组的中位总体生存时间为23月,仅细胞质表达组的中位总体生存时间为60月。

|
| A: the relationship between KIF3A expression and overall survival; B: the relationship between KIF3A expression and disease-free survival; C: the relationship between KIF3A expression and overall survival in the patients with TNM stage Ⅲ and Ⅳ; D: the relationship between KIF3A expression and overall survival in the patients with lymph node metastasis; E: the relationship between positive nuclear staining for KIF3A and overall survival 图 3 KIF3A的表达及与患者术后生存时间的关系 Figure 3 Relationship between KIF3A expression and prognosis of gastric adenocarcinoma patients |
单因素回归分析表明,KIF3A的表达水平(P < 0.01)、TNM分期(P < 0.01)、淋巴结转移(P < 0.01)对胃腺癌患者总体生存时间的影响差异均有统计学意义,KIF3A的表达水平(P < 0.01)、浸润深度(P < 0.05)、TNM分期(P < 0.01)、淋巴结转移(P < 0.01)对胃腺癌患者的无病生存时间的影响差异均有统计学意义;Cox多因素回归分析表明,KIF3A的表达与TNM分期是影响胃腺癌患者总体生存时间和无病生存时间的独立预后因素(P < 0.05),见表 5~6。

|

|
KIF3A是1993年从海胆卵中分离出的一种新的驱动蛋白相关蛋白[15]。人KIF3A基因位于5q31[16],其编码的蛋白质主要在胞质中表达,其结构包含一个球状头部及一个杆状尾部,其中头部具有链接微管及结合催化ATP酶的位点。KIF3A是驱动蛋白Ⅱ的亚基,是一种微管正端导向的马达蛋白,在神经元的快速轴浆运输、细胞极性及胶原蛋白三维结构形成等过程中发挥重要作用[17-19]。
关于KIF3A与肿瘤关系的研究相对较少,胃癌方面尚未见研究报道。Liu等[10]研究发现KIF3A在前列腺癌组织及细胞中的表达水平较正常前列腺组织及细胞高。Wang等[13]研究发现甲状腺癌中KIF3A的表达水平明显高于癌旁相对正常组织。本研究结果也显示了KIF3A在胃腺癌中的表达水平明显高于癌旁相对正常组织。另外,本结果还表明KIF3A在低级别上皮内瘤变中的表达水平高于慢性胃炎组,且与高级别上皮内瘤变及腺癌组无差别,提示KIF3A可能参与胃黏膜上皮内瘤变及胃癌的发生。
Liu等[10]研究发现,前列腺癌中KIF3A的表达水平明显升高,其表达水平与TNM分期、Gleason评分、转移有关,并且发现前列腺癌细胞中KIF3A的过表达提高了细胞的增殖能力。另外,Boehlke等[19]研究表明MDCK细胞中四环素诱导的KIF3A缺乏减缓了上皮细胞的迁移。Wang等[13]研究发现甲状腺癌中KIF3A高表达,FTC133细胞中敲除KIF3A抑制细胞的迁移、侵袭过程。本研究发现KIF3A在进展期胃腺癌组织中的表达与淋巴结转移、脉管侵犯及TNM分期有关,提示KIF3A可能参与胃腺癌的侵袭转移过程。另外,我们还分析了部分进展期胃腺癌原发灶与相应淋巴结转移灶中KIF3A的表达水平,发现其在淋巴结转移灶中的表达水平较原发灶高。该结果进一步表明KIF3A与进展期胃腺癌的侵袭转移相关,推测可能与KIF3A促进细胞增殖及迁移有关[10, 13, 19],但其具体机制仍需细胞学实验进一步探讨。
有研究发现,非小细胞肺癌中KIF3A的表达水平明显降低,且KIF3A的表达水平在原发灶与术后复发灶中的表达水平一致;KIF3A表达水平下降导致干细胞标志物OCT4、NANOG和SOX2表达升高,同时发现KIF3A的表达水平越低,患者的总体生存期越短[12]。另有研究发现,OCT4/NANOG/SLUG三阳性的肺腺癌患者预后较差[20]。本研究结果显示:进展期胃腺癌中KIF3A高表达患者的总体生存期及无病生存期较低表达者短;其次,在淋巴结转移的患者中,KIF3A高表达的患者总体生存期较低表达者更短;TNM分期为Ⅲ、Ⅳ期的患者中,KIF3A低表达患者的总体生存期较高表达者更长。有研究曾报道,细胞质与细胞核中均可表达的分子(如Survivin),细胞核有表达时,往往提示肿瘤患者预后不良[21]。同样,本结果显示KIF3A的阳性表达部位与患者的总体生存期相关,即细胞质与细胞核中均有表达的患者总体生存期较仅在细胞质中表达的患者更短,其具体机制尚不清楚,需进一步探讨研究。以上结果提示KIF3A的表达强度及部位均与胃腺癌患者的术后生存期有关。通过Cox回归模型进一步分析,我们发现KIF3A高表达是影响胃腺癌患者总体生存期与无病生存期的独立危险因素。KIF3A高表达的患者,肿瘤组织的转移、侵袭能力较强及预后不良。KIF3A可能成为评价胃腺癌侵袭转移及预后的一种新的有效标志物。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–864. DOI:10.1002/ijc.29210 |
| [2] | Nam S, Chung JW, Yang JY. WNT5A Correlates with Clinicopathological Characteristics in Gastric Cancer: a Meta-Analysis[J]. Cell Physiol Biochem, 2017, 41(1): 33–40. DOI:10.1159/000455934 |
| [3] | Van Cutsem E, Sagaert X, Topal B, et al. Gastric cancer[J]. Lancet, 2016, 388(10060): 2654–64. DOI:10.1016/S0140-6736(16)30354-3 |
| [4] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [5] | Liu HS, Xiao HS. MicroRNAs as potential biomarkers for gastric cancer[J]. World J Gastroenterol, 2014, 20(34): 12007–17. DOI:10.3748/wjg.v20.i34.12007 |
| [6] | Yasuda K, Shiraishi N, Suematsu T, et al. Rate of detection of lymph node metastasis is correlated with the depth of submucosal invasion in early stage gastric carcinoma[J]. Cancer, 2015, 85(10): 2119–23. |
| [7] | Hirokawa N, Noda Y. Intracellular Transport and Kinesin Superfamily Proteins, KIFs: Structure, Function, and Dynamics[J]. Physiol Rev, 2008, 88(3): 1089–118. DOI:10.1152/physrev.00023.2007 |
| [8] | Sablin EP. Kinesins and microtubules: their structures and motor mechanisms[J]. Curr Opin Cell Biol, 2000, 12(1): 35–41. |
| [9] | Andreasson JO, Shastry S, Hancock WO, et al. The Mechanochemical Cycle of Mammalian Kinesin-2 KIF3A/B under Load[J]. Curr Biol, 2015, 25(9): 1166–75. DOI:10.1016/j.cub.2015.03.013 |
| [10] | Liu Z, Rebowe RE, Wang Z, et al. KIF3a Promotes Proliferation and Invasion via Wnt Signaling in Advanced Prostate Cancer[J]. Mol Cancer Res, 2014, 12(4): 491–503. DOI:10.1158/1541-7786.MCR-13-0418 |
| [11] | Barakat MT, Humke EW, Scott MP. Kif3a is necessary for initiation and maintenance of medulloblastoma[J]. Carcinogenesis, 2013, 34(6): 1382–92. DOI:10.1093/carcin/bgt041 |
| [12] | Kim M, Suh YA, Oh JH, et al. Corrigendum: KIF3A binds to β-arrestin for suppressing Wnt/β-catenin signalling independently of primary cilia in lung cancer[J]. Sci Rep, 2017, 7: 46773. DOI:10.1038/srep46773 |
| [13] | Wang SC, Hu Z, Chai DS, et al. Knockdown of KIF3a inhibits hypoxia-induced epithelial-to-mesenchymal transition via suppression of the Wnt/β-catenin pathway in thyroid cancer[J]. Int J Clin Exp Pathol, 2016, 9(2): 1014–21. |
| [14] | Duan H, Zhang X, Wang FX, et al. KIF-2C expression is correlated with poor prognosis of operable esophageal squamous cell carcinoma male patients[J]. Oncotarget, 2016, 7(49): 80493–507. |
| [15] | Cole DG, Chinn SW, Wedaman KP, et al. Novel heterotrimeric kinesin-related protein purified from sea urchin eggs[J]. Nature, 1993, 366(6452): 268–70. DOI:10.1038/366268a0 |
| [16] | Kim JH, Cha JY, Cheong HS, et al. KIF3A, a Cilia Structural Gene on Chromosome 5q31, and Its Polymorphisms Show an Association with Aspirin Hypersensitivity in Asthma[J]. J Clin Immunol, 2011, 31(1): 112–21. |
| [17] | Takeda S, Yamazaki H, Seog DH, et al. Kinesin superfamily protein 3 (KIF3) motor transports fodrin-associating vesicles important for neurite building[J]. J Cell Biol, 2000, 148(6): 1255–65. DOI:10.1083/jcb.148.6.1255 |
| [18] | Nishimura T, Kato K, Yamaguchi T, et al. Role of the PAR-3-KIF3 complex in the establishment of neuronal polarity[J]. Nat Cell Biol, 2004, 6(4): 328–34. DOI:10.1038/ncb1118 |
| [19] | Boehlke C, Kotsis F, Buchholz B, et al. Kif3a guides microtubular dynamics, migration and lumen formation of MDCK cells[J]. PLoS One, 2013, 8(5): e62165. DOI:10.1371/journal.pone.0062165 |
| [20] | Chiou SH, Wang ML, Chou YT, et al. Coexpression of Oct4 and Nanog enhances malignancy in lung adenocarcinoma by inducing cancer stem cell-like properties and epithelial-mesenchymal transdifferentiation[J]. Cancer Res, 2010, 70(24): 10433–44. DOI:10.1158/0008-5472.CAN-10-2638 |
| [21] | Shinohara ET, Gonzalez A, Massion PP, et al. Nuclear survivin predicts recurrence and poor survival in patients with resected nonsmall cell lung carcinoma[J]. Cancer, 2005, 103(8): 1685–92. DOI:10.1002/(ISSN)1097-0142 |
 2018, Vol. 45
2018, Vol. 45



