文章信息
- 长链非编码RNA ZNF667-AS1在食管鳞状细胞癌组织中的表达及其DNA甲基化状态的研究
- Expression and DNA Methylation Status of Long Non-coding RNA ZNF667-AS1 in Esophageal Squamous Cell Carcinoma Tissues
- 肿瘤防治研究, 2018, 45(12): 976-980
- Cancer Research on Prevention and Treatment, 2018, 45(12): 976-980
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0586
- 收稿日期: 2018-05-02
- 修回日期: 2018-07-10
2. 056001 邯郸,河北省邯郸市中心医院胸外科
2. Department of Thoracic Surgery, Handan Central Hospital, Handan 056001, China
ZNF667-AS1基因,又名MORT,是ZNF667基因的反义链,ZNF667基因属于锌指蛋白C2H2家族成员之一。研究表明ZNF667-AS1基因为抑癌基因,其在肿瘤中的低表达与其启动子区高甲基化状态密切相关[1]。目前关于ZNF667-AS1基因与ESCC关系的研究报道较少,在ESCC中的表观遗传学变化及功能尚不清楚,本研究检测了ZNF667-AS1基因在食管癌细胞和组织中的表达,分析了其与各区域甲基化状态的相关性,并结合临床资料探讨ZNF667-AS1基因在ESCC发生发展中的作用。
1 资料与方法 1.1 资料 1.1.1 主要试剂反转录试剂盒(美国Promega公司);蓝色体系(北京康为世纪公司);DNA纯化试剂盒(德国Qiagen公司);胎牛血清(美国BI公司);RPMI1640培养基(美国Gibco公司);5-氮杂-2’-脱氧胞苷(美国Gibco公司);蛋白酶K(美国Ambion公司);TRIzol(北京索莱宝公司);所有引物均在北京捷瑞基因技术有限公司合成。
1.1.2 食管癌细胞系的培养Kyse170、Eca109、TE1和TE13(由河北医科大学第四医院肿瘤研究所病理研究室保留并传代)用含10%胎牛血清的RPMI1640培养液,置于37℃、CO2体积分数为5%的条件下培养。常规培养同时应用DNA甲基转移酶抑制剂5-Aza-dC(浓度5 μmol/L)作用于Kyse170、Eca109、TE1和TE13细胞系后,每24 h更换培养液,培养48 h,72 h后换成全血清培养基培养24 h后收集细胞。
1.1.3 研究对象和标本来源组织标本均来自河北医科大学第四医院生物样本库2014年6月至2016年9月间的食管鳞癌手术患者,共54例。其中男39例,女15例,年龄45~78岁,中位年龄62岁。每例患者均取食管鳞癌原发灶组织及相应癌旁正常组织(距原发灶边缘3~5 cm以上),HE染色确定肿瘤标本均为食管鳞癌组织,癌旁组织为癌旁食管鳞状上皮组织,全部患者术前均未给予任何放、化疗。手术切除标本一部分在新鲜状态下放入液氮冷藏,后转到-80℃低温冰箱保存用来提取RNA与DNA,另一部分标本置于10%福尔马林溶液中固定,常规制作蜡块保存,行HE染色。按照国际抗癌联盟(UICC)标准进行TNM分期:54例肿瘤患者中Ⅰ+Ⅱ期34例(62.9%)、Ⅲ+Ⅳ期20例(37.1%)。按照WHO肿瘤的病理学分级:54例患者中高分化3例(5.6%)、中分化21例(38.9%)、低分化30例(55.5%)。有淋巴结转移者29例(53.7%),无淋巴结转移者25例(46.3%)。
1.2 方法 1.2.1 qPCR法检测在ESCC中ZNF667-AS1基因的表达依据TRIzol试剂说明书提取5-Aza-dC处理前后的食管癌细胞系、ESCC组织和相应癌旁正常组织中的总RNA,并参照反转录试剂盒说明书步骤,将RNA反转录为cDNA,之后以其为模板进行荧光定量PCR扩增,引物、退火温度及产物大小见表 1。以GAPDH作为内参,反应条件为95℃预变性10 min;95℃变性15 s、58℃退火30 s、72℃延伸30 s,共40个循环;72℃延伸7 min。在反应达到阈值的循环数被记录为该组织中ZNF667-AS1基因和GAPDH的CT值。结果采用相对定量法:ΔCT=CTZNF667-AS1-CTGAPDH,ΔΔCT=ΔCT癌组织-ΔCT癌旁组织,以N=2-ΔΔCT表示目的基因的相对表达量,以ΔΔCT > 1表示目的基因在ESCC中低表达。实验重复3次取平均值。

|
首先应用酚/氯仿抽提法提取5-Aza-dC处理前后的食管癌细胞系、ESCC和相应癌旁正常组织中的DNA,利用分光光度仪进行DNA定量。之后用DNA纯化试剂进行纯化。经亚硫酸氢盐处理后,DNA单链中未发生甲基化的“C”转变为“U”,通过随后的PCR将“U”转化为“T”,但亚硫酸氢盐不能使已发生了甲基化的DNA的“C”发生上述转化,根据此原理设计相应的引物,检测该基因是否发生甲基化。运用在线软件Meth Primer预测ZNF667-AS1基因CpG岛情况,结果显示ZNF667-AS1基因有三个CpG岛,长度分别为764、250、509 bp,为了研究不同区域中CpG岛的甲基化状态在食管癌发生发展中的作用,我们分别选取该基因远端、近端启动子区及第一外显子区的CpG岛进行分析。用甲基化特异性引物和非甲基化特异性引物进行PCR扩增,引物序列、退火温度及产物大小见表 1。反应条件为:95℃预变性10 min后,95℃变性45 s、退火45 s、72℃延伸50 s,35个循环后,72℃延伸7 min。MSP扩增产物经2%琼脂糖凝胶电泳,用凝胶电泳成像及GeneSys图像分析系统进行分析。MSP结果可能出现以下几种情况:(1)基因发生完全甲基化:甲基化特异引物扩增出目的条带,而非甲基化特异引物没有扩增出目的条带;(2)基因发生非甲基化:非甲基化特异引物扩增出目的条带,而甲基化引物没有扩增出目的条带;(3)基因发生不完全甲基化:两对引物均有目的条带扩出,按甲基化计入统计分析。甲基化率=(完全甲基化+不完全甲基化)标本数/总的标本数。MSP阴性对照用灭菌双蒸水取代DNA模板进行PCR,为进行MSP检测的质量控制,随机选取10%的标本进行重复试验。
1.3 统计学方法采用SPSS21.0版统计软件进行数据分析,ZNF667-AS1基因在ESCC及相应癌旁正常组织中的表达差异及其与不同临床病理资料分析均采用秩和检验,MSP实验结果与临床病理资料间的关系采用χ2和校正χ2检验,以上均为双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 食管癌细胞中ZNF667-AS1基因的表达情况qPCR结果显示:在未经5-Aza-dC处理的细胞系(Kyse170、Eca109、TE1和TE13)中ZNF667-AS1基因均呈低表达,在5-Aza-dC处理后的四株细胞系中,ZNF667-AS1基因的表达均增高,见图 1。
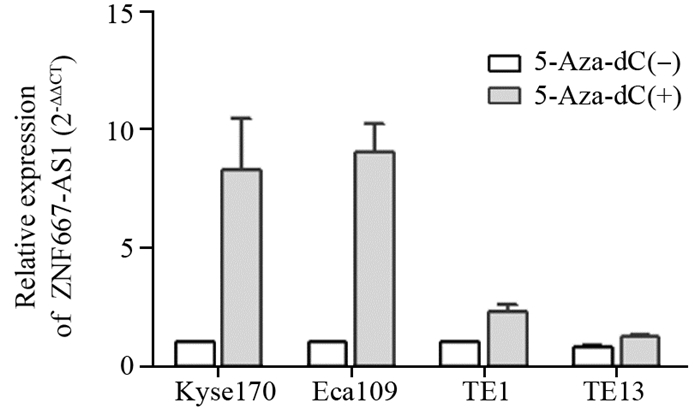
|
| 图 1 5-Aza-dC处理前后食管癌细胞中ZNF667-AS1 mRNA的表达 Figure 1 Expression of ZNF667-AS1 mRNA in esophageal cancer cell lines before and after 5-Aza-dC treatment |
MSP结果显示,5-Aza-dC处理前Kyse170、Eca109、TE1和TE13细胞系中ZNF667-AS1基因CpG岛远端、近端启动子区及第一外显子区均呈高甲基化状态,5-Aza-dC处理后,Kyse170、TE1细胞系中CpG岛远端启动子区甲基化程度均降低,非甲基化程度增高,Eca109及TE13细胞系中该区域表现为非甲基化状态;4株细胞系近端启动子区甲基化程度均降低,表现为非甲基化状态;Kyse170、TE13细胞系在第一外显子区CpG岛甲基化程度降低,非甲基化程度增高,Eca109及TE1细胞系表现为非甲基化状态,见图 2。
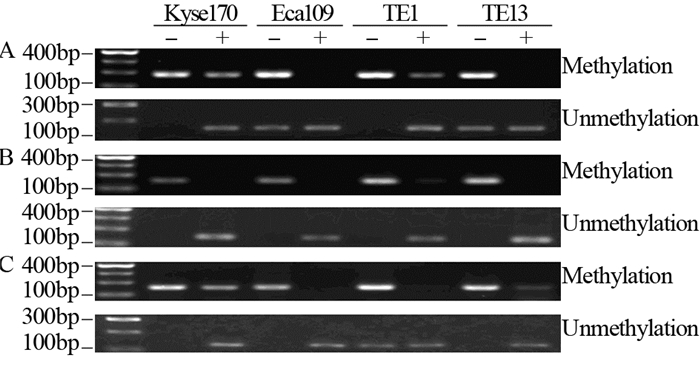
|
| A: distal CpG island; B: the proximal promoter region; C: Exon 1;-: before 5-Aza-dC treatment; +: after 5-Aza-dC treatment 图 2 5-Aza-dC处理前后食管癌细胞系中ZNF667-AS1基因甲基化状态 Figure 2 Methylation of ZNF667-AS1 in esophageal cancer cell lines before and after 5-Aza-dC treatment |
qPCR结果显示,ZNF667-AS1基因在54例ESCC组织中的表达显著低于癌旁正常组织((0.47±0.99)vs.(1.00±0.01), P=0.04),见图 3。结合临床病例资料分析,ZNF667-AS1基因在发生淋巴结转移的ESCC组织中表达低于未发生淋巴结转移的ESCC组织(P=0.04),在低分化组ESCC中的表达低于中高分化组(P=0.02),在Ⅲ期+Ⅳ期ESCC组织的表达低于Ⅰ期+Ⅱ期(P=0.01);按照年龄、性别各自分组进行统计分析,ZNF667-AS1基因的表达差异均无统计学意义,见表 2。
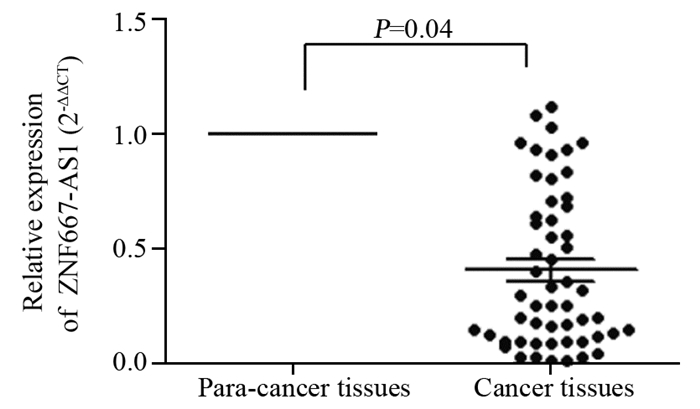
|
| 图 3 ESCC及其相应癌旁正常组织中ZNF667-AS1基因的表达 Figure 3 Expression of ZNF667-AS1 in ESCC and corresponding normal tissues |

|
MSP结果显示,ESCC组织中ZNF667-AS1基因远端、近端启动子区及第一外显子区CpG岛甲基化率明显高于癌旁正常组织(均P=0.00)。结合临床病理特征发现,远端和近端启动子区CpG岛甲基化率在ESCC低分化组组织中显著高于中高分化组(均P=0.00);远端、近端启动子区及第一外显子区CpG岛甲基化率在Ⅲ期+Ⅳ期中显著高于Ⅰ期+Ⅱ期(P=0.01, 0.00, 0.01)。按照年龄、性别及有无淋巴结转移各自分组进行统计分析,各组食管鳞癌组织ZNF667-AS1基因远端和近端启动子区甲基化率差异均无统计学意义;按照年龄、性别、分化程度及有无淋巴结转移各自分组进行统计分析,其第一外显子区甲基化率差异无统计学意义,见表 3。
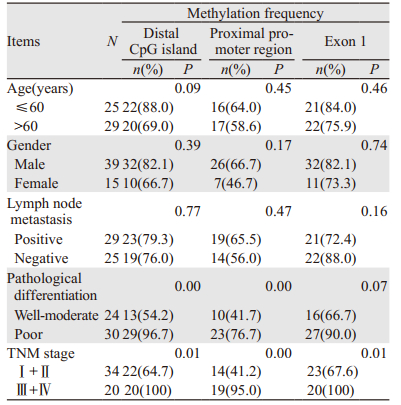
|
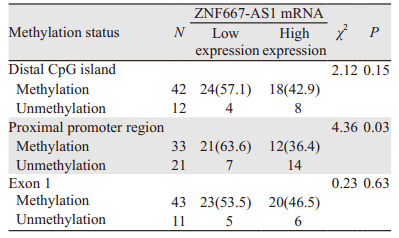
ZNF667-AS1基因远端启动子区和第一外显子区CpG岛发生甲基化的ESCC组织中低表达例数高于高表达例数,差异无统计学意义(P=0.15, 0.63);近端启动子区CpG岛发生甲基化的ESCC组织中低表达例数高于高表达例数,差异具有统计学意义(P=0.03),见表 4。
|
人类基因组包括约20 000种蛋白质编码基因,但仅占总基因的约2%,随着基因微阵列和全基因组转录测序技术的进步证实90%的基因组是可转录的,其转录产物多为非编码RNA(non-coding RNA, ncRNA),而其又可以分为小非编码RNA(small ncRNA, sncRNA)和lncRNAs[2]。LncRNA可直接与DNA甲基转移酶作用,改变DNA的甲基化状态,调控基因的表达[3],如通过高通量测序技术发现的lncRNA DACOR1在结肠癌细胞系中通过与DNMT1相互作用,导致基因组DNA甲基化[4]。研究表明一些lncRNA的异常甲基化模式涉及肿瘤发生发展[5],且已有文献证实,不同区域甲基化状态对基因的转录及翻译有不同影响[6]。
据文献报道,ZNF667基因可通过增强BCL-2及降低BAX蛋白的表达,进而调控肝癌的发生发展[7];在脑缺血的预处理中,ZNF667基因蛋白表达显著升高,从而保护细胞免受缺氧损伤[8]。ZNF667-AS1基因是ZNF667基因的反义链,有研究表明ZNF667基因与ZNF667-AS1基因共用其启动子区大型CpG岛,且二者在肿瘤中表达情况具有一致性[1]。ZNF667-AS1基因位于染色体19q13.43,其mRNA序列具有两个转录本,长度分别为1 837 bp和1 428 bp,其中转录本2包含于转录本1中,我们选取转录本1为主要研究序列。癌症基因组图谱显示ZNF667-AS1基因在17种肿瘤中存在表观遗传学沉默,如乳腺癌、结肠腺瘤、子宫颈癌,且该沉默发生于人类癌变早期,常见于肿瘤的癌前病变[9-10]。
研究者经UCSC序列检索并结合MethPrimer软件预测发现,ZNF667-AS1基因启动子区及第一外显子区的5’端CpG岛情况,结果显示ZNF667-AS1基因转录本1有三个CpG岛,长度分别为764、250、509 bp,本研究分别选取启动子远端、近端启动子区及第一外显子区富含CG的区域进行分析发现,ZNF667-AS1基因在食管癌细胞中低表达,经5-Aza-dC处理后表达升高,且在ESCC组织中ZNF667-AS1基因的mRNA表达量显著低于其相应癌旁正常组织,这一结果提示该基因在ESCC中起抑癌作用。同时发现,在四株食管癌细胞系中,ZNF667-AS1基因的三个区域CpG岛在5-Aza-dC处理前均表现为高甲基化状态,5-Aza-dC处理后甲基化状态降低,这一结果提示甲基化是该基因表达沉默的机制之一。进一步研究发现,在ESCC组织中ZNF667-AS1基因远端、近端启动子区及第一外显子区甲基化率显著高于其相应癌旁正常组织,但仅有近端启动子区甲基化与该基因在ESCC组织中的表达呈明显的负相关,远端和第一外显子区CpG岛甲基化与该基因在ESCC组织中的表达无相关性,因而得出近端启动子区为该基因的关键性CpG区域,近端启动子区DNA甲基化可能是ESCC组织中ZNF667-AS1基因表达下调的主要机制之一,并对该基因的表达起关键的调控作用。
总之,本研究发现ZNF667-AS1基因在ESCC中呈低表达,其表达量与淋巴结转移、组织分化程度、TNM分期高度相关,提示该基因可能参与EMT等相关生物学过程,其机制有待进一步研究。ZNF667-AS1基因在ESCC中沉默与其近端启动子区的异常高甲基化密切相关,该关键性CpG区域的异常高甲基化可能是导致其在ESCC组织中表达下调的重要机制之一。
| [1] | Vrba L, Garbe JC, Stampfer MR, et al. A LincRNA connected to cell mortality and epigenetically-silenced in most common human cancers[J]. Epigenetics, 2015, 10(11): 1074–83. DOI:10.1080/15592294.2015.1106673 |
| [2] | Gibb EA, Brown CJ, Lam WL, et al. The functional role of long non-coding RNA in human carcinomas[J]. Mol Cancer, 2011, 10: 38. DOI:10.1186/1476-4598-10-38 |
| [3] | Lai F, Shiekhattar R. Where long noncoding RNAs meet DNA methylation[J]. Cell Res, 2014, 24(3): 263–4. DOI:10.1038/cr.2014.13 |
| [4] | Merry CR, Forrest ME, Sabers JN, et al. DNMT1-associated long non-coding RNAs regulate global gene expression and DNA methylation in colon cancer[J]. Hum Mol Genet, 2015, 24(21): 6240–53. DOI:10.1093/hmg/ddv343 |
| [5] | Zhi H, Ning S, Li X, et al. A novel reannotation strategy for dissecting DNA methylation patterns of human long intergenic non-coding RNAs in cancers[J]. Nucleic Acids Res, 2014, 42(13): 8258–70. DOI:10.1093/nar/gku575 |
| [6] | Ge MH, Chen C, Xu JJ, et al. Critical regions and spreading of runt-related transcription factor-3 C-phosphate-G(CpG)island methylation in human salivary gland adenoid cystic carcinoma[J]. Hum Pathol, 2011, 42(12): 1862–72. DOI:10.1016/j.humpath.2011.02.003 |
| [7] | Cheng K, Chen Z, Liu L, et al. ZNF667 Serves as a Putative Oncogene in Human Hepatocellular Carcinoma[J]. Cell Physiol Biochem, 2017, 41(6): 2523–33. DOI:10.1159/000475971 |
| [8] | Yuan D, Huang J, Yuan X, et al. Zinc finger protein 667 expression is upregulated by cerebral ischemic preconditioning and protects cell from oxidative stress[J]. Biomed Rep, 2013, 1(4): 534–8. DOI:10.3892/br.2013.124 |
| [9] | Zhao LP, Li RH, Han DM, et al. Independent prognostic Factor of low-expressed LncRNA ZNF667-AS1 for cervical cancer and inhibitory function on the proliferation of cervical cancer[J]. Eur Rev Med Pharmacol Sci, 2017, 21(23): 5353–60. |
| [10] | Vrba L, Futscher BW. Epigenetic silencing of LncRNA MORT in 16 TCGA cancer types[J]. F1000Research, 2018, 7: 211. DOI:10.12688/f1000research |
 2018, Vol. 45
2018, Vol. 45


