文章信息
- δ-三烯生育酚通过上调MicroRNA-34a抑制宫颈癌细胞增殖
- δ-tocotrienol Inhibits Proliferation of Cervical Carcinoma Cells Through Upregulating MicroRNA-34a
- 肿瘤防治研究, 2018, 45(12): 965-969
- Cancer Research on Prevention and Treatment, 2018, 45(12): 965-969
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0523
- 收稿日期: 2018-04-14
- 修回日期: 2018-08-30
MicroRNA(miRNA)是19~25 bp的短的非编码RNA,通过与蛋白复合物一起结合到mRNA分子3′非编码区(3′ untranslated region, 3′UTR)调控靶基因的表达[1]。宫颈癌组织和细胞中异常表达的miRNA影响宫颈癌的发展[2-3]。miR-34a是许多癌症(如神经母细胞瘤、结肠癌和非小细胞肺癌等)发展过程中一个关键的调节因子[4]。在多种癌细胞中发现,miR-34a是抑癌蛋白p53下游因子,诱导细胞周期阻滞、衰老和凋亡[5-9]。有证据表明,在宫颈癌组织和细胞中miR-34a表达下调[10],通过调控多条通路抑制宫颈癌细胞的增殖和侵袭能力[11-12]。因此,宫颈癌组织中miR-34a的失活可能是其发展的一个重要因素。
近年来有研究报道,δ-三烯生育酚具有强大的诱导周期阻滞、激活p53和caspase-8通路、抑制黏附、并且下调原癌基因c-Myc和端粒酶的作用[13]。研究发现,三烯生育酚能作用于多条信号通路,进而影响细胞的生长、生存和增殖能力。而其中δ-三烯生育酚被认为具有最强的抗肿瘤作用[14]。然而,δ-三烯生育酚能否调节宫颈癌细胞生长和宫颈癌的发展及其作用机制仍然不清楚。
本研究旨在探究δ-三烯生育酚能否促进miR-34a表达,并抑制宫颈癌细胞增殖以及miR-34a是否介导δ-三烯生育酚的作用,以期为宫颈癌治疗靶点的识别以及新型辅助治疗药物的研发提供理论参考。
1 材料与方法 1.1 材料和试剂本实验所用人宫颈癌细胞系HeLa购于美国模式培养物保藏所(American Type Culture Collection);DMEM/F12细胞培养基、胎牛血清(FBS)、胰酶、磷酸盐缓冲液(PBS)和双抗(青链霉素)购于美国Hyclone公司;FuGENE HD转染试剂购于美国罗氏公司(Roche Applied Science);miR-34a mimics和inhibitors由广州瑞博生物公司合成;TRIzol购于美国Invitrogen公司;CCK-8细胞增殖检测试剂盒、细胞周期与细胞凋亡检测试剂盒、Western及IP细胞裂解液、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒购于北京碧云天生物技术有限公司;脱脂奶粉购于光明乳业;兔抗人CCND1和GAPDH抗体以及羊抗兔二抗购于美国BioWorld公司;PrimeScript RT reagent kit反转录试剂盒和SYBR Green 1荧光染色购于日本TaKaRa公司;荧光定量所需引物由上海生工生物工程公司合成;D-δ-三烯生育酚购于美国Sigma公司。
1.2 实验方法 1.2.1 细胞培养宫颈癌细胞HeLa用含10%胎牛血清和1%双抗的DMEM/F12培养液培养于5%CO2、37℃培养箱中。细胞90%融合度时进行传代。
1.2.2 细胞活力检测将细胞以5×103的密度接种于96孔板,贴壁12 h后换无血清培养基,分别添加0、5、10、20 μmol/L浓度的δ-三烯生育酚;在培养箱中孵育36 h后换掉培养基并在每个孔中分别加入10 μl CCK-8试剂,轻轻晃匀后继续在培养箱孵育2 h;之后在酶标仪中450 nm波长处读取吸光度(OD值)。
1.2.3 总RNA提取和荧光定量PCR将细胞以1×105的密度接种于12孔板,贴壁12 h后,换无血清培养基并添加相应处理;处理结束后,去掉培养基,加入TRIzol收集细胞,并按照厂家说明书提取细胞总RNA,用微量紫外分光光度计测量RNA浓度和纯度,用1%琼脂糖凝胶电泳检测RNA完整性。将RNA浓度调一致并用反转录试剂盒按照说明将RNA反转录成cDNA;miR-34a和cel-miR-39反转录引物分别为5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAACC-3′和5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCAAGCT-3′。然后以cDNA为模板,用SYBR Green 1荧光染色进行荧光定量PCR扩增;用到的基因特异性引物序列如下:miR-34a上游引物5′-GTGCAGTGGCAGTGTCTTAGC-3′,下游引物5′-GTGCAGGGTCCGAGGT-3′;cel-miR-39上游引物5′-GCGGTCACCGGGTGTAAATC-3′,下游引物5′-GTGCAGGGTCCGAGGT-3′;CCND1上游引物5′-CGTGGCCTCTAAGATGAAGG-3′, 下游引物5′-CTGGCATTTTGGAGAGGAAG-3′;CCNE2上游引物5′-TACGTCACTGATGGTGCTTGC-3′,下游引物5′-ACTGTCCCACTCCAAACCTGA-3′;CDKN1A上游引物5′-GTCAGTTCCTTGTGGAGCCG-3′,下游引物5′-GAAGTTCCATCGCTCACGGG-3′;β-ACTIN上游引物为5′-CGCGAGAAGATGACCCAGAT-3′,下游引物为5′-ACAGCCTGGATAGCAACGTACAT-3′。反应条件为94℃ 5 min,然后94℃ 30 s,60℃ 30 s,72℃ 30 s,共40个循环。miR-34a表达水平用cel-miR-39作内参校正,CCND1、CCNE2、CDKN1A表达水用β-ACTIN作内参校正,结果用2-ΔΔCt方法计算。实验最少独立重复3次。
1.2.4 Western blot检测将细胞以2×105的密度接种于6孔板,处理结束后用Western及IP细胞裂解液裂解细胞,12000 g 4℃离心15 min,收集上清液;用BCA蛋白浓度测定试剂盒测定蛋白浓度;40 μg蛋白用12%SDS-PAGE电泳分离,之后转膜到PVDF膜上;然后用含5%脱脂奶粉的TBST封闭2 h,4℃过夜孵育兔抗人CCND1和GAPDH多克隆抗体(1:2000稀释);吸去一抗,用TBST洗4次,每次10 min;加入辣根过氧化物酶标记的羊抗兔IgG(1:10000稀释)室温孵育2 h;TBST洗4次,每次10 min;最后,用ECL发光显色在Tanon放射自显影仪中显影,并用仪器自带软件采集图像,以GAPDH作为内参照。
1.2.5 流式细胞术将细胞以2×105的密度接种于6孔板,处理结束后,用不含EDTA胰蛋白酶消化收集细胞到1.5 ml离心管,用PBS洗涤1次;加入1 ml 70%乙醇溶液,固定过夜;离心去掉酒精,用PBS重悬洗涤;之后使用细胞周期与细胞凋亡检测试剂盒按照说明进行碘化丙啶(propidium iodide, PI)染色;最后使用流式细胞仪分析各细胞周期的细胞数。
1.2.6 miR-34a mimics和inhibitors转染将细胞以1×105的密度接种于12孔板,贴壁12 h后换无血清培养基,参照FuGENE HD说明书利用FuGENE HD转染试剂分别转染50 nmol/L的miR-34a mimics和inhibitors以及其各自的阴性对照。
1.3 统计学方法用SPSS22.0软件进行统计学分析。所有结果计量数据均以均数±标准差(x±s)表示,两组间方差分析用独立样本t检验,三组或三组以上用Turkey多重比较进行方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 δ-三烯生育酚影响HeLa细胞增殖和miR-34a表达0、5、10、20 μmol/L浓度的δ-三烯生育酚处理HeLa细胞36 h后,CCK-8检测结果显示,10和20 μmol/L δ-三烯生育酚显著降低细胞活力(P < 0.001),并呈浓度依赖趋势,见图 1A。20 μmol/L δ-三烯生育酚处理细胞36 h后Real-time PCR和Western blot结果显示,δ-三烯生育酚处理组CCND1表达显著降低(P=0.005),然而CCNE2和CDKN1A表达变化并不显著(P值分别为0.662,0.256),见图 1B;此外,流式细胞术结果显示,δ-三烯生育酚显著增加了细胞周期G1期细胞比例(P=0.008),而减少了S期细胞比例(P=0.007)见图 1C~1D。结果表明,δ-三烯生育酚抑制HeLa细胞增殖。同时,δ-三烯生育酚也升高了miR-34a的表达(P < 0.001),见图 1B。
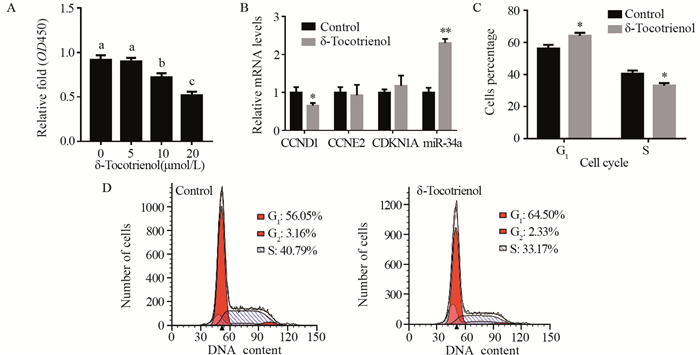
|
| A: the effect of δ-tocotrienol on cell viability was assessed using CCK-8 assay, n=5; P < 0.05, compared between different letters(a, b, c); B: the effects of δ-tocotrienol on the expressions of proliferation-related key genes and miR-34a were assessed using real-time PCR, n=4; *: P < 0.05, **: P < 0.01, compared with control group; C, D: the effects of δ-tocotrienol on cell cycle were assessed using flow cytometry, n=3, *: P < 0.05, compared with control group 图 1 δ-三烯生育酚对HeLa细胞增殖和miR-34a表达的影响 Figure 1 Effects of δ-tocotrienol on cell proliferation and miR-34a expression in HeLa cells |
由于有研究表明,miR-34a抑制肿瘤细胞生长[12],而此实验发现δ-三烯生育酚促进HeLa细胞中miR-34a表达,因此我们又用miR-34a模拟剂(mimics)和抑制剂(inhibitor)验证了miR-34a是否介导了δ-三烯生育酚对HeLa细胞增殖的抑制作用。结果显示,给HeLa细胞转染50 nmol/L miR-34a mimics 36 h后,和对照组(mimics NC)相比细胞活力显著下降(P < 0.001),见图 2A,CCND1表达水平也显著下降(P < 0.001),见图 2B。给HeLa细胞转染50 nmol/L miR-34a inhibitor 24 h后再添加20 μmol/L δ-三烯生育酚继续处理24 h,和对照组(Inhibitor NC)相比,miR-34a inhibitor转染组细胞活力显著上升(P < 0.001),并且显著减弱了δ-三烯生育酚对细胞活力的抑制作用(P < 0.001),见图 2C;同时,CCND1表达也呈现同样的变化,见图 2D~2E。结果表明,miR-34a介导了δ-三烯生育酚对HeLa细胞增殖的抑制作用。
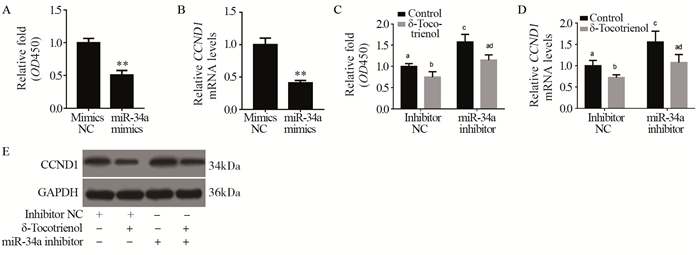
|
| A: effects of miR-34a mimics on HeLa cell viability, n=5, *: P < 0.05, **: P < 0.01; B: effect of miR-34a mimics on CCND1 expression in HeLa cells, n=4, *: P < 0.05, **: P < 0.01. After transfected with 50 nmol/L miR-34a inhibitor for 24 h, the cells were incubated with 20 μmol/L δ-tocotrienol for 24 h additionally; C: the cell viability was assessed by CCK-8, n=5; D: the expression of CCND1 mRNA was assessed by real-time PCR, n=4; P < 0.05, compared between different letters(a, b, c, d); E: CCND1 protein was determined using Western blot and the protein levels were normalized to GAPDH 图 2 miR-34a介导δ-三烯生育酚对HeLa细胞增殖的影响 Figure 2 miR-34a mediated effect of δ-tocotrienol on HeLa cell proliferation |
宫颈癌是妇科三大恶性肿瘤之一,严重威胁女性健康安全,全世界每年约有27万人被宫颈癌夺去生命[15],近85%新发病例发生在发展中国家[16]。感染高危人乳头状瘤病毒(human papillomavirus, HPV)是宫颈癌发生的一个重要因素[17]。此外,还有很多其他因子也促进宫颈癌的发生和发展[18]。
癌症的发病过程是一个连续的多个致癌基因、肿瘤抑制基因或miRNA表达改变的多步过程。miR-34a基因位于染色体1p36.23位点,在多种肿瘤(如宫颈癌、乳腺癌、肺癌等)中出现这一区域缺失或异常情况[19]。miR-34a是许多癌症(如神经母细胞瘤、结肠癌和肺非小细胞癌等)发展过程中一个关键的调节因子[4]。在多种癌细胞中发现,miR-34a是抑癌蛋白p53下游因子,在P53诱导下,miR-34a表达升高并诱导细胞周期G1期阻滞、衰老和凋亡[5-9]。而且,许多与增殖相关的基因被发现是miR-34a的靶基因,例如,Bcl-2、CCNE2、CCND1等[7, 19-21]。证据表明,在宫颈癌组织和细胞中miR-34a表达下调[10]。并且miR-34a可以通过靶向Notch1和Jagged1抑制其表达,进而抑制宫颈癌细胞侵袭能力。Wang等[12]研究发现,miR-34a通过上调retinoic acid-inducible gene-Ⅰ(RIG-Ⅰ)诱导宫颈癌细胞凋亡并阻碍细胞周期进程。这些证据表明,miRNA通过影响癌细胞增殖和侵袭能力在宫颈癌发生和发展过程中起关键作用,并具有成为宫颈癌治疗靶点的潜力。
许多天然化合物已被证明具有抗肿瘤作用,并具有研制成治疗肿瘤药物的潜力。在多种肿瘤细胞研究中发现,δ-三烯生育酚具有抑制肿瘤细胞增殖和迁移能力的作用[14]。本研究发现δ-三烯生育酚上调HeLa宫颈癌细胞中miR-34a,下调CCND1,进而抑制细胞增殖。CCND1是细胞周期素Cyclin D1的编码基因。Cyclin D1与细胞周期素依赖性激酶CDK4或CDK6形成复合物并作为它们的调节亚基,促进G1到S期的转变,对细胞增殖至关重要。而在此实验中,δ-三烯生育酚降低了G1期细胞比例,升高了S期细胞比例,同时降低了细胞活力。因此,δ-三烯生育酚抑制HeLa细胞CCND1表达,进而阻碍G1向S期的转变过程,引起G1期阻滞,抑制细胞增殖。但是,上调的miR-34a是否参与介导了δ-三烯生育酚对HeLa细胞增殖的抑制作用呢?为此,我们接着给HeLa细胞转染了miR-34a mimics和inhibitor。结果表明,miR-34a mimics升高HeLa细胞活力同时上调CCND1表达,而miR-34a inhibitor则抑制细胞活力并下调CCND1表达,并且miR-34a inhibitor减弱了δ-三烯生育酚对HeLa细胞增殖的抑制作用。这说明,miR-34a介导了δ-三烯生育酚对HeLa细胞增殖的抑制作用。普遍证实miR-34a是与靶基因mRNA 3′UTR结合位点结合,进而调节靶基因的表达。多个研究发现,人的CCND1 mRNA的3′UTR存在miR-34a结合位点,并且在多种细胞中发现miR-34a能与此结合位点直接结合,并抑制CCND1表达[19, 21]。此外,miR-34a也能调控多个增殖通路如Notch1、MAPK和PI3K/AKT[19]。因此,miR-34a可能通过直接与CCND1 mRNA的3′UTR结合并抑制了其表达,同时也可能间接地影响了增殖信号通路抑制CCND1表达。
总之,本研究结果表明,δ-三烯生育酚通过上调miR-34a抑制HeLa宫颈癌细胞增殖。δ-三烯生育酚在与宫颈癌传统化学疗法或靶向制剂结合起来使用时还能否发挥作用,还需在动物模型实验进一步验证。本实验结果为宫颈癌靶向药物或辅助治疗药物的研究提供了重要的理论依据。
| [1] | Wang L, Xu C. Role of microRNAs in mammalian spermatogenesis and testicular germ cell tumors[J]. Reproduction, 2015, 149(3): R127–37. DOI:10.1530/REP-14-0239 |
| [2] | Wang FF, Li BH, Xie X. The roles and clinical significance of microRNAs in cervical cancer[J]. Histol Histopathol, 2016, 31(2): 131–9. |
| [3] | Ye HQ, Yu XL, Xia JY, et al. MiR-486-3p targeting ECM1 represses cell proliferation and metastasis in cervical cancer[J]. Biomed Pharmacother, 2016, 80: 109–14. DOI:10.1016/j.biopha.2016.02.019 |
| [4] | Li XJ, Ren ZJ, Tang JH. MicroRNA-34a: a potential therapeutic target in human cancer[J]. Cell Death Dis, 2014, 5: e1327. DOI:10.1038/cddis.2014.270 |
| [5] | Hou Q, Tang J, Wang ZL, et al. Inhibitory Effect of MicroRNA-34a on Retinal Pigment Epithelial Cell Proliferation and Migration[J]. Invest Ophthalmol Vis Sci, 2013, 54(10): 6481–8. DOI:10.1167/iovs.13-11873 |
| [6] | Ma ZL, Hou PP, Li YL, et al. MicroRNA-34a inhibits the proliferation and promotes the apoptosis of non-small cell lung cancer H1299 cell line by targeting TGF beta R2[J]. Tumor Biol, 2015, 36(4): 2481–90. DOI:10.1007/s13277-014-2861-5 |
| [7] | Li LS, Yuan LJ, Luo JM, et al. MiR-34a inhibits proliferation and migration of breast cancer through down-regulation of Bcl-2 and SIRT1[J]. Clin Exp Med, 2013, 13(2): 109–17. |
| [8] | Chakraborty S, Mazumdar M, Mukherjee S, et al. Restoration of p53/miR-34a regulatory axis decreases survival advantage and ensures Bax-dependent apoptosis of non-small cell lung carcinoma cells[J]. FEBS Lett, 2014, 588(4): 549–59. DOI:10.1016/j.febslet.2013.11.040 |
| [9] | Zhao J, Guerrero A, Kelnar K, et al. Synergy between next generation EGFR tyrosine kinase inhibitors and miR-34a in the inhibition of non-small cell lung cancer[J]. Lung Cancer, 2017, 108: 96–102. DOI:10.1016/j.lungcan.2017.02.020 |
| [10] | Tian QF, Li Y, Wang FF, et al. MicroRNA Detection in Cervical Exfoliated Cells as a Triage for Human Papillomavirus-Positive Women[J]. J Natl Cancer Inst, 2014, 106(9): pii: dju241. |
| [11] | Geng D, Song X, Ning F, et al. MiR-34a Inhibits Viability and Invasion of Human Papillomavirus-Positive Cervical Cancer Cells by Targeting E2F3 and Regulating Survivin[J]. Int J Gynecol Cancer, 2015, 25(4): 707–13. DOI:10.1097/IGC.0000000000000399 |
| [12] | Wang JH, Zhang L, Ma YW, et al. microRNA-34a-Upregulated Retinoic Acid-Inducible Gene-Ⅰ Promotes Apoptosis and Delays Cell Cycle Transition in Cervical Cancer Cells[J]. DNA Cell Biol, 2016, 35(6): 267–79. DOI:10.1089/dna.2015.3130 |
| [13] | Eitsuka T, Tatewaki N, Nishida H, et al. A Combination of delta-Tocotrienol and Ferulic Acid Synergistically Inhibits Telomerase Activity in DLD-1 Human Colorectal Adenocarcinoma Cells[J]. J Nutr Sci Vitaminol, 2016, 62(5): 281–7. DOI:10.3177/jnsv.62.281 |
| [14] | Hodul PJ, Dong YB, Husain K, et al. Vitamin E delta-Tocotrienol Induces p27(Kip1) -Dependent Cell-Cycle Arrest in Pancreatic Cancer Cells via an E2F-1-Dependent Mechanism[J]. PLoS One, 2013, 8(2): e52526. DOI:10.1371/journal.pone.0052526 |
| [15] | He Y, Lin J, Ding Y, et al. A systematic study on dysregulated microRNAs in cervical cancer development[J]. Int J Cancer, 2016, 138(6): 1312–27. DOI:10.1002/ijc.29618 |
| [16] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [17] | Sangar VC, Ghongane B, Mathur G. Development of Human Papillomavirus (HPV) Vaccines: A Review of Literature and Clinical Update[J]. Rev Recent Clin Trials, 2016, 11(4): 284–9. DOI:10.2174/1574887111666160502160748 |
| [18] | Husain RS, Ramakrishnan V. Global Variation of Human Papillomavirus Genotypes and Selected Genes Involved in Cervical Malignancies[J]. Ann Glob Health, 2015, 81(5): 675–83. |
| [19] | Pang RT, Leung CO, Ye TM, et al. MicroRNA-34a suppresses invasion through downregulation of Notch1 and Jagged1 in cervical carcinoma and choriocarcinoma cells[J]. Carcinogenesis, 2010, 31(6): 1037–44. DOI:10.1093/carcin/bgq066 |
| [20] | Raver-Shapira N, Marciano E, Meiri E, et al. Transcriptional activation of miR-34a contributes to p53-mediated apoptosis[J]. Mol Cell, 2007, 26(5): 731–43. DOI:10.1016/j.molcel.2007.05.017 |
| [21] | Sun F, Fu H, Liu Q, et al. Downregulation of CCND1 and CDK6 by miR-34a induces cell cycle arrest[J]. FEBS Lett, 2008, 582(10): 1564–8. DOI:10.1016/j.febslet.2008.03.057 |
 2018, Vol. 45
2018, Vol. 45
