文章信息
- 阿霉素通过Stat3-cMyc途径诱导三阴性乳腺癌MDA-MB-468细胞耐药性
- Adriamycin Induced Chemoresistance of Human TNBC MDA-MB-468 Cells Through Stat3-cMyc Signal Pathway
- 肿瘤防治研究, 2018, 45(12): 949-953
- Cancer Research on Prevention and Treatment, 2018, 45(12): 949-953
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0497
- 收稿日期: 2018-04-13
- 修回日期: 2018-09-13
2. 261053 潍坊,潍坊医学院附属医院分子肿瘤学实验室;
3. 261053 潍坊,潍坊医学院临床医学院;
4. 261053 潍坊,潍坊医学院病理学教研室;
5. 261053 潍坊,潍坊医学院病原微生物学教研室
2. Laboratory of Molecular Oncology, Affiliated Hospital, Weifang Medical University, Weifang 261053, China;
3. School of Clinical Medicine, Weifang Medical University, Weifang 261053, China;
4. Department of Pathology, Weifang Medical University, Weifang 261053, China;
5. Department of Pathogeny Microbiology, Weifang Medical University, Weifang 261053, China
目前,化学治疗仍是三阴性乳腺癌的主要治疗方法之一,但是肿瘤细胞对化疗药物的耐药性严重影响了治疗效果,化疗药物与肿瘤细胞的接触是诱导继发性耐药的主要原因[1]。由于阿霉素是乳腺癌化学方案的常用药物[2],本研究观察阿霉素对三阴性乳腺癌耐药性的诱导作用并探究其机制。
ATP结合盒(ABC)转运蛋白在耐药的发展中起着至关重要的作用。ATP结合盒亚家族G成员2(ATP-binding cassette, sub-family G member 2, ABCG2)能排出大量异质化合物,导致耐药,引起治疗抵抗[3]。细胞耐药性的产生及耐药蛋白的表达受多种转录因子的调控。有研究报道cMyc能够调控包括ABCG2在内的ABC转运蛋白的表达[4]。cMyc是一个多功能的转录因子,参与调节细胞对阿霉素的敏感度[5],而cMyc的表达受其上游基因Stat3的调控。Stat3在肿瘤组织中异常激活,引发其下游靶基因cMyc转录,从而使正常细胞转化为癌细胞,并增加肿瘤细胞的耐药性[6]。因此,本研究观察阿霉素对MDA-MB-468细胞耐药性的诱导作用并探讨Stat3-cMyc通路是否介导了耐药性的发生。
1 材料与方法 1.1 细胞株、试剂、仪器人乳腺癌MDA-MB-468细胞株购自美国标准细胞库(American type culture collections, ATCC)。本研究实验剂和仪器包括:RPMI 1640培养基(Hyclone,美国)、青霉素/链霉素(索莱宝,北京,中国)、胎牛血清(四季青,杭州,中国)、阿霉素(索莱宝,北京,中国)、RIPA裂解液/苯甲基磺酰氟(索莱宝,北京,中国)、聚偏二氟乙烯膜(Millipore,Billerica,美国)、ABCG2抗体(Abcam,Cambridge,美国)、WP1066抑制剂(Selleckchem,上海,中国)和二甲基亚砜(索莱宝,北京,中国)等。
1.2 细胞培养人乳腺癌MDA-MB-468细胞用含10%FBS和1%青霉素/链霉素的RPMI 1640在37℃、5%CO2培养箱中培养。以不同浓度的阿霉素(0、0.05、0.1和0.5 μmol/L)孵育细胞24 h,观察并筛选最适阿霉素浓度进行后续实验。
1.3 MTT法检测细胞以3 000个/孔的密度接种至96孔板,然后分别加入终浓度为0、0.05、0.1和0.5 μmol/L的阿霉素。24 h后,每孔加入20 μl MTT溶液(5 mg/ml)继续培养4 h,吸弃培养液,每孔加150 μl DMSO溶液,振荡15 min后测定570 nm处的吸光度(OD570)。
1.4 细胞爬片及免疫荧光染色将盖玻片置于24孔板孔底,分别将MDA-MB-468和MDA-MB-468/ADM细胞以1×104个/孔接种,待细胞爬满盖玻片后进行免疫荧光染色。用PBS轻轻冲洗后在4%多聚甲醛中固定15 min。PBS洗涤爬片3次,山羊血清封闭1 h。将细胞用ABCG2一抗在4℃冰箱中孵育、过夜。PBS洗涤后,用二抗于37℃温育1 h。PBS洗涤细胞,用DAPI染色10 min,再次洗涤3次后滴加荧光防淬灭剂,观察免疫荧光染色并拍照。
1.5 蛋白质印迹分析抽提各组细胞的总蛋白,利用BCA法测定总蛋白浓度,以每个泳道20 μg浓度的蛋白样品上样,经SDS-PAGE电泳后,利用半干电转化法将蛋白转移至PVDF膜上,经过封闭、一抗(稀释倍数1:1 000)孵育、TBST洗脱、HRP标记的二抗(稀释倍数1:5 000)孵育、TBST再洗脱等步骤后,用增强化学发光法检测信号及X线片曝光,并且经定影显影处理,获得清晰条带。
1.6 统计学方法运用SPSS13.0统计软件进行分析,所有结果采用(x±s)表示,组间均数的比较采用独立t检验(双侧),P < 0.05为差异有统计学意义。
2 结果 2.1 持续低剂量阿霉素刺激诱导MDA-MB-468细胞产生耐药性不同浓度阿霉素作用于MDA-MB-468细胞24 h后可见0.05 μmol/L与0.1 μmol/L浓度的阿霉素未引起细胞明显的损伤,大部分细胞生长良好。当浓度增加到0.5 μmol/L时,几乎所有细胞都受损,可见大量坏死细胞;MTT法测得在0.05 μmol/L、0.1 μmol/L及0.5 μmol/L浓度下阿霉素对MDA-MB-468细胞的抑制率分别为0.14、0.20、0.38,而且阿霉素对MDA-MB-468细胞的半数最大效应浓度(concentration for 50% of maximal effect, EC50)为0.94 μmol/L(P=0.038)。综合以上结果,我们选用0.1 μmol/L的阿霉素继续进行后续研究。
用0.1 μmol/L的阿霉素持续刺激MDA-MB-468细胞4周后获得耐药细胞,命名为MDA-MB-468/ADM。MTT实验检测MDA-MB-468/ADM细胞对阿霉素敏感度,结果显示MDA-MB-468/ADM的EC50为5.2 μmol/L,较MDA-MB-468的EC50(0.94 μmol/L)显著升高(P=0.041),说明长期使用0.1 μmol/L的阿霉素后,MDA-MB-468细胞对阿霉素的敏感度显著下降,产生耐药,见图 1。

|
| 图 1 MTT测定经24h处理后的MDA-MB-468细胞与MDA-MB-468/ADM细胞对阿霉素的敏感度(x±s, n=3) Figure 1 Sensitivity of MDA-MB-468 and MDA-MB-468/ADM cells to adriamycin after 24h treatment detected by MTT assay (x±s, n=3) |
与正常MDA-MB-468细胞相比,MDA-MB-468/ADM细胞中代表ABCG2表达水平的红色荧光明显增多增强,见图 2A。Western blot检测结果也表明了MDA-MB-468/ADM细胞中ABCG2的高表达,见图 2B。提示用0.1 μmol/L阿霉素持续刺激后,三阴性乳腺癌MDA-MB-468细胞对阿霉素产生耐药。
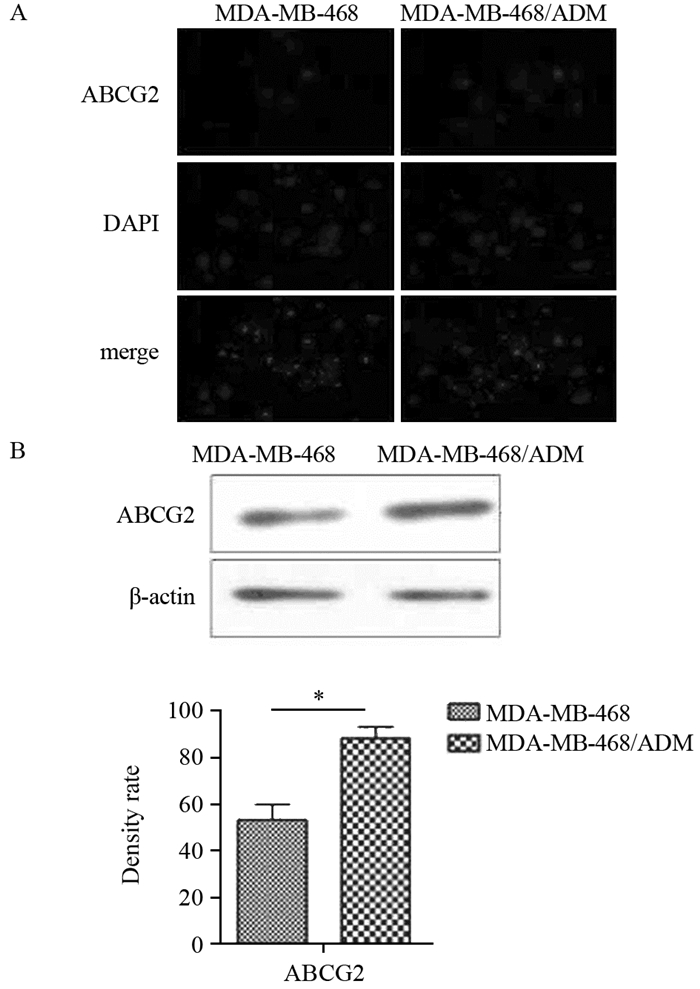
|
| A: Immunofluorescence staining results showed the increased expression of ABCG2 (red) in MDA-MB-468/ADM cells, staining with DAPI (blue); B: Western blot analysis results showed high expression of ABCG2 in MDA-MB-468/ADM cells (n=3, *: P < 0.05) 图 2 MDA-MB-468/ADM细胞中耐药蛋白ABCG2的表达 Figure 2 Expression of drug resistance protein ABCG2 in MDA-MB-468/ADM cells |
为探究MDA-MB-468细胞对阿霉素产生耐药的机制,我们进一步检测了MDA-MB-468/ADM细胞中转录因子p-stat3与cMyc的表达水平,观察MDA-MB-468细胞对阿霉素耐药性的产生是否与Stat3-cMyc途径有关。Western blot结果显示,MDA-MB-468/ADM中p-Stat3与cMyc的表达均明显升高,而两组细胞中总的Stat3表达水平未见显著变化。这些结果表明Stat3的激活和cMyc表达的增多可能参与了MDA-MB-468细胞对阿霉素耐药性的产生,见图 3。
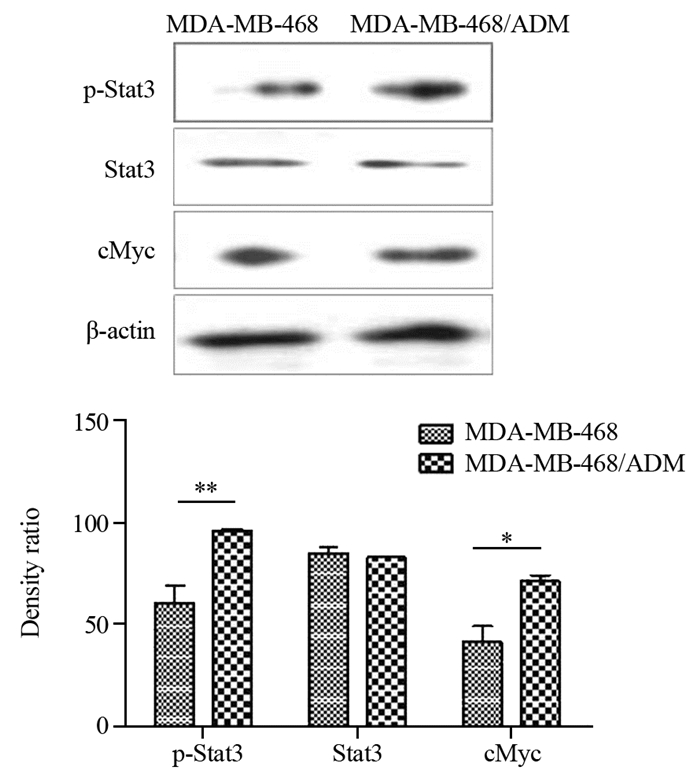
|
| 图 3 Western blot检测在MDA-MB-468和MDA-MB-468/ADM细胞中p-Stat3、Stat3及cMyc的表达(n=3, *: P < 0.05, **: P < 0.01) Figure 3 p-Stat3, Stat3 and cMyc expression in MDA-MB-468 and MDA-MB-468/ADM cells analyzed by Western blot (n=3, *: P < 0.05, **: P < 0.01) |
为进一步证明Stat3-cMyc途径在阿霉素诱导三阴性乳腺癌MDA-MB-468细胞耐药性产生中的作用,我们用Stat3磷酸化的抑制剂WP1066抑制Stat3活化,观察转录因子cMyc的表达是否受到影响。结果显示WP1066(1.25 μmol/L)作用于MDA-MB-468/ADM细胞后,磷酸化的Stat3显著降低(P=0.014),同时cMyc表达水平明显下降(P=0.044)。另外WP1066处理后MDA-MB-468/ADM细胞耐药蛋白ABCG2的表达也显著减少(P=0.000)。这些结果进一步说明阿霉素通过Stat3-cMyc途径诱导了MDA-MB-468细胞耐药性的产生,而抑制Stat3的活化后,耐药蛋白表达减少,细胞的耐药性减弱,见图 4。
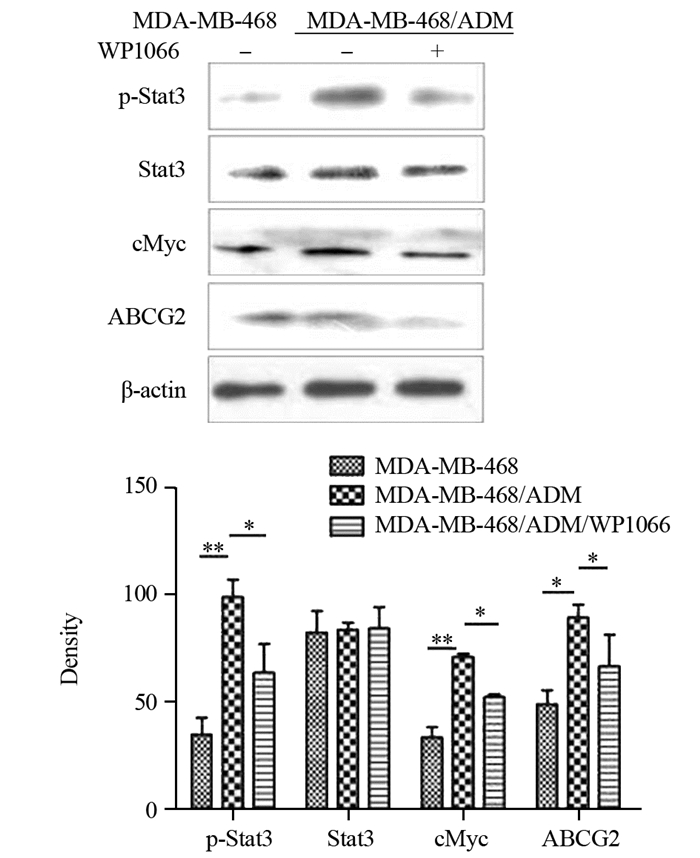
|
| *: P < 0.05, **: P < 0.01 (x±s, n=3) 图 4 Western blot检测MDA-MB-468、MDA-MB-468/ADM、MDA-MB-468/ADM/WP1066三组细胞中p-Stat3、Stat3、cMyc及ABCG2的表达 Figure 4 Stat3, p-Stat3, cMyc and ABCG2 expression in MDA-MB-468, MDA-MB-468/ADM and MDA-MB-468/ADM/WP1066 cells analyzed by Western blot |
由于WP1066下调了耐药蛋白ABCG2的表达,因此我们进一步通过MTT法检测MDA-MB-468/ADM细胞对阿霉素敏感度的变化。结果显示,阿霉素对MDA-MB-468/ADM细胞的EC50为6.774 μmol/L,而在使用WP1066之后的EC50降低至1.29 μmol/L(P=0.000),这表明WP1066抑制Stat3的活化增强了MDA-MB-468/ADM细胞对阿霉素的敏感度,见图 5。
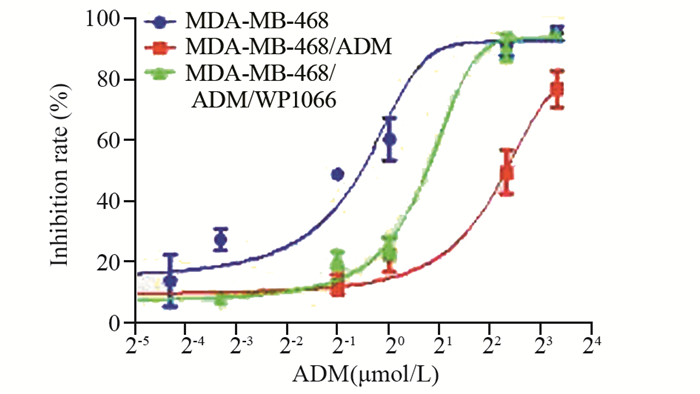
|
| 图 5 MTT法检测经36 h处理后的MDA-MB-468、MDA-MB-468/ADM、MDA-MB-468/ADM/WP 1066三组细胞对阿霉素的敏感度(x±s, n=3) Figure 5 Sensitivity of MDA-MB-468, MDA-MB-468/ADM and MDA-MB-468/ADM/WP1066 cells to adriamycin after 36h treatment detected by MTT assay (x±s, n=3) |
目前肿瘤细胞的耐药性是临床治疗的难点与研究的热点,阐明肿瘤耐药的机制可以为肿瘤的治疗提供新的治疗方向和靶点。
本研究应用低剂量阿霉素持续诱导人三阴性乳腺癌MDA-MB-468细胞,导致细胞产生耐药性,对阿霉素的敏感度显著下降,耐药蛋白ABCG2表达增高。为探究MDA-MB-468细胞对阿霉素产生耐药的机制,本实验进一步检测了MDA-MB-468/ADM细胞中转录因子p-stat3与cMyc的表达水平,观察MDA-MB-468细胞对阿霉素耐药性的产生与Stat3-cMyc途径有关。为进一步证明Stat3-cMyc途径在阿霉素诱导三阴性乳腺癌MDA-MB-468细胞耐药性产生中的作用,实验用Stat3磷酸化的抑制剂WP1066抑制Stat3活化,发现转录因子cMyc的表达也受到影响。进一步的机制研究揭示了Stat3-cMyc通路在阿霉素诱导的耐药中具有重要作用。
文献报道,Stat3信号通路与肿瘤细胞对化疗的耐药性有关[7]。Stat3的激活可以帮助癌细胞逃避由药物引起的死亡,从而诱发耐药性。Yue等[8]证明了Stat3的过度活化可以促进顺铂耐药的卵巢癌进展,相反,如果抑制Stat3信号通路则会促进耐药性癌细胞的凋亡,增加癌细胞对各种药物的敏感度。Li等[9]研究也有相似的发现,抑制Stat3信号通路后人胃癌细胞的凋亡增强,耐药性减弱。那么Stat3在三阴性乳腺癌耐药性的产生中有何作用?文献报道,乳腺癌组织中Stat3的活化增强与乳腺癌的临床分期和侵袭转移密切相关[10]。多种致癌性细胞因子与细胞膜的相应受体结合后导致Stat3与酪氨酸磷酸化通道相偶联后被激活,激活后的Stat3可在核内与特异性DNA启动子相结合,调节cMyc、Oct4、Sox2等相关基因表达[11]。作为调节多种转录因子功能的重要枢纽,Stat3有望成为肿瘤基因治疗中的有效靶点。有研究表明,在肿瘤中cMyc的表达水平与耐药性有关[4, 12-13],cMyc能够调控ABC转运蛋白的表达水平,而ABCG2与肿瘤细胞的耐药性直接相关,但Stat3/cMyc在三阴性乳腺癌产生耐药性方面的影响及机制却未见报道。
本研究发现低浓度(0.1 μmol/L)阿霉素持续刺激使MDA-MB-468细胞对阿霉素的敏感度明显降低,MDA-MB-468/ADM细胞中p-Stat3和cMyc的表达较MDA-MB-468细胞显著增加,这些发现与上述文献中对Stat3和cMyc在肿瘤耐药性中的作用相一致。另外,刘丽等[6]在喉鳞癌细胞的研究中也揭示了Stat3-cMyc通路的重要作用,与本研究的结果相吻合。由此推测,MDA-MB-468/ADM对阿霉素耐药的机制很可能与Stat3的激活和p-Stat3介导的cMyc表达的增多有关。为进一步证明Stat3-cMyc通路在阿霉素诱导的乳腺癌耐药性中的关键作用,本实验应用WP1066抑制MDA-MB-468/ADM中Stat3的活化,发现随着p-Stat3的降低,cMyc和ABCG2的表达也相应下降,这与Granato等[14]证实抑制Stat3信号可下调cMyc的表达一致。再次MTT检测发现WP1066作用后MDA-MB-468/ADM细胞对阿霉素的敏感度显著增强,这与Li等[9]研究结果一致。
总之,本实验结果表明阿霉素可以诱导Stat3活化,上调转录因子cMyc及耐药蛋白ABCG2的表达,促进了三阴性乳腺癌MDA-MB-468细胞对阿霉素耐药性的产生。因此,抑制Stat3的表达与活化可有效逆转乳腺癌对阿霉素的耐药性,特异性靶向Stat3-cMyc途径联合化疗药物治疗有望成为一种有效治疗乳腺癌的新措施,改善乳腺癌患者的预后。
| [1] | Marta Prieto-Vila, Ryou-u Takahashi, Wataru Usuba, et al. Drug Resistance Driven by Cancer Stem Cells and Their Niche[J]. Int J Mol Sci, 2017, 18(12): E2574. DOI:10.3390/ijms18122574 |
| [2] | Huang JF, Wen CJ, Zhao GZ, et al. Overexpression of ABCB4 contributes to acquired doxorubicin resistance in breast cancer cells in vitro[J]. Cancer Chemother Pharmacol, 2018, 82(2): 199–210. DOI:10.1007/s00280-018-3603-y |
| [3] | Ceballos MP, Rigalli JP, Cere LI, et al. ABC transporters: Regulation and association with multidrug resistance in hepatocellular carcinoma and colorectal carcinoma[J]. Curr Med Chem, 2018. |
| [4] | 张欢乐, 王萍, 陆妙珍, 等. c-Myc通过调控ATP结合盒转运蛋白表达对CD133+肠癌干细胞耐药性的影响[J]. 生理学报, 2016, 68(2): 171–8. [ Wang HL, Wang P, Lu MZ, et al. c-Myc regulation of ATP-binding cassette transporter reverses chemoresistance in CD133+ colon cancer stem cells[J]. Sheng Li Xue Bao, 2016, 68(2): 171–8. ] |
| [5] | Zhang X, Ai Z, Chen J, et al. Glycometabolic adaptation mediates the insensitivity of drug-resistant K562/ADM leukaemia cells to adriamycin via the AKT-mTOR/c-Myc signalling pathway[J]. Mol Med Rep, 2017, 15(4): 1869–76. |
| [6] | 刘丽, 王莹, 桑建中. p-Stat3及其下游靶基因c-myc在喉鳞癌组织和细胞中的表达及意义[J]. 临床耳鼻咽喉头颈外科杂志, 2016, 30(2): 123–5. [ Liu L, Wang Y, Sang JZ. Expression and Significance of p-Stat3 and its downstream gene c-Myc in laryngeal squamous cell carcinoma tissues and cells line[J]. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2016, 30(2): 123–5. ] |
| [7] | Liu X, Xiao Q, Bai X, et al. Activation of Stat3 is involved in malignancy mediated by CXCL12-CXCR4 signaling in human breast cancer[J]. Oncol Rep, 2014, 32(6): 2760–8. DOI:10.3892/or.2014.3536 |
| [8] | Yue P, Zhang X, Paladino D, et al. Hyperactive EGF receptor, Jaks and Stat3 signaling promote enhanced colony-forming ability, motility and migration of cisplatin-resistant ovarian cancer cells[J]. Oncogene, 2012, 31(18): 2309–22. DOI:10.1038/onc.2011.409 |
| [9] | Li H, Lu H, Lv M, et al. Parthenolide facilitates apoptosis and reverses drug resistance of human gastric carcinoma cells by inhibiting the Stat3 signaling pathway[J]. Oncol Lett, 2018, 15(3): 3572–9. |
| [10] | Kohsaka S, Wang L, Yachi K, et al. STAT3 inhibition overcomes temozolomide resistance in glioblastoma by downregulating MGMT expression[J]. Mol Cancer Ther, 2012, 11(6): 1289–99. DOI:10.1158/1535-7163.MCT-11-0801 |
| [11] | Huang S, Chen M, Shen Y, et al. Inhibition of activated Stat3 reverses drug resistance to chemotherapeutic agents in gastric cancer cells[J]. Cancer Lett, 2012, 315(2): 198–205. DOI:10.1016/j.canlet.2011.10.011 |
| [12] | Reyes-González JM, Armaiz-Peña GN, Mangala LS, et al. Targeting c-MYC in platinum-resistant ovarian cancer[J]. Mol Cancer Ther, 2015, 14(10): 2260–9. DOI:10.1158/1535-7163.MCT-14-0801 |
| [13] | Zuo Y, Yang D, Yu Y, et al. Niclosamide enhances the cytotoxic effect of cisplatin in cisplatin-resistant human lung cancer cells via suppression of lung resistance-related protein and c-Myc[J]. Mol Med Rep, 2018, 17(3): 3497–502. |
| [14] | Granato M, Rizzello C, Gilardini Montani MS, et al. Quercetin induces apoptosis and autophagy in primary effusion lymphoma cells by inhibiting PI3K/AKT/mTOR and Stat3 signaling pathways[J]. J Nutr Biochem, 2017, 41: 124–36. DOI:10.1016/j.jnutbio.2016.12.011 |
 2018, Vol. 45
2018, Vol. 45


