文章信息
- COMPASS三维验证系统在食管癌容积旋转调强放疗中的应用
- Application of COMPASS 3D Dose Validation System in Volumetric Modulated Arc Therapy of Esophageal Cancer
- 肿瘤防治研究, 2018, 45(11): 890-893
- Cancer Research on Prevention and Treatment, 2018, 45(11): 890-893
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0431
- 收稿日期: 2018-04-02
- 修回日期: 2018-06-10
2. 455000 安阳, 安阳地区医院血液科;
3. 450000 郑州, 郑州大学一附院放疗一科
2. Department of Hematology, Anyang District Hospital, Anyang 455000, China;
3. Department 1st of Radiation Oncology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450001, China
随着科学技术的不断发展, 放疗设备也在不断升级更新。以调强放射治疗(intensity modulated radiotheragy, IMRT)调强技术为主的放疗技术在临床得到了普及和应用, 目前越来越多的医院开展调强放疗, 将调强技术作为放射治疗的首选技术。由于调强放疗技术属于一种高度精确的放疗技术, 执行计划中参数较多、技术难度大, 要确保患者获得精准的照射剂量, 治疗前的剂量验证十分必要。由于容积旋转调强(volumetric modulated arc therapy, VMAT)的特殊性使得常规的调强剂量验证工具无法实现。近年来由比利时IBA公司和RaySearch公司共同开发了一种三维剂量验证系统, 即COMPASS系统。该系统采集治疗射线并与患者的CT图像相结合, 通过剂量算法来反推患者体内实际接受到的剂量, 可以直观地显示误差。首次实现了剂量体积直方图DVH及三维剂量评估伽马分析[1-4]。安阳市肿瘤医院于2013年引进了这套系统并投入使用, 积累了一些使用COMPASS系统进行调强验证的一些经验。本研究使用该系统对食管癌容积旋转调强进行了剂量验证。
1 资料和方法 1.1 收集病例初治食管癌患者, 依据2002年AJCC/UICC临床分期为标准, 分期结果为T1bN+M0~1a或T2~4N0~1M0~1a, 即ⅡA~ⅣA期; KPS≥70分或ECOG评分为0~1;细胞学或病理学证实为鳞癌; 如有其他恶性肿瘤病史(不包括可治愈的非黑色素性皮肤癌和子宫颈原位癌), 需临床治愈达五年以上; 入组前未行手术、放疗患者; 拟放疗部位既往未接受过放疗。
收集安阳市肿瘤医院2012年7月—2013年1月间食管癌住院患者37例, 其中男21例, 女16例, 年龄41~88岁, 中位年龄66岁。颈段5例, 胸上段16例, 胸中段15例, 胸下段1例。经活检组织病理确诊37例均为鳞癌。TNM分期:T3N0M0 22例, T3N1M0 12例, T4N0M0 2例, T4N1M0 1例。
1.2 研究方法 1.2.1 定位患者均采取仰卧位, 双臂伸直置于两侧。颈段及上段患者采用头颈肩罩固定, 中下段及食管胃交界癌体膜固定, 行静脉造影增强扫描。对造影剂过敏者可不行增强扫描。首先体位固定, 图像扫描采用飞利浦公司16排大孔径CT(Philips Brilliance Big Bore CT)模拟定位机, 层厚5 mm, 扫面范围从下颌骨到肾上腺, 扫描完成后将图像传输至Elekta Oncentra计划系统。
1.2.2 计划系统(TPS)和加速器Oncentra计划系统(瑞典医科达公司), 6MV-X射线加速器(Synergy型, 瑞典医科达公司), 可以进行锥形束CT扫描, 最大射野为40 cm×40 cm。等中心层面的叶片宽度为1 cm, 叶片的最大运动速度为2.5 cm/s, 最大剂量率为600 MU/min。
1.2.3 验证系统(1) 将COMPASS验证系统所使用专用附件托架挂置在ARTI-STE加速器附件架上, 再将MatriXX矩阵安装到固定架上, 然后执行患者QA计划进行剂量数据采集, 最后将采集到的数据传输到COMPASS系统中。(2)COMPASS的原理是将实际测量得到的照射剂量反推至患者的CT图像上并重新进行剂量计算, 在这个过程中引入了MLC叶片到位精确度、剂量准确度等稳定加速器误差。将COMPASS实测后膜体的剂量在与计划系统下的剂量进行Gamma(3%/3 mm)分析[4]。(3)COMPASS系统(IBA公司, 比利时)是基于容积旋转调强(volumetric modulated arc therapy, VMAT)、计划的三维验证系统, 包括探测器和软件两部分。其中探测器是有MatriXX为二维电离室矩阵组成, 均匀分布了1020个平行板通气电离室, 测量的敏感体积为0.07 cm3, 相邻两个电离室的距离为0.762 cm, 有效测量面积为24 cm×24 cm, 其建成材料为3.3 mm的等效水厚度[5]。而软件部分包含三个部分:Beam模块(Beam commissioning), Detector模块(Detector commissioning), Patient3D模块(Patient 3D dosimetry)。Beam模块主要利用加速器的光子和电子的能谱模拟出加速器机头的剂量学参数。Detector模块主要测量MatriXX电离室探头的绝对剂量和测量中心点的位置。Patient3D模块中可以利用COMPASS本身的算法来计算验证计划基于计划数据重新计算剂量分布。实际临床工作中, 需要验证的工作量太大, 物理师不能全部应付, 利用COMPASS进行Compute Dose计算, 来检验TPS的精度。也可抽检部分QA计划, 实际测量靶区内各照射野的通量, 进行Reconstruct Dose计算。还可以通过测量标准计划定期检测测量, 反映加速器的日常参数情况。
1.2.4 命名勾画的靶区有原发肿瘤区的计划靶区:GTV-T-P。危及器官的剂量双肺V20:即双肺接受照射剂量大于20 Gy的体积的百分比。双肺V30:即双肺接受照射剂量大于30 Gy的体积的百分比。
1.3 剂量精度评估靶区95%体积剂量(D95)和平均剂量(Dmean)。利用COMPASS三维剂量验证系统验证治疗计划的γ通过率, 采用3%/3 mm位标准。通过Gamma通过率, 检测计划执行剂量的准确性[6-7]。
1.4 统计学方法采用软件SPSS19.0进行统计分析, 计划中各指标为定量资料, 数据进行正态性检验(Shapiro-Wilk正态性检验, 各组数据, P > 0.05), 结果显示各组数据均服从正态分布, 资料用均数±标准差表示。成组比较方法采用t检验, P < 0.05为差异有统计学意义。
2 结果 2.1 靶区剂量通过率偏差使用以上方法进行实测, 并采用Gamma分析方法(3%/3 mm)进行分析, 分析时将感兴趣区域分为靶区和危及器官两组进行统计, 以γ > 95%作为要求。结果发现, Gamma误差限定条件为3%/3 mm时, 计划的所有危及器官的γ通过率为93.5%, 各个靶区的Dmean平均偏差都 < 3%, 各个靶区的Dmean偏差平均值在1%以内。显示COMPASS和计划系统与验证计划的剂量学差异较小。Gamma通过率见表 1。
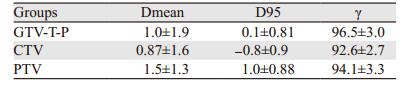
|
危及器官中, 重点观察了双肺耐受剂量。验证系统和计划系统中双肺V20二者差异有统计学意义(P=0.000), COMPASS测量的双肺V20的剂量都比计划系统计算的结果小。双肺V30两者吻合度基本相似, 见表 2。
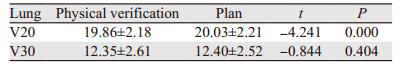
|
整体Gamma通过率为96%, 之所以出现如下原因, 主要是由于COMPASS所测量的剂量通量图分辨率较低, 计算时将通量图经过重新差值[4], 再次投射到CT图像上, 经过二次投射后, 在分野中由于分野和子野数目的增加, MLC运动的限制, 使在高剂量梯度区域的误差放大, 致使通过率降低。一般情况下危及器官的剂量梯度较小, Gamma分析时, 通过率稍高。如mA可以提供将Compute dose与Reconstruct dose之间直接进行对比分析的功能[8], 则可以将因系统计算之间的误差消除, 更有利于分析由加速器稳定性等产生的误差。
3 讨论随着放射治疗技术快速发展, 调强放疗在临床中得到推广和普及, 而VMAT作为调强放疗的新技术也得以认可, 尤其是高治疗计划、高效率治疗等方面, 随之而来的三维剂量验证系统越来越多地被应用于临床。容积旋转调强通过机架旋转一周或数周进行连续照射, 同时子野形状、剂量率、加速器机架旋转速度都在持续变化, 正式基于如此多的自由度才实现了在较短时间内完成了肿瘤的照射, 同时又很好地保护了周围的危及器官[9]。临床上常用的调强计划剂量验证手段包括:点剂量(电离室)、二维平面剂量验证(胶片、矩阵等), 但两者都不能很好地反映肿瘤和正常器官受量的实际受量情况[10-13]。由于VMAT计划在设计和执行过程中具有很多动态变化的参数, 增加了计划实施的不确定性, 目前, 国内外对于COMPASS系统临床应用的研究, 更多的关注在鼻咽癌、食管癌[14]、宫颈癌[15]、前列腺癌[16]等肿瘤上面。
本研究重点观察了双肺V20、V30计划系统与验证系统差别。双肺V20在临床上作为一个评价放射性肺损伤至关重要因素。理论上, 验证系统应与计划系统完全吻合。本研究发现, 双肺V20二者差异有统计学意义, COMPASS测量的双肺V20的剂量都比计划系统计算的结果小。双肺V30两者吻合度基本相似。张丹丹[17]比较了初治鼻咽癌VMAT与IMRT二者计划系统下, 正常组织计划系统低于验证系统, 这与本研究相似。
对于正常组织, COMPASS测量的结果都要低于计划系统计算的结果, 除了个别病例中的一些器官。将计划导入DVH图, 从DVH图中也可以发现, 肿瘤靶区与正常组织二者都吻合得很好。Boggula等[18]利用COMPASS系统验证了ERGO++计划系统做的前列腺、椎旁、肛门肿瘤各4例, 共12例的VMAT计划, 结果发现COMPASS验证结果与实际相符, 差异较小, 测量结果的平均剂量与PTV的平均剂量之间的差异控制在2.5%以内, 在低剂量区内正常组织的最大差异小于9%。这也与本研究结果相吻合。段隆焱等[19]在对直肠癌计划进行验证时, 尤其要关注高剂量梯度区域, 特别是与靶区较近的危及器官。胡彩容等[20]利用COMPASS验证系统通过测量的三个方向上的偏差均小于1 mm, 显示对加速器的中心误差几乎无影响。本研究因技术限制, 未能从三个面测量误差。
综上所述, VMAT技术治疗食管癌都能达到临床要求的剂量分布质量。在当前的实施治疗过程中, 该系统可以对所提供的剂量进行精确的测量, 并可以直接在患者的解剖结构上投射3D剂量分布。虽然VMAT计划验证γ通过率略差于标准(95%), 但可显著减少治疗时间, 提高实际治疗时患者接受的剂量精度。COMPASS系统的独立计算功能和剂量重建功能可以提高TPS的精度, 可以提供患者更详细直观的三维的剂量分布信息, 可满足临床的要求, 为临床工作控制提供了安全、有效的技术保障。
| [1] | 李奇欣, 柏朋刚, 张秀春, 等. MatriXX射野角度剂量响应修正[J]. 中华放射医学与防护杂志, 2011, 31(2): 229–32. [ Li QX, Bai PG, Zhang XC, et al. Angular dose dependency of MatriXX and its calibration[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2011, 31(2): 229–32. DOI:10.3760/cma.j.issn.0254-5098.2011.02.030 ] |
| [2] | Wolfsherger LD, Wagar M, Nitsch P, et al. Angular dose Dependence of Matrixx TM and its calibration[J]. J Appl Clin Med Phys, 2010, 1: 3057. |
| [3] | 张秀春, 胡彩容, 陈开强, 等. COMPASS验证系统在放射治疗中的应用研究[J]. 肿瘤预防与治疗, 2012, 25(5): 273–9. [ Zhang XC, Hu CR, Chen KQ, et al. Commisioing of the compass system for clinical dose verification[J]. Zhong Liu Yu Fang Yu Zhi Liao, 2012, 25(5): 273–9. ] |
| [4] | 方明明, 周希法, 卢绪菁, 等. 使用Compass系统进行调强验证的一些探讨[J]. 中国医学物理学杂志, 2013, 30(1): 3870–2. [ Fang MM, Zhou XF, Lu XJ, et al. Discusion about the application of compass system in IMRT verification[J]. Zhongguo Yi Xue Wu Li Xue Za Zhi, 2013, 30(1): 3870–2. DOI:10.3969/j.issn.1005-202X.2013.01.008 ] |
| [5] | Barbeiro AR, Ureba A, Baeza JA, et al. 3D VMAT verification based on monte carlo log file simulation with experimental feedback from film dosimetry[J]. PLoS One, 2016, 11(11): e0166767. DOI:10.1371/journal.pone.0166767 |
| [6] | Bedford LJ, Lee KY, Wai P, et al. Evaluation of the Delta 4 phantom for IMRT and VMAT verification[J]. Phys Med Biol, 2009, 54(9): N167–76. DOI:10.1088/0031-9155/54/9/N04 |
| [7] | Bedford LJ, Waningma PA. Commissioning of volumetric modulated arc therapy(VMAT)[J]. Int J Radiat Oneol Bid Plays, 2009, 73(2): 537–47. |
| [8] | Low DA, Dempsey JF. Evaluation of the gamma dose distribution comparison method[J]. Med Phys, 2003, 30(9): 2455–64. DOI:10.1118/1.1598711 |
| [9] | Verbakel WF, Senan S, Cui jper JP, et al. Rapid delivery of stereotactic radiotherapy for peripheral lung tumors usin g volum etric intensity modulated arcs[J]. Radiother Oncol, 2009, 93: 122–4. DOI:10.1016/j.radonc.2009.05.020 |
| [10] | Clemente-Gutiérrez F, Pérez-Vara C. Dosimetric validation and clinical implementation of two 3D dose verification systems for quality assurance in volumetric-modulated arc therapy techniques[J]. J Appl Clin Med Phys, 2015, 16(2): 5190. |
| [11] | Ezzell GA, Galvin JM, Low D, et al. Guidance document on delivepy, treatment planning, and clinical implementation of IMRT:report of the IMRT Subcommittee of the AAPM Radiation Therapy Committee[J]. Med Phys, 2003, 30(8): 2089–115. DOI:10.1118/1.1591194 |
| [12] | Buceiolini M, Bounamici FB, Casati M. Verification of IMRT fields by film dosimetry[J]. Med Phys, 2004, 31(1): 161–8. |
| [13] | Stathakis S. Ionization chamber array for patient specific VMAT, Tomotherapy and IMRT QA[J]. Phys Conf Ser, 2010, 250: 012029. DOI:10.1088/1742-6596/250/1/012029 |
| [14] | 刑晓汾, 褚薛刚, 郑旭亮, 等. Compass在食管癌IMRT三维剂量验证中应用研究[J]. 中华放射肿瘤学杂志, 2015, 24(3): 323–30. [ Xing XF, Chu XG, Zheng XL, et al. A clinical application research of 3D dose verification for esophageal carcinoma intensity-modulated radiation therapy with Compass[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2015, 24(3): 323–30. DOI:10.3760/cma.j.issn.1004-4221.2015.03.023 ] |
| [15] | 褚薛刚, 邢晓汾, 崔桐, 等. Compass R在宫颈癌调强放疗三维剂量验证中的应用研究[J]. 中华放射医学与防护杂志, 2015, 35(7): 548–9. [ Chu XG, Xing XF, Cui T, et al. Aclinical application research of 3D dose verification for cervical carcinoma intensity- modulated radiation therapy with Compass[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2015, 35(7): 548–9. DOI:10.3760/cma.j.issn.0254-5098.2015.07.017 ] |
| [16] | Sdrolia A, Brownsword KM, Marsden JE, et al. Retrospective review of locally set tolerances for VMAT prostate patient specific QA using the COMPASS® system[J]. Phys Med, 2015, 31(7): 792–7. DOI:10.1016/j.ejmp.2015.03.017 |
| [17] | 张丹丹, 黄劭敏, 邓小武, 等. 初治鼻咽癌VMAT与IMRT的比较评估[J]. 中华放射肿瘤学杂志, 2012, 21(4): 364–8. [ Zhang DD, Huang SM, Deng XW, et al. Comparison and evaluation of VMAT and IMRT for the treatment of initial treated nasophyngeal carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2012, 21(4): 364–8. DOI:10.3760/cma.j.issn.1004-4221.2012.04.021 ] |
| [18] | Boggula R, Lorenz F, Mueller L, et al. Experimental Validation of commercial 3D dose verification system for intensity-modulated arc therapies[J]. Phys Med Biol, 2010, 55(19): 5619–33. DOI:10.1088/0031-9155/55/19/001 |
| [19] | 段隆焱, 蔡钢, 陈毅, 等. Compass在直肠癌术前调强放射治疗三维剂量验证中的应用[J]. 中国医学物理学杂志, 2017, 34(12): 1200–5. [ Duan LY, Cai G, Chen Y, et al. Application of Compass system in three-dimensional dose verification of preoperative intensity-modulated radiotherapy plan for rectal cancer[J]. Zhongguo Yi Xue Wu Li Xue Za Zhi, 2017, 34(12): 1200–5. DOI:10.3969/j.issn.1005-202X.2017.12.003 ] |
| [20] | 胡彩容.三维验证系统在容积旋转调强剂量验证中的应用研究[D].北京: 清华大学, 2012. [ Hu CR.Research on Application of Three-dimensional Verification System in Volume Rotation Intensity Modulation Verification[D].Peking: Tsinghua University, 2012. ] |
 2018, Vol. 45
2018, Vol. 45


