文章信息
- 脑胶质瘤腮腺及骨髓转移1例报告
- Parotid Gland and Bone Marrow Metastasis from Gliomas:A Case Report
- 肿瘤防治研究, 2018, 45(11): 936-937
- Cancer Research on Prevention and Treatment, 2018, 45(11): 936-937
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0430
- 收稿日期: 2018-04-02
- 修回日期: 2018-08-01
2. 063000 唐山, 华北理工大学研究生院
2. Graduate School of North China University of Science and Technology, Tang shan 063000, China
脑胶质瘤是由于大脑和脊髓胶质细胞癌变所产生的、最常见的原发性颅脑肿瘤, 根据病理特征可分为星形细胞瘤、髓母细胞瘤、多形胶母细胞瘤、室管膜瘤、少枝胶母细胞瘤等。脑胶质瘤颅外转移较为少见, 发生腮腺及骨髓转移的更是罕见, 现报告1例脑胶质瘤腮腺及骨髓转移的病例, 以提高相关认识。
1 临床资料患者, 男, 66岁, 无明显诱因突发肢体抽搐伴意识丧失1 h于2013年10月8日入院。查体:体温35.9℃, 脉博73次/分, 呼吸18次/分, 血压18/12 kpa。神清淡漠, 语利, 对答正确, 双侧瞳孔正大等圆, 对光反射敏感, 心肺腹及神经系统查体无异常。PS评分2分。既往高血压病史20余年、胃溃疡病史20年。无肝炎、结核等传染病史。无冠心病及糖尿病等病史。查头颅MRI:右额颞叶病变, 考虑低级别胶质瘤可能性大, 患者拒绝进一步诊治。2013年12月无明显诱因突发面部抽搐再次入院, 查体未见异常, 无意识障碍。复查头颅MRI, 病变部位较前无明显变化, 予以抗癫痫药物治疗。于2014年2月行神经导航下右额颞叶病变切除术, 术后病理:(右额、颞占位)星形细胞瘤, WHOⅡ级, 脑灰质内见多灶发生, 局灶核分裂相较活跃, 肿瘤与周围皮质界限不清。免疫组织化学染色:p53(+8%), GFAP(+), Ki-67(+20%), Olig-2(+), MGMT(+2%)。术后恢复尚可, 出院。患者于2016年11月无明显诱因出现流涎, 睡觉时尤为明显, 复查头颅MRI提示脑胶质瘤复发, 于2016年11月再次行右额叶胶质瘤术后复发切除术。术后病理:(右额叶)高级别胶质瘤, 血管内皮增生显著, 未见明显坏死, WHOⅢ~Ⅳ级, 倾向胶质母细胞瘤, 免疫组织化学:ATRX(+), Olig-2(+), IDH-1(-), GFAP(+), MGMT(+5%), Ki-67(+60%), PD-1(-), p53(-), PD-L1(-)。2016年11月22日行术后放疗(因个人原因不同意化疗), 处方剂量CTV:5 400 cGy/30次, GTV:6 000 cGy/30次。2017年9月患者无意间发现右耳后方一大小约2 cm×2 cm包块, MRI提示:右侧腮腺占位性病变。考虑不排除炎性反应, 予以抗炎治疗后肿物进行性增大, 肿物大小约8 cm×8 cm, 边界尚清楚, 质地不均, 压痛, 无活动, 不影响正常咀嚼, 2017年10月12日行超声引导下右侧耳后肿物穿刺术, 病检:胶质细胞肿瘤, 见图 1, 免疫组织化学染色:Olig-2(+), MBP(+), GFAP(部分细胞+), Nestin(+), MEUN(-), Vimentin(部分细胞+), CD34(血管+), p53(+), NF(-), Syn(+), MGMT(-), IDH1(-), Ki-67阳性率约40%~60%。结合免疫组织化学染色, 诊断为间变少突胶质瘤(WHOⅢ级), 考虑腮腺转移。2017年10月24日给予右侧耳后肿物放疗, 头颅CT见图 2, 处方剂量:GTV:6 400 cGy/30次, CTV:5 400 cGy/30次, 期间复查血常规, 最低至白细胞计数(WBC):2.34×109/L、血红蛋白(HGB):84 g/L、血小板计数(PLT):26×109/L, 考虑不排除骨髓转移, 遂于2017年12月行骨髓穿刺术, 骨髓细胞检查报告:骨髓象可见分类不明细胞及细胞团, 结合病史考虑肿瘤骨髓转移可能性大, 见图 3。病理活检示:局部纤维组织增生, 异型细胞灶状浸润, 免疫组织化学染色:CD42b(巨核细胞+), CD71(红系细胞+), MPO(粒系细胞+), CD34(-), CD3(少数细胞+), CD20(少数细胞+)。特殊染色:网状纤维(2~3级, 灶性), Masson(±), PAS(+), 结合病史考虑肿瘤骨髓转移。颅外转移患者血常规三系减低, 给予对症支持治疗, 于2018年2月28日因多脏器功能衰竭死亡。
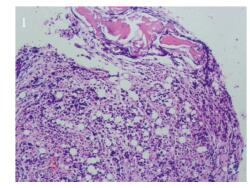
|
| 图 1 右侧腮腺穿刺活检病理(HE ×100) Figure 1 Biopsy of the right parotid gland tumor (HE ×100) |
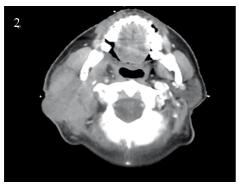
|
| 图 2 CT示右侧腮腺区占位 Figure 2 CT showed the right parotid mass |
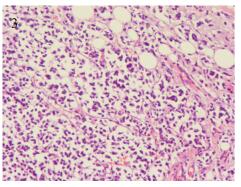
|
| 图 3 左侧髂后上棘骨髓活检病理(HE ×100) Figure 3 Biopsy of the left posterior superior iliac spine bone marrow (HE ×100) |
原发性脑胶质瘤颅外转移是很少见的, 腮腺及骨髓同时存在转移的案例更是罕见, 目前脑胶质瘤颅外转移的机制尚未明确, 查阅相关文献有以下几种:(1)既往恶性脑胶质瘤生存期短, 胶质母细胞瘤患者的预后差, 在确诊之后平均生存期为8~10月, 只有5%~10%的患者能活到24月[1], 患者还未出现颅外转移就已经死亡。但随着手术、放化疗在胶质瘤治疗领域内的发展, 恶性胶质瘤患者生存时间得到显著延长, 这可能是导致颅外转移发病率上升的一个原因[2]。(2)多数(约96%)中枢神经系统以外转移病例发生于原发肿瘤手术切除之后[3]。未行手术就发生中枢神经系统以外转移的脑胶质瘤非常罕见[4]。查阅相关文献, 就可能是由于手术破坏了血脑屏障结构, 血管内皮细胞结合处出现裂缝或网眼从而导致颅外转移[5]。(3)颅内原发肿瘤沿淋巴道远处播散, 这也可能是引起颅外转移的一个机制。虽然脑与脊髓内并没有淋巴道, 但当肿瘤细胞浸润、穿透脑脊膜, 就可能通过淋巴道向颅外转移[6]。腮腺转移最常见的是淋巴传播, 但也可能由于术中肿瘤细胞经脑室引流管直接或者血行播散。或经皮切口, 行额颞骨开颅手术, 由于靠近腮腺, 在手术期间肿瘤细胞可以直接移位到皮下结缔组织中[7]。本例患者既往行右侧额颞叶部开颅术, 并存在右侧腮腺转移, 考虑与上述机制有关。此外, 中枢神经系统以外最常见转移的胶质瘤为多形性胶质母细胞瘤, 其余依次为髓母细胞瘤、室管瘤、星形细胞瘤, 少突胶质细胞瘤最不易发生转移[8]。间变少突胶质瘤最容易发生颅外转移的部位是骨与骨髓。转移性少突胶质细胞瘤对骨和骨髓的高度偏好的原因可能与神经细胞黏附分子(NCAM)的表达有关, 这可能也是骨髓维持微环境和造血功能的基础。同类NCAM之间的相互结合, 可能是少突胶质细胞瘤在骨和骨髓中种植的分子基础[9]。胶质瘤骨髓转移可通过免疫组织化学染色中神经胶质纤维酸性蛋白(GFAP)检测, GFAP是胶质肿瘤来源的敏感和特异性标志物, 有助于确认是否由胶质起源[10]。本例患者由于已确诊脑胶质瘤并且存在颅外转移的情况, 同时结合病史考虑存在骨髓转移, 遂未行GFAP检测。综上, 对于有过多次手术或存在脑胶质瘤复发的患者, 出现其他部位占位或其他系统症状时, 要及时通过查体、影像学检查及病理确定是否存在颅外转移情况。
| [1] | Ogungbo BI, Perry RH, Bozzino J, et al. Report of GBM metastasis to the parotid gland[J]. J Neurooncol, 2005, 74(3): 337–8. DOI:10.1007/s11060-005-1480-9 |
| [2] | 孙谦, 江浩, 汪庚明, 等. 恶性胶质瘤颅外转移2例报告并文献复习[J]. 中国神经肿瘤杂志, 2013, 11(3): 209–12. [ Sun Q, Jiang H, Wang GM, et al. Report of 2 cases of extracranial metastasis of malignant glioma and literature review[J]. Zhongguo Shen Jing Zhong Liu Za Zhi, 2013, 11(3): 209–12. ] |
| [3] | Fayeye O, Sankaran V, Sherlala K, et al. Oligodendroglioma presenting with intradural spinal metastases:an unusual cause of cauda equine syndrome[J]. J Clin Neurosci, 2010, 17(2): 265–7. DOI:10.1016/j.jocn.2009.05.029 |
| [4] | Ueda S, Mineta T, Suzuyama K, et al. Biologic characterization of a secondary glioblastoma with extracranial progression and systemic metastasis[J]. Neuro Oncol, 2003, 5(1): 14–8. DOI:10.1093/neuonc/5.1.14 |
| [5] | 任力, 郑吉春, 李德昌, 等. 脑少突胶质细胞瘤颅外转移临床病理观察[J]. 诊断病理学杂志, 2010, 17(4): 271–4. [ Ren L, Zheng JC, Li DC, et al. Brain oligodendroglioma with extracranial metastasis:a cliniclpathological study[J]. Zhen Duan Bing Li Xue Za Zhi, 2010, 17(4): 271–4. DOI:10.3969/j.issn.1007-8096.2010.04.011 ] |
| [6] | 李军钊, 贺世明, 张治国, 等. 间变型少突胶质细胞瘤发生中枢神经系统以外转移:附1例经验及文献回顾[J]. 转化医学电子杂志, 2014, 1(6): 1–12. [ Li JZ, He SM, Zhang ZG, et al. Occipital anaplastic oligodendroglioma with multiple organ metastases after a short clinical course:a case report and literature review[J]. Zhuan Hua Yi Xue Di Zi Za Zhi, 2014, 1(6): 1–12. ] |
| [7] | Kraft M, Lang F, Braunschweig R, et al. Parotid gland metastasis from glioblastoma multiforme:a case report and review of the literature[J]. Eur Arch Otorhinolaryngol, 2008, 265(6): 709–11. DOI:10.1007/s00405-007-0499-2 |
| [8] | Li G, Zhang Z, Zhang J, et al. Occipital anaplastic oligodendroglioma with multiple organ metastases after a short clinical course:a case report and literature review[J]. Diagn Pathol, 2014, 9: 17. DOI:10.1186/1746-1596-9-17 |
| [9] | Demeulenaere M, Duerinck J, DU Four S, et al. Bone Marrow Metastases from a 1p/19q Co-deleted Oligodendroglioma-A Case Report[J]. Anticancer Res, 2016, 36(8): 4145–9. |
| [10] | Rajagopalan V, Kamar F G E, Thayaparan R, et al. Bone marrow metastases from glioblastoma multiforme-A case report and review of the literature[J]. J Neurooncol, 2005, 72(2): 1 57–61. DOI:10.1007/s11060-004-3346-y |
 2018, Vol. 45
2018, Vol. 45


