文章信息
- 人乳腺癌相关成纤维原代细胞培养的改良方法
- An Modified Primary Culture Method of Breast Cancer-associated Fibroblasts
- 肿瘤防治研究, 2018, 45(10): 717-721
- Cancer Research on Prevention and Treatment, 2018, 45(10): 717-721
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0428
- 收稿日期: 2018-04-02
- 修回日期: 2018-06-29
2. 100700 北京,解放军陆军总医院乳腺科;
3. 100700 北京,解放军陆军总医院全军普通外科中心
2. Department of Breast Surgery, The PLA Army General Hospital, Beijing 100700, China;
3. Center of General Surgery of PLA, The PLA Army General Hospital, Beijing 100700, China
乳腺癌是女性发病率排名第一的恶性肿瘤,发病率呈逐年上升,且越来越年轻化。长期以来学者对乳腺癌的研究一直集中在乳腺癌癌细胞本身,对其周围环境的研究较少[1]。早在1889年,Stephen Paget就提出了著名的“种子与土壤”学说,经过100多年的反复验证,“种子与土壤”理论获得越来越多的证据支持[2]。其中癌相关成纤维细胞(CAFs)是肿瘤微环境中的主要成分之一,CAFs可通过分泌多种生长因子、趋化因子和细胞因子促进癌的发生、癌细胞的增殖、侵袭、转移及微环境中血管和淋巴管的形成[3-5]。因此,越来越多的学者对乳腺癌相关成纤维细胞(BCAFs)的来源、生物学特征、基因特征及其与乳腺癌发生发展的关系等产生了浓厚的兴趣,而获取BCAFs原代细胞是这些研究的基础[6]。目前国内常用Ⅰ型胶原酶消化法培养BCAFs原代细胞[7-9],但这种方法消化时间较长,易污染。本实验通过改良酶的类型和消化时间,采用Ⅱ型胶原酶加透明质酸酶消化组织块,成功探索出一种快速高效的人BCAFs原代细胞培养方法。
1 材料与方法 1.1 标本来源收集2017年3月至2018年2月解放军陆军总医院乳腺科20份乳腺癌患者的新鲜癌组织标本。无菌条件下,切取癌组织标本约1 cm3大小,放入无菌离心管中,在冰桶中迅速带回实验室。术后经病理确诊均为浸润性导管癌,其中Ⅰ期6例,Ⅱ期14例,患者年龄在40到65岁之间,术前均未进行放化疗,本研究征得患者或家属知情同意。
1.2 主要试剂与仪器磷酸盐缓冲液(PBS)、青霉素、链霉素(吉诺生物科技)、胎牛血清(FBS,HyClone),胰岛素-转铁蛋白-硒添加剂(ITS×100),0.25%胰酶,Ⅰ型胶原酶、Ⅱ型胶原酶、透明质酸酶Sigma,成纤维细胞生长因子(FGF,ScienCell),胰岛素样生长因子-1(IGF-1, Peproteeh)、α-平滑肌肌动蛋白抗体(anti-alpha smooth muscle actin, Abcam)、波形蛋白抗体(anti-vimentin, Abcam),二抗,山羊封闭血清(碧云天)、DMEM/F12培养基(Corning),100 μm筛网及培养皿,氢化克的松注射液(天津金耀氨基酸)。
1.3 实验前准备(1)完全细胞培养基的配制见表 1;(2)转运及冲洗液:PBS+青链双抗(1 000 U/ml青霉素、1 000 U/ml链霉素);(3)改良酶消化液:0.01 mg/ml Ⅱ型胶原酶+0.01 mg/ml透明质酸酶+5% FBS;(4)传统酶消化液:0.1 mg/ml Ⅰ型胶原酶。
(1)在超净工作台内,用4℃预冷的冲洗液冲洗组织块,洗净组织块上的血迹,并用眼科镊去除坏死组织和脂肪组织;(2)在含有DMEM/F12的培养皿中用眼科剪剪切组织块,剪成约1 mm3的碎片,分成质量相同的两份,随机标记为改良组、传统组;(3)1 500 r/min,离心5 min,去上清液。加入5倍体积的消化液,改良组加入改良酶消化液,传统组加入传统酶消化液;(4)混匀,转移至培养皿中,置于37℃温箱静置。改良组消化10 min,传统组组消化10 h;(5)加入DMEM稀释消化液,混匀,过100 μm筛网,去除剩余组织碎片;(6)1 000 r/min,离心5 min,去上清液。加入完全细胞培养液,吹打混匀,进行细胞计数后调整合适的细胞浓度转入培养皿中。置于37℃、5%CO2培养箱中培养;(7)隔日换液,12~14天可以进行细胞传代和纯化。
1.5 观察项目及检测指标 1.5.1 分离的细胞总量在原代培养转入培养皿之前,倒置相差显微镜下用细胞计数板计数每毫升细胞悬液中的细胞数,重复3次。细胞总量=每毫升细胞数×细胞悬液的体积。
1.5.2 免疫荧光鉴定BCAFs纯度通过α-SMA和Vimentin蛋白的表达确定BCAFs的纯度[10-12]。具体如下:(1)把1×105个每毫升浓度的细胞悬液加入到有无菌圆形盖玻片的24孔板中,置于37℃、5% CO2培养箱培养48 h,48 h后去除培养液;(2)4%多聚甲醛室温固定细胞30 min;(3)0.25%Triton-X-100室温通透15 min;(4)10%的山羊血清封闭1 h;(5)4℃一抗(Anti-α-SMA和Anti-vimentin)孵育过夜;(6)PBS清洗,加入荧光二抗,室温避光孵育2 h;(7)加入DAPI即4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole),室温15 min,封片,荧光显微镜下观察。随机计数5个高倍镜下被染色的细胞占细胞总数的百分比计算BCAFs的纯度。BCAFs的纯度=被染色的细胞/细胞总数×100%。
1.5.3 贴壁BCAFs原代细胞的增殖活力通过MTT法获得贴壁细胞的增殖活力。在细胞计数后,调整细胞浓度为1×105个每毫升,接种于96孔板中,每孔100 μl(1×104个细胞),CO2培养箱培养48 h,去除培养液,每孔加入20 μl的MTT溶液,孵育4 h后,每孔加入150 μl的DMSO溶液,振荡10 min,使用酶标仪测得570 nm处吸光度值(OD值)。取3个孔的均值。
1.5.4 BCAFs原代细胞的形态学特征在倒置显微镜下观察不同时间段BCAFs原代细胞的形态学特征。
1.6 统计学方法采用SPSS16.0统计软件对实验数据进行统计分析,计量资料采用均数±标准差(x±s)表示,采用配对设计的t检验,P < 0.05为差异有统计学意义。
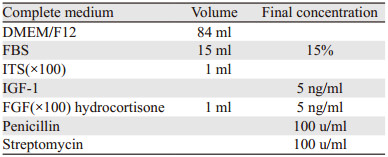
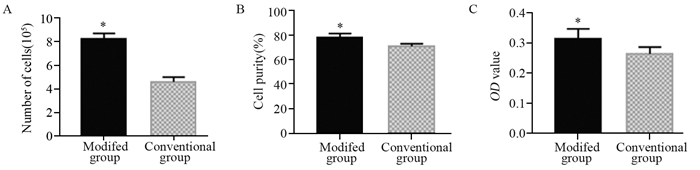
2 结果 2.1 分离的原代细胞总量改良酶消化法明显比传统酶消化法分离到的细胞数多。改良方法所得细胞总数约为(8.26±0.46)×105个,而传统方法所得细胞总数约为(4.61±0.40)×105个,差异有统计学意义(P=0.000),见图 1A。
|
| *: P < 0.001, compared with conventional group; n=20 图 1 消化获得的细胞量(A)、细胞纯度(B)、培养48 h后贴壁细胞活性(C) Figure 1 Cell amount(A), cell purity(B) and adherent cells activity after 48h culture(C) obtained by digestion from two groups |
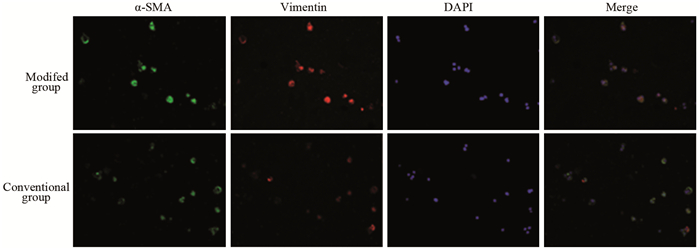
培养的原代细胞经α-SMA和Vimentin染色后,荧光显微镜观察可见α-SMA被染成绿色,Vimentin被染成红色,都位于细胞质中,而DAPI染成蓝色,位于细胞核中,见图 2。通过α-SMA和Vimentin确定BCAFs。计数得出两种方法所获纯度百分比,传统组纯度约为(70.85±2.23)%,改良组的纯度约为(77.85±3.65)%,差异有统计学意义(P=0.000),见图 1B。
|
| 图 2 改良组和传统组BCAFs免疫荧光检测结果(×100) Figure 2 Immunofluorescence of BCAFs in modified group and conventional group (×100) |
两种方法获得的48 h贴壁原代细胞的增殖活力通过吸光度值OD代表。传统组细胞OD值为(0.26±0.02),改良组OD值为(0.31±0.03),差异有统计学意义(P=0.000),见图 1C。
2.4 细胞形态学观察经改良酶消化法培养3天后,可见细胞贴壁并伸展,见图 3A,培养7~12天细胞可长满培养板的底部,呈铺路石样,多数为单个细胞核,胞质内颗粒较多,局部细胞有融合及重叠生长,见图 3B,细胞传代后细胞呈纺锤体形或长梭形,长短不一,胞质透明,细胞排列不规则,有时呈旋涡状生长,见图 3C。

|
| A, B: ×250; C: ×100 图 3 不同时间段BCAFs的细胞特征 Figure 3 Morphological characteristics of BCAFs at different times |
人BCAFs原代培养是从乳腺癌患者癌组织中直接分离BCAFs,生物学特性变化不大,最大程度保留原来的遗传特性,也最接近其在体内的生长特性,适宜做各种实验研究[13]。常用培养原代细胞的方法有组织块贴壁法和酶消化法,由于乳腺组织含有较多的脂肪,因此使用贴壁法培养细胞时,组织块贴壁较困难,且培养时间较长。因此在培养BCAFs原代细胞时,一般采用酶消化法[14]。
酶消化法常用的酶有胰酶和胶原酶,其中胰酶的消化能力强,适用于消化细胞间质较少的软组织,而乳腺癌组织一般较硬,含有较多BCAFs,使用胰酶时,浓度、温度和时间不易把握,往往会导致消化过度,造成细胞损伤。因此在培养BCAFs原代细胞时使用较少[15]。胶原酶仅对细胞间质有消化作用,消化作用较温和,适于消化分离纤维性组织及癌组织。胶原酶又分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ型以及肝细胞专用胶原酶。每种酶消化的组织类型也不尽相同。胶原酶Ⅰ:适用于上皮、肺、脂肪和肾上腺等组织细胞的分离;胶原酶Ⅱ:适用于肝脏、骨、甲状腺、心脏和唾液腺等组织;胶原酶Ⅲ型对哺乳动物的组织有广谱的消化作用;胶原酶Ⅳ:包含至少7种蛋白酶成分,能消化多种组织;胶原酶Ⅴ:包含至少7种蛋白酶成分,可用于胰腺小岛组织的分离,将结缔组织分离成单个细胞[16],而适合分离人乳腺癌组织中的BCAFs原代细胞的方法一直在探索阶段,不同研究者使用的方法也不尽相同[17-18]。
本研究对传统的人BCAFs细胞培养方法进行了改进,传统酶消化法需要消化长达10 h,早期消化出来的细胞在消化液中活性容易降低,长时间的消化增加了细胞污染的概率,加大了细胞培养的工作难度。本方法在选用Ⅱ型胶原酶消化的基础上增加了透明质酸酶,透明质酸酶可以水解透明质酸,降低细胞间质的黏性,加速细胞分离[19]。改良后分离细胞仅需10 min,节约了细胞培养的时间,降低了污染的概率,且改良后可以获得更多的细胞,细胞的活性更好,细胞纯度更高。
在实验过程中,经过多次探索发现有以下几点需要注意:(1)取材:尽量在癌组织丰富的区域取材,取材完毕放入含有转运液的无菌离心管中,用冰桶带回实验室,尽快开始实验,间隔时间应不超过4 h;(2)剪切:剪切过程要在冰袋上完成,降低细胞代谢,尽可能的去除脂肪组织和血迹;(3)使用改良酶消化法消化时,前7 min在37℃培养箱中消化,剩余时间可以在镜下观察消化,适当减少或增加消化时间,但应不超过15 min;(4)离心:在离心组织块时,离心机转数可以为1 500 r/min,但离心细胞时要降低转数,避免损伤细胞;(5)由于组织块较少,所获细胞量较少,因此前期培养时选用12孔板较好,待细胞长满80%~90%时再传代到培养瓶中。前期转入12孔板时,培养液不要加太多,24 h后换液时可以适量增加培养液;(6)24 h后未贴壁的细胞仍有贴壁的可能,可以收集继续培养。
综上所述,本文所介绍的改良酶消化法可以获得产量多、活力好、纯度高的BCAFs细胞,且消化时间明显缩短,是一种较好的培养人BCAFs原代细胞的方法,为后期探究其在乳腺癌中的功能研究建立了良好的基础。
| [1] | 李智勇, 白雪. 三阴性乳腺癌分子分型的研究进展[J]. 新医学, 2018, 49(2): 77–81. [ Li ZY, Bai X. Research progress on molecular typing of triple-negative breast cancer[J]. Xin Yi Xue, 2018, 49(2): 77–81. DOI:10.3969/j.issn.0253-9802.2018.02.001 ] |
| [2] | 马齐襄, 朱晓丹, 胡凯文, 等. 肿瘤转移的种子与土壤学说新认识[J]. 肿瘤防治研究, 2015, 42(10): 1049–53. [ Ma QX, Zhu XD, Hu KW, et al. New Thoughts upon Seed and Soil Hypothesis of Tumor Metastasis[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(10): 1049–53. DOI:10.3971/j.issn.1000-8578.2015.10.021 ] |
| [3] | Jung YY, Lee YK, Koo JS. Expression of cancer-associated fibroblast-related proteins in adipose stroma of breast cancer[J]. Tumor Biol, 2015, 36(11): 8685–95. DOI:10.1007/s13277-015-3594-9 |
| [4] | Donnarumma E, Fiore D, Nappa M, et al. Cancer-associated fibroblasts release exosomal microRNAs that dictate an aggressive phenotype in breast cancer[J]. Oncotarget, 2017, 8(12): 19592–608. |
| [5] | Angelucci C, Maulucci G, Colabianchi A, et al. Stearoyl-CoA desaturase 1 and paracrine diffusible signals have a major role in the promotion of breast cancer cell migration induced by cancer-associated fibroblasts[J]. Br J Cancer, 2015, 112(10): 1675–86. DOI:10.1038/bjc.2015.135 |
| [6] | Buchsbaum RJ, Oh SY. Breast Cancer-Associated Fibroblasts: Where We Are and Where We Need to Go[J]. Cancers(Basel), 2016, 8(2): E19. |
| [7] | 张春敏, 郭变琴, 吴立翔. 乳腺癌中肿瘤相关成纤维细胞原代分离、培养及相关生物学特性分析[J]. 肿瘤研究与临床, 2017, 29(8): 510–4. [ Zhang CM, Guo BQ, Wu LX. Primary isolation, culture and biological property analysis of breast cancer-associated fibroblast[J]. Zhong Liu Yan Jiu Yu Lin Chuang, 2017, 29(8): 510–4. DOI:10.3760/cma.j.issn.1006-9801.2017.08.002 ] |
| [8] | 吴潇然. 乳腺癌基质成纤维细胞分离培养的优化及对乳腺癌细胞作用的初步研究[J]. 天津医科大学学报, 2017, 23(6): 489–92, 501. [ Wu XR. Optimization of isolation and culture of breast cancer stromal fibroblasts and their effects on breast cancer cells MDA-MB-231 and MCF7[J]. Tianjin Yi Ke Da Xue Xue Bao, 2017, 23(6): 489–92, 501. ] |
| [9] | 彭琼乐, 孙艳, 赵浏阳, 等. 人乳腺癌相关成纤维细胞的原代培养及其生物学特性[J]. 中国生物制品学杂志, 2012, 25(10): 1368–72. [ Peng QL, Sun Y, Zhao LY, et al. Primary culture and biologic characteristics of human breast cancer-associated fibroblasts[J]. Zhongguo Sheng Wu Zhi Pin Xue Za Zhi, 2012, 25(10): 1368–72. ] |
| [10] | Shan T, Chen S, Chen X, et al. Cancer-associated fibroblasts enhance pancreatic cancer cell invasion by remodeling the metabolic conversion mechanism[J]. Oncol Rep, 2017, 37(4): 1971–9. DOI:10.3892/or.2017.5479 |
| [11] | Wang X, Zhang W, Sun X, et al. Cancer-associated fibroblasts induce epithelial-mesenchymal transition through secreted cytokines in endometrial cancer cells[J]. Oncol Lett, 2018, 15(4): 5694–702. |
| [12] | 李盼, 蔡红兵. 一种改良宫颈癌相关成纤维细胞原代培养方法的建立[J]. 武汉大学学报(医学版), 2017, 38(2): 193–7. [ Li P, Cai HB. Establishment of modified primary culture method of cervical cancer associated fibroblasts[J]. Wuhan Da Xue Xue Bao(Yi Xue Ban), 2017, 38(2): 193–7. ] |
| [13] | 蔡慧云, 于波, 白雪, 等. 简便人大肠癌原代细胞培养方法的探讨[J]. 临床军医杂志, 2011, 39(4): 611–2. [ Cai HY, Yu B, Bai X, et al. Analysis on method of primary cell culture of human colorectal cancer in vitro[J]. Lin Chuang Jun Yi Za Zhi, 2011, 39(4): 611–2. DOI:10.3969/j.issn.1671-3826.2011.04.03 ] |
| [14] | Qiu LQ, Lai WS, Stumpo DJ, et al. Mouse Embryonic Fibroblast Cell Culture and Stimulation[J]. Bio Protoc, 2016, 6(13): e1859. |
| [15] | 苍宏宇. 乳腺癌原代细胞培养方法的研究进展[J]. 内蒙古医学杂志, 2014, 46(3): 316–9. [ Cang HY. Research Progress on Her -2/neu and Breast Cancer[J]. Neimenggu Yi Xue Za Zhi, 2014, 46(3): 316–9. ] |
| [16] | 黄成龙, 黎庆, 王雷, 等. 两种方法培养骨质疏松症小鼠脂肪干细胞的比较[J]. 中国组织工程研究, 2017, 21(29): 4654–9. [ Huang CL, Li Q, Wang L, et al. A comparative study on two culture methods for adipose-derived stem cells from mice with osteoporosis[J]. Zhongguo Zu Zhi Gong Cheng Yan Jiu, 2017, 21(29): 4654–9. DOI:10.3969/j.issn.2095-4344.2017.29.011 ] |
| [17] | Li Y, Rong G, Kang H. Taxotere-induced elevated expression of IL8 in carcinoma-associated fibroblasts of breast invasive ductal cancer[J]. Oncol Lett, 2017, 13(3): 1856–60. DOI:10.3892/ol.2017.5612 |
| [18] | Hosein AN, Livingstone J, Buchanan M, et al. A functional in vitro model of heterotypic interactions reveals a role for interferon-positive carcinoma associated fibroblasts in breast cancer[J]. BMC Cancer, 2015, 15(1): 130–41. DOI:10.1186/s12885-015-1117-0 |
| [19] | 苏康, 吉爱国. 透明质酸酶的研究进展[J]. 生物技术通报, 2014, 30(3): 15–21. [ Su K, Ji AG. Research of hyaluronidases and future development[J]. Sheng Wu Ji Shu Tong Bao, 2014, 30(3): 15–21. ] |
 2018, Vol. 45
2018, Vol. 45