文章信息
- 敲低膜联蛋白A5对人胃癌细胞系MKN-45增殖的作用
- Annexin A5 Knockdown Prompts Proliferation of Gastric Cancer MKN-45 Cells
- 肿瘤防治研究, 2018, 45(10): 734-738
- Cancer Research on Prevention and Treatment, 2018, 45(10): 734-738
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0396
- 收稿日期: 2018-03-26
- 修回日期: 2018-06-20
胃癌是常见的消化道恶性肿瘤之一,发病率和死亡率分别为42.6%和45.0%,位居恶性肿瘤前列[1]。近年来以手术为主的综合治疗使胃癌的治愈率有所提高,但五年生存率仍没有明显改善。膜联蛋白A5(annexin A5, ANXA5)是一种钙离子依赖的磷脂结合蛋白,同时具有促瘤和抑瘤的双重作用[2-4]。研究显示,ANXA5通过调控上皮间质转化影响胃癌的发生发展[5],但对于ANXA5影响胃癌发生发展机制尚不清楚。因此本研究拟通过抑制ANXA5在胃癌MKN-45细胞中的表达,观察胃癌细胞增殖和凋亡的变化,从而为探讨胃癌发生发展的机制提供理论依据及新的治疗策略。
1 材料与方法 1.1 细胞株与主要试剂人胃癌MKN-45细胞株购自上海中科院细胞库,常规培养。细胞培养液(DMEM)及胎牛血清为美国Gibco公司产品,CO2培养箱(HER Aceu150)为德国贺利公司产品。靶向ANXA5的siRNA(正义链序列:GGGCTGATGCAGAAACTCTTCGGAA)、阴性siRNA(货号: 1082140)和LipofectamineTM2000转染试剂及TRIzol为美国Invitrogen公司产品。RIPA裂解液与5×蛋白上样缓冲液(Loading Buffer)购自上海贝博生物公司,BCA蛋白定量试剂盒购自北京索莱宝生物有限公司。ANXA5、Cyclin D1及β-actin兔抗人单克隆抗体购自美国Abcam公司,PCNA鼠抗人单克隆抗体为武汉三鹰生物技术有限公司产品,羊抗兔IgG及羊抗鼠IgG抗体购自美国KPL公司。Takara反转录试剂盒购自大连宝生物工程有限公司,MTT增殖及细胞毒性检测试剂盒为碧云天公司产品,Annexin V-FITC/PI凋亡试剂盒购自联科生物公司。MK3酶联检测仪购自美国Thermo公司,化学发光仪(Tanon 6100)购自上海天能公司;紫外分光光度计(DU 800)为美国贝克曼库尔特公司产品。
1.2 siRNA转染MKN-45细胞于60 mm培养皿中培养MKN-45细胞,转染前一天将细胞按(3~5)×104每孔种植于6孔板中,使细胞密度在24 h内达到40%~70%;将细胞分为干扰组、阴性对照组和空白对照组。于无血清DMEM培养液中加入30 pmol/L siRNA Oligo,使终体积为500 μl,轻柔混匀;于无血清DMEM培养液中加入5 μl脂质体2000转染试剂,使终体积为500 μl,轻柔混匀,室温放置5 min;将靶向ANXA5 siRNA和阴性对照siRNA分别与脂质体2000转染试剂混合,室温放置20 min后分别将混合物均匀加至各组培养孔中,空白对照组不予处理。转染后6 h更换含血清培养液,48 h后收集细胞。
1.3 Western blot检测siRNA转染后MKN-45细胞ANXA5、PCNA、Cyclin D1的蛋白表达细胞转染后48 h,收集各组细胞,每孔加150 μl RIPA裂解液充分裂解细胞,BCA蛋白定量试剂盒检测蛋白浓度,与5×Loading Buffer混合后煮沸10 min,加样,每样品孔30 μg,12%SDS-PAGE凝胶电泳(80~120 V 2 h),电泳后湿转法(80 V 1.5 h)转至PVDF膜,5%脱脂奶粉封闭2 h,ANXA5、Cyclin D1兔抗人单克隆一抗(1:1000)及PCNA鼠抗人单克隆一抗(1:5000)4℃孵育过夜;TBST洗膜(15 min、10 min、5 min各一次);羊抗兔、鼠抗兔二抗(1:5000)室温孵育1.5 h;TBST洗膜(10 min、10 min、10 min各一次);ECL化学发光法检测目的蛋白条带。
1.4 qRT-PCR检测siRNA转染后MKN-45细胞ANXA5 mRNA的表达转染后48 h,每孔加1 ml TRIzol,提取细胞总RNA,以其为模板使用Takara反转录试剂盒反转为cDNA。以β-actin为内参,qRT-PCR法检测各组ANXA5的mRNA表达水平。β-actin上游引物:5'-TGGCACCCAGCACAATGAA-3',下游引物:5'-CTAAGTCATAGTCCGCCTAGAAGCA-3'。ANXA5的基因序列上游引物:5'-CTGACTTCCCTGGATTTG-3',下游引物:5'-TGAAGGAGAACCACCAAC-3';反应体系20 μl,SYBR Premix Ex TaqⅡ(2×)10 μl,上下游引物各0.8 μl,ROX Reference DyeⅡ0.4 μl,cDNA模板2 μl,ddH2O 6 μl。反应条件为:预变性95℃ 30 s,PCR反应95℃ 5 s,60℃ 20 s,共40个循环。
1.5 MTT法检测ANXA5低表达对MKN-45细胞增殖的影响细胞转染48 h后,按1 000个每孔接种于96孔板,每24 h检测一次。检测前每孔加10 μl(5 mg/ml)的MTT溶液,37℃孵育4 h后弃孔内培养液加150 μl DMSO溶解结晶物,振荡10 min,酶联免疫检测仪测波长490 nm处OD值,每次设6个复孔取其平均值。按照OD490值大小绘制细胞增殖曲线。
1.6 细胞克隆形成实验观察ANXA5低表达对MKN-45细胞增殖的影响胰酶消化处于对数生长期的各实验组细胞,以1 000个每孔接种于6孔板中,加入2 ml DMEM培养液,5%CO2、37℃培养箱内培养;至出现肉眼可见的细胞团时,弃培养液,PBS漂洗2次,4%多聚甲醛固定15 min,去固定液,加1 ml Giemsa染液染色10 min,然后流水慢慢洗去染色液,空气干燥。肉眼计数克隆数或者倒置显微镜下计数大于50个细胞的克隆数,统计分析并拍照。每种细胞设3个平行对照孔。
1.7 流式细胞术检测ANXA5低表达对MKN-45细胞凋亡的影响细胞转染48 h后,收集各组细胞,预冷的PBS洗3次,将细胞重悬于1 ml的结合缓冲液中,调整细胞密度为1×106每毫升。取500 μl细胞悬液于流式管中,加入5 μl Annexin V-FITC、10 μl碘化丙啶(PI)染液,室温下孵育5 min,流式细胞术检测细胞凋亡。
1.8 统计学方法实验数据均以均值±标准差(x±s)表示,应用SPSS19.0统计学软件对数据进行处理,组间两两比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 siRNA转染ANXA5效果鉴定Western blot和qRT-PCR检测ANXA5蛋白表达,见图 1。siRNA干扰组较阴性组和空白组ANXA5在蛋白和RNA水平表达均明显下调, (0.068±0.023)vs.(0.418±0.042)(0.408±0.044); (0.047±0.010)vs.(0.169±0.012)(0.172±0.016),差异有统计学意义(均P < 0.05),结果表明siRNA能有效地抑制ANXA5的表达。
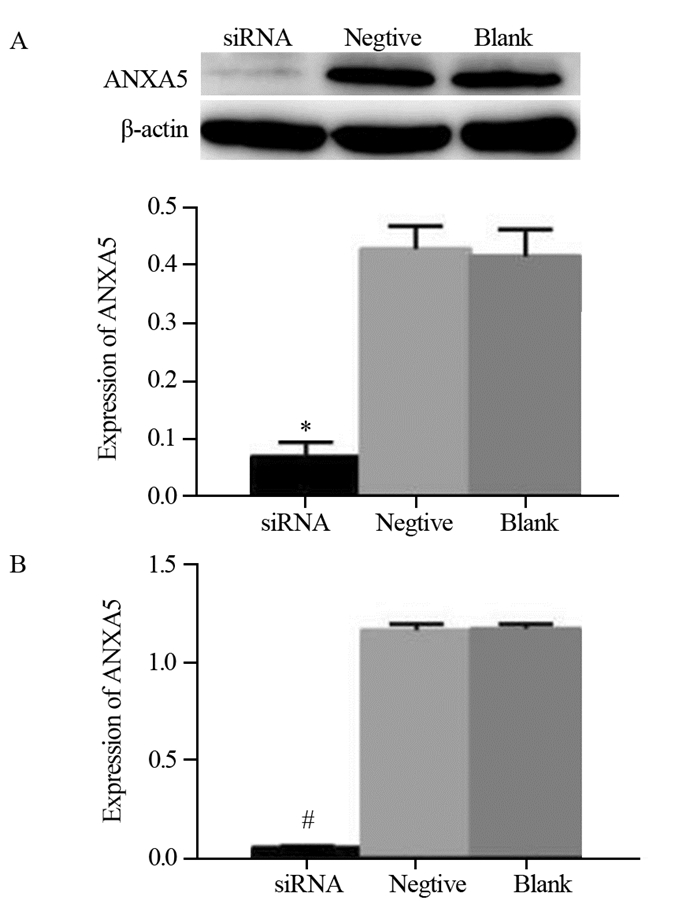
|
| *: P < 0.05, #: P < 0.05, compared with the other two groups 图 1 Western blot(A)和qRT-PCR检测ANXA5 siRNA(B)的表达 Figure 1 Expression of ANXA5 siRNA detected by Western blot(A) and qRT-PCR(B) |
MTT法检测结果见图 2,与阴性组和空白对照组相比,siRNA干扰组细胞增殖速率明显上调,差异有统计学意义(P < 0.05);阴性组和空白组比较差异无统计学意义(P > 0.05)。结果表明ANXA5低表达能促进MKN-45细胞增殖。
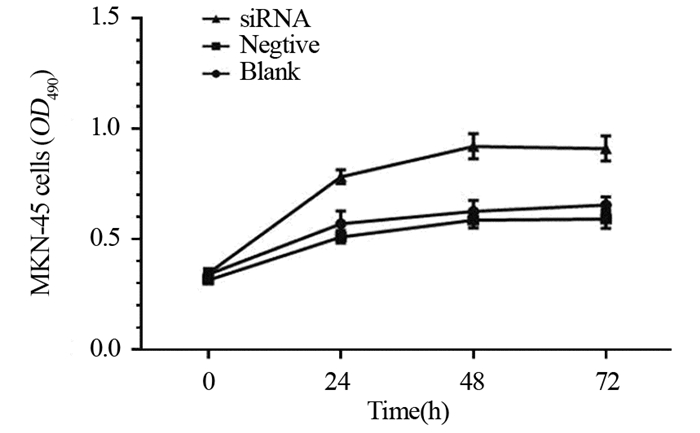
|
| 图 2 ANXA5低表达抑制MGC-803细胞的增殖 Figure 2 Low ANXA5 expression inhibited proliferation of MGC-803 cells |
细胞集落形成实验见图 3,与阴性对照组和空白对照组比较,siRNA干扰组细胞克隆数明显增多,(762±23)vs.(374±19)(351±20)个,差异有统计学意义(P < 0.05)。阴性对照组和空白对照组比较(374±19)vs.(351±20)个,差异无统计学意义(P > 0.05)。结果说明ANXA5低表达对MKN-45细胞集落形成能力具有促进作用。
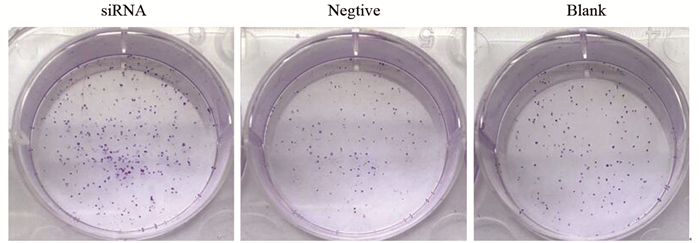
|
| 图 3 ANXA5低表达对MGC-803细胞集落形成的影响 Figure 3 Effect of low ANXA5 expression on MGC-803 cells colony formation |
siRNA干扰组Cyclin D1和PCNA的表达显著高于阴性对照组和空白对照组,(0.484±0.021)vs.(0.256±0.031)(0.246±0.023),(0.724±0.024)vs.(0.264±0.018)(0.252±0.016),阴性对照组和空白对照组差异无统计学意义(P > 0.05),见图 4。

|
| *: P < 0.05, #: P < 0.05, compared with the other two groups 图 4 Western blot检测Cyclin D1和PCNA的表达 Figure 4 Expression of Cyclin D1 and PCNA detected by Western blot |
siRNA干扰组细胞凋亡率与阴性对照组和空白对照组相比无明显改变(0.551±0.032)vs.(0.535±0.029)(0.538±0.019),说明ANXA5低表达对胃癌MKN-45细胞凋亡无明显影响,见图 5。
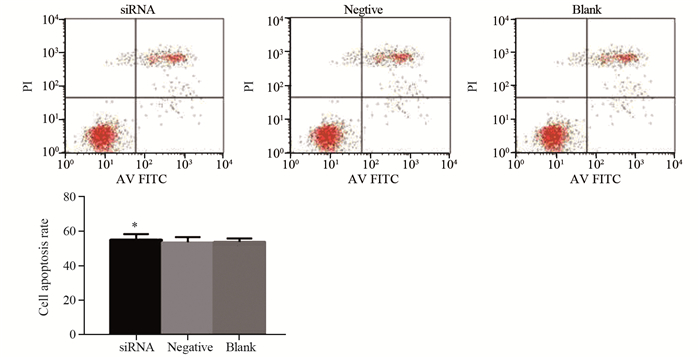
|
| *: P > 0.05, compared with the other two groups 图 5 ANXA5低表达对MKN-45细胞凋亡的影响 Figure 5 Effect of low ANXA5 expression on MKN-45 cells apoptosis |
膜联蛋白A5(ANXA5)是膜联蛋白家族中分布最广、含量最丰富成员之一,由保守的C端和特异的N末端构成,具有膜融合、离子通道、信号转导等作用。由于ANXA5促瘤和抑瘤的双重调控作用及其与磷脂酰丝氨酸有极强的亲和力等多种生物学特性,许多学者已将其作为分子靶点,从多种角度探索其在肿瘤发生发展与治疗方面的研究[6-9]。研究表明,ANXA5在多种肿瘤组织中异常表达[10],其中在乳腺癌、宫颈癌、结肠癌中的表达显著上调[11-13],在肺癌中的表达下调[14]。说明ANXA5的表达具有组织学特异性。Sun等[15]发现,抑制肝癌细胞中ANXA5的表达后,细胞增殖、侵袭、转移等能力明显下降;Shin等[16]亦发现ANXA5通过抑制PKC信号通路活性下调PAI-2而促进前列腺癌细胞凋亡。而Wehder等[17]通过RNA干扰技术下调ANXA5在口腔癌A431细胞中的表达,细胞增殖速率显著下降,说明ANXA5能够促进口腔癌细胞增殖。以上研究表明,ANXA5在不同肿瘤中所表现的基因属性不同。
本研究采用脂质体转染法转染靶向ANXA5 siRNA,抑制ANXA5在胃癌细胞中的表达后,MTT和平板克隆形成实验结果显示,siRNA干扰组胃癌MKN-45细胞增殖能力和克隆形成能力明显上调。我们又检测了Cyclin D1和增殖核抗原PCNA的表达。Cyclin D1是G1期细胞周期素,具有驱动细胞由G1期进入S期,促进细胞增殖的作用。生理状态下[18],Cyclin D1在细胞进入S期后迅速分解,过度表达则可使G1/S调控点失控,细胞不断进入细胞周期,从而造成恶性增生发生癌变。本研究结果显示,siRNA干扰组Cyclin D1表达显著上调,推测ANXA5表达下调后可以增加Cyclin D1的表达,促进细胞进入S期进程,因而促进了细胞增殖。PCNA是一种增殖核抗原,作为DNA聚合酶的附属蛋白,通过促进DNA聚合酶延伸DNA[19],从而促进细胞增殖,是评价细胞增殖状态的一个指标[20]。本研究发现,siRNA干扰组PCNA表达明显高于阴性对照组,说明ANXA5低表达促进了胃癌细胞增殖。以上研究均提示,ANXA5在胃癌细胞中具有抑癌基因属性。同时我们又采用流式细胞术检测了细胞凋亡情况,结果显示,胃癌MKN-45细胞凋亡率无明显改变。虽然有文献报道ANXA5可调控促凋亡蛋白(Bcl-2、Bax)[21],但在胃癌中的具体机制尚有待进一步研究。
综上研究结果提示,ANXA5在胃癌中显示抑癌基因属性,与Bortner等[14]研究一致。因此,推断ANXA5在胃癌的发生发展过程中具有抑制胃癌细胞增殖的作用。当胃癌MKN-45细胞中ANXA5的表达受抑后,根据Cyclin D1表达上调及结果,初步推测其可能是通过调控细胞周期来调控胃癌细胞增殖,因此我们在今后的研究中将会对ANXA5的作用途径进行验证,以及对ANXA5参与的细胞调控通路进行更为深入的研究。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–86. DOI:10.1002/ijc.29210 |
| [2] | Peng B, Liu S, Gun C, et al. ANXA5 level is linked to in vitro and in vivo tumor malignancy and lymphatic metastasis of murine hepatocarcinoma cell[J]. Future Oncol, 2016, 12(1): 31–42. DOI:10.2217/fon.15.289 |
| [3] | Wu L, Yang L, Xiong Y, et al. Annexin A5 promotes invasion and chemoresistanee to temozolomide in glioblastoma multiforme cells[J]. Tumour Biol, 2014, 35(12): 12327–37. DOI:10.1007/s13277-014-2545-1 |
| [4] | Gong LL, Zhao HQ, Wang L, et al. Upregnlation of annexin A5 affects the biological behaviors of lung squamous carcinoma cells in vitro[J]. Chin Sci Bull, 2014, 59(28): 3610–20. DOI:10.1007/s11434-014-0301-y |
| [5] | Zhu Y, Liu Y, Qian Y, et al. Research on the efficacy of celastrus orbiculatus in suppressing TGF-β1-induced epithelial-mesenchymal transition by inhibiting HSP27 and TNF-α-induced NF-κB/snail signaling pathway in human gastric adenocarcinoma[J]. BMC Complement Ahem Med, 2014, 14: 433. DOI:10.1186/1472-6882-14-433 |
| [6] | Tiscia GL, Dørum E, Myklebust CF, et al. Functional characterization of annexin A5 gene promoter allelic variants[J]. Thromb Res, 2016, 144: 93–9. DOI:10.1016/j.thromres.2016.06.009 |
| [7] | Wang C, Chen YW, Zhang L, et al. Melanoma cell surface-expressed phosphatidylsefine as a therapeutic target for cationic anticancer peptide, tempori-1CEa[J]. J Drug Target, 2016, 24(6): 548–56. DOI:10.3109/1061186X.2015.1113539 |
| [8] | Guillen KP, Restuccia A, Kurkjtan C, et al. Armexin V-directed enzyme prodmg therapy plus doeetaxel for the targeted treatment of pancreatic cancer[J]. Pancreas, 2015, 44(6): 945–52. DOI:10.1097/MPA.0000000000000343 |
| [9] | Gieseler F, Gamperl H, Theophil F, et al. Using annexin V-coated magnetic beads to capture active tissue factor-bearing microparticles from body fluids[J]. Cell Biol Int, 2014, 38(2): 277–81. DOI:10.1002/cbin.v38.2 |
| [10] | Fatimathas L, Moss SE. Annexins as disease modifiers[J]. Histol Histopathol, 2010, 25(4): 527–32. |
| [11] | 李欣, 高福禄, 李建团, 等. 膜联蛋白A5在人子宫颈鳞癌组织中的表达[J]. 解剖学报, 2008, 39(6): 923–6. [ Li X, Gao FL, Li JT, et al. Expression of Annexina5 in human uterine cervical squamous cell carcinomas[J]. Jie Pou Xue Bao, 2008, 39(6): 923–6. DOI:10.3321/j.issn:0529-1356.2008.06.030 ] |
| [12] | 吴韩梅, 张淼, 林健敏. 膜联蛋白A5在乳腺癌中的表达及意义[J]. 广东医学, 2013, 34(7): 1097–9. [ Wu HM, Zhang M, Lin JM. Expression of Annexina5 in breast cancer[J]. Guangdong Yi Xue, 2013, 34(7): 1097–9. DOI:10.3969/j.issn.1001-9448.2013.07.042 ] |
| [13] | 龙军先, 高丕尧, 高枫, 等. 膜联蛋白A5在不同临床分期结肠癌患者中的表达及意义[J]. 广东医学, 2014, 35(13): 2013–5. [ Long JX, Gao PY, Gao F, et al. The expression and clinical significance of annexin A5 in colon cancer patients in different clinical stages[J]. Guangdong Yi Xue, 2014, 35(13): 2013–5. DOI:10.3969/j.issn.1001-9448.2014.13.013 ] |
| [14] | Bortner JD Jr, Das A, Umstead TM, et al. Down-regulation of 14-3-3 isoforms and annexin A5 proteins in lung adenocarcinoma induced by the tobacco-specific nitrosamine NNK in the A/J mouse revealed by proteomic analysis[J]. J Proteome Res, 2009, 8(8): 4050–61. DOI:10.1021/pr900406g |
| [15] | Sun X, Wet B, Liu S, et al. Anxa5 mediates the in vitro malignant behaviours of murine hepatocareinoma Hca-F cells with high lymph node metastasis potential preferentially via ERK2/p-ERK2/c-Jun/p-c-Jun(Ser73) and E-cadherin[J]. Biomed Pharmacother, 2016, 84: 645–54. DOI:10.1016/j.biopha.2016.09.086 |
| [16] | Shin DW, Kwon YJ, Ye DJ, et al. Auranofin suppresses plasminogen activator inhibitor-2 expression through annexin A5 induction in human prostate cancer cells[J]. Biomol Ther(Seoul), 2017, 25(2): 177–85. DOI:10.4062/biomolther.2016.223 |
| [17] | Wehder L, Arndt S, Murzik U. Annexin A5 is involved in migration and invasion of oral carcinoma[J]. Cell Cycle, 2009, 8(10): 1552–8. DOI:10.4161/cc.8.10.8404 |
| [18] | Motokura T, Bloom T, Kim HG, et al. A novel cyclin encoded by a bcl1-linked candidate oncogene[J]. Nature, 1991, 350(6318): 512–5. DOI:10.1038/350512a0 |
| [19] | Herce HD, Rajan M, Lättig-Tünnemann G, et al. A novel cell permeable DNA replication and repair marker[J]. Nucleus, 2014, 5(6): 590–600. DOI:10.4161/nucl.36290 |
| [20] | 石静, 梁永刚. 穿心莲内脂对人皮肤基底细胞癌A431细胞生长、凋亡及增殖细胞核抗原蛋白表达的影响[J]. 解剖学报, 2013, 44(1): 73–8. [ Shi J, Liang YG. Effect of andrographolide on cell growth, apoptosis and expression of proliferating cell nuclear antigen protein in the human skin carcinoma A431 cell line[J]. Jie Pou Xue Bao, 2013, 44(1): 73–8. DOI:10.3969/j.issn.0529-1356.2013.01.014 ] |
| [21] | Hong M, Park N, Chun YJ. Role of annexin a5 on mitochondria-dependent apoptosis induced by tetramethoxystilbene in human breast cancer cells[J]. Biomol Ther(Seoul), 2014, 22(6): 519–24. DOI:10.4062/biomolther.2014.112 |
 2018, Vol. 45
2018, Vol. 45


