文章信息
- 光学分子影像学在肿瘤外科应用的前景
- Comment on Prospect of Optical Molecular Imaging in Oncological Surgery
- 肿瘤防治研究, 2018, 45(6): 357-361
- Cancer Research on Prevention and Treatment, 2018, 45(6): 357-361
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0364
- 收稿日期: 2018-03-19
- 修回日期: 2018-04-20
临床实践表明,经尿道膀胱肿瘤电切术后,膀胱肿瘤还会多次复发,而近期复发的主要因素是术中没有将肿瘤彻底切除,传统经尿道电切镜采用白光照明很难识别微小肿瘤和术中残余肿瘤[1-2]。2005年我们开始探索将光学分子影像学理论和技术应用于膀胱镜诊疗的可能性,提出了“光学分子影像内窥镜”的理论和技术。2009年成功研制了多光谱小动物活体光学分子成像仪,成功实现了在体光学分子成像以及在体生物大分子的科学研究。2014年编写的《光学分子影像外科学》专著被三峡出版社免费资助出版。该书概述了肿瘤外科在手术切缘处理和肿瘤淋巴结清扫术中遇到的科学问题和临床难点,介绍了外科手术中图像引导技术发展的现状,阐述了光学成像引导外科手术的基本理论和成像机制,系统介绍了光学成像技术和设备的国内外前沿动态,及其在开放手术和内窥镜手术术中导航等实际临床操作要点,指出未来光学分子影像外科学发展的方向、研究策略和需要解决的关键科学问题。
2012—2016年在国家自然科学基金委和科学部项目的资助下,获得了国人膀胱肿瘤导向肽-NYZL1多肽序列及其光学分子探针,对光学分子探针的结构、性能、研究现状和应用前景有了更加深入的了解,期间完成了“多光谱分光融合外科手术引导系统”设备质量标准的制定、安全性检测、临床验证和注册,对荧光导航外科、分子影像导航外科和靶向外科新理论、新技术进行了多学科、多领域的研究。本文就将光学分子影像外科学的现状、研究内容、需要解决的科学和技术问题、临床应用前景及其挑战提出一些个人意见和看法,为从事光学分子影像外科学研究人员提供参考,期望我国在分子影像设备、靶向分子探针和临床诊疗技术等方面有新的突破,以造福肿瘤患者。
1 荧光染料与荧光诊断最早的荧光诊断技术是自体荧光成像技术,与现代新的成像技术相比,敏感度较低,成像技术并不能成为医生的常规检查手段。
由于自体荧光十分微弱,增加肿瘤细胞内荧光物质的聚集,将会增强肿瘤的荧光强度,国内外已报道应用于外科领域的荧光染料包括四环素、金丝桃素、血卟啉衍生物、5-氨基酮戊酸(5-aminolevulinic acid, 5-ALA)及其酯类衍生物氨基酮戊酸己酯(hexaminolevulinate, HAL)等,其中5-ALA是目前临床应用最为广泛的外源性荧光染料[3-4]。
5-ALA荧光成像的峰值吸收波长是450 nm,峰值荧光波长是635 nm,根据生物医学光子学原理,700~900 nm的近红外光(near-infrared, NIR)具有“组织光窗”效应,与可见光或635 nm荧光相比,700~900 nm的近红外光具有以下优点:(1)生物组织对此波段近红外光的吸收和散射效应最小,与可见光相比,近红外光可穿透更深层的组织;(2)生物组织对此波段近红外光的自体荧光较小,信背比相对较高等,这是临床医学在体实时近红外荧光成像的理论基础,吲哚青绿(indocyanine green, ICG)是目前应用最为广泛的近红外荧光染料。最新研究发现,近红外Ⅱ区荧光染料(波长1 000~1 700 nm)与吲哚菁绿等传统的荧光染料相比,活体组织对近红外Ⅱ区荧光染料的吸收和散射效应更加显著降低,在活体水平可以实现更深、更清晰和更快的荧光成像,是原位、实时、动态活体成像的又一新的研究手段,但目前尚无临床使用的近红外Ⅱ区荧光染料[5]。
ICG是一种三碳箐染料,相对分子质量774.96,分子式C43H47N2O6S2Na。其特性包括:(1)血液中峰值吸收波长805 nm,峰值荧光波长835 nm,均在近红外光范围内;(2)血液中,ICG与血浆蛋白结合率高达98%,主要与高密度和低密度脂蛋白相结合,形成较大体积的ICG-血浆蛋白复合体,使ICG极少从毛细血管中漏出;(3)ICG分子为三维立体结构,两个多环结构具有亲脂性,而其硫酸盐基团具有亲水性,因此,ICG具有亲脂和亲水的双重特性;(4)ICG的血浆清除有两个高峰,第1个高峰在其注射后的3~4 min,第2个高峰在1 h后;(5)ICG由肝实质细胞从血浆中摄取后,以整分子形式经胆囊胆汁排泄,不再经过肠肝循环,短时间内允许重复使用;(6)ICG的荧光效率仅为荧光素的4%,成像效果有待提高[6]。进一步研究还发现,ICG荧光波形与ICG的化学环境、物理条件、温度、浓度、pH值以及荧光成像设备的技术性能密切相关[7]。
总之,ICG和吲哚青绿血管造影(indocyanine green angiography, ICGA)具有下列性能:(1)患者应用安全,但ICG注射溶液中含有碘化钠,有发生过敏的可能;(2)是理想的血管造影剂,ICG与血脂蛋白有效结合,不会从循环中泄露;(3)血液循环中半衰期短,允许重复使用,ICG在水溶液中或者暴露光时间超过10 h致结构不稳定;(4)信噪比好,组织自体荧光低;(5)ICG的荧光量子效率与浓度成非线性关系;(6)能够组织深部成像,属于组织光窗的光谱;(7)ICG和ICGA在外科领域的应用将成为生物医学工程一个新的研究领域。但ICG最大的缺点是体内清除率很快(血浆半衰期2~4 min),体内不稳定,体外不能与抗体、多肽等构成共轭分子,制备ICG分子探针非常困难。国内外正在寻找一种可以替代ICG,还能够与靶向载体构建光学分子探针、无毒、敏感、量子效率高的近红外荧光染料[8]。
2 荧光成像和光学分子影像荧光是一种光致发光的冷发光现象。某种物质,在常温下经某种波长的入射光照射,吸收光能后进入激发态,立即退激发时发出比入射光波长更长的出射光;而且一旦停止入射光,发光现象也随之立即消失,具有这种性质的出射光被称为荧光。单纯荧光染料在一定的条件下发出荧光,但只有当荧光材料与特异性靶向载体相结合,活体靶向标记靶向目标,进一步荧光成像激发出的荧光才被称为“光学分子影像”。
2010年,美国Frangioni团队研制了具有荧光成像功能的腹腔镜手术导航系统,用于术中实时观察胆管、输尿管[9];2011年van Dam等[10]首先使用异硫氰酸荧光素标记叶酸-α受体抗体构建的分子探针和光学分子影像腹腔镜,进行了卵巢癌腹膜转移瘤诊疗一体化的Ⅰ期临床试验。这是人类第一次将光学分子影像技术应用到外科手术中,使肿瘤在体诊疗达到了分子水平。2013年Glatz等研发了腹腔镜光学分子影像系统,开展了小鼠结直肠癌离体手术的实验[11];2014年韩国科学家研发了腹腔镜分子影像手术导航系统用于结直肠癌在体手术的试验。2015年de Boer等[12]在“Optical innovations in surgery”一文中报道,美国FDA正在进行针对乳腺癌、结肠癌和头颈部肿瘤等多种肿瘤新型光学分子靶向显影剂的Ⅰ期临床研究,预期3~5年临床应用,将极大提高肿瘤外科手术的精准度。
特别是近年来,随着“荧光引导外科(fluorescence-guided surgery)”、“分子引导外科(molecularly guided surgery)”、“靶向外科(targeted surgery)”等外科学新概念的提出[13-14],光学分子影像外科学将成为精准外科的前沿理论和先进诊疗技术[15-16]。
3 光学分子影像和光学分子影像诊疗设备光学分子影像学技术早期主要用于活体体内生物大分子的研究,直到2008年诺贝尔化学奖获得者钱永健教授报告了活体荧光成像引导切除荧光标记小鼠肿瘤组织的实验手术,才开启了光学分子影像学技术在手术领域应用的先河。光学分子影像的核心是具有靶向性的光学分子显影剂和成像效果良好的光学分子影像成像设备。
目前非靶向性荧光显影剂包括ICG、荧光素钠、亚甲基蓝和丫啶黄素,仅有ICG、荧光素钠、亚甲基蓝被美国FDA批准临床应用。而靶向光学分子显影剂需要靶向性良好的靶向载体,靶向类载体,主要包括:(1)氨基酸和肽类,如5-氨基酮戊酸及其酯类、cRGD、叶酸、循环RPMC、NP41、BMB、GE3082,其中仅5-氨基酮戊酸及其酯类能够临床应用,其他尚处于临床前期研究,NP41、BMB、GE3082主要是用于神经纤维的荧光成像;(2)合成大分子类,主要有锝-99m脂质体、ACPP、ProSense MMPSense GB119和BMV083等5种,除锝-99m脂质体外,其他4种大分子还没有临床应用,锝-99m脂质体靶向淋巴结,ACPP、ProSense MMPSense GB119和BMV083靶向肿瘤微环境和动脉粥样硬化斑块中的蛋白酶;(3)抗体类,目前共有5种抗体能够与表达CA19-9、CA19-9、CEA、EPCAM、PSMA和EGFR的肿瘤抗原特异性靶向结合[17]。此外,靶向多肽载体的研究发展也十分迅速。
早在2002年,美国波士顿Beth Israel Deaconess医学中心首先介绍了第一代外科手术荧光成像系统,当时主要用于外科手术的动物研究,近年来逐渐进入临床。目前美国波士顿Frangioni实验室、日本滨松光电、法国Fluoptics公司、加拿大和荷兰等研究机构正在从事相关研发。美国FDA批准临床应用的荧光成像系统主要是加拿大生产的SPY,同时我国研究的多光谱分光融合外科手术引导系统也开始临床应用。
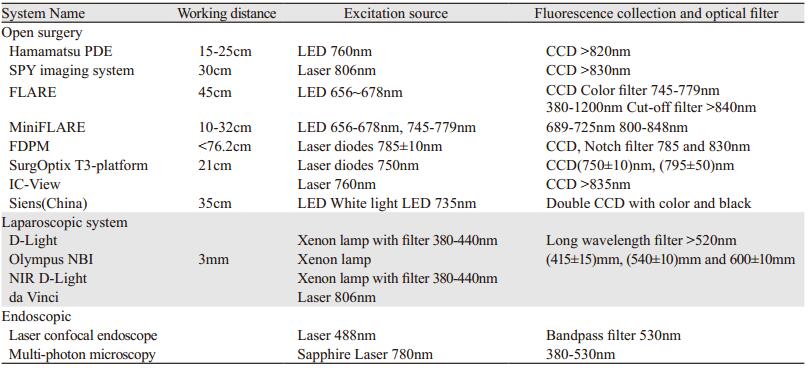
表 1中列出了14种成像设备,分为开放手术系统、腹腔镜系统和显微成像系统三大类,虽然硬件和软件配置上有一定差异,但工作原理基本一致[18]。
肿瘤外科由开放手术发展为微创腹腔镜手术,使手术的切口缩小、创伤减轻、患者康复快,但肿瘤切缘的阳性率没有显著降低,反而有所升高,如根治性前列腺切除术后肿瘤阳性切缘率高达10%~38%。其中主要原因是术中难以鉴别肿瘤边缘或识别微小肿瘤,成为临床亟待解决的重大科学和技术问题。
比如,荧光影像引导的外科手术主要包括多种肿瘤前哨淋巴结示踪、部分肿瘤边缘识别、血管和重要结构完整性的诊断。当皮下注射ICG 1.6 ml 500 μmol/L时,前哨淋巴结的成像效果比较理想。静脉注射ICG同时进行肝脏荧光成像可以发现术中超声难以发现的浅表及微小肝肿瘤。Satou等研究发现,ICG荧光成像还能进行肝癌肝外转移瘤的诊断。术前CT、术中超声以及术中触摸都没有发现结肠癌肝转移灶,ICG荧光成像能够准确定位诊断,肿瘤深度一般小于8 mm[19]。另外,近红外荧光成像在神经外科应用十分迅猛,ICG荧光成像已经成功用于高级别胶质瘤、脑膜瘤、血管母细胞瘤和垂体瘤术中肿瘤切缘的识别。
荧光成像还能用于重要结构完整性的诊断,如胆道术中损伤、输尿管损伤和术中输尿管的探测等。另外皮下注射ICG还能实时观察淋巴液的流动,进行淋巴水肿机制的研究。在乳腺重建手术中,荧光血管造影有助于皮瓣的血管识别和选择,Yamaguchi等[20]研究认为根据荧光血管造影进行手术规划,能够保证皮瓣100%的成活率,说明荧光引导外科手术对于提高手术治疗效果具有重要意义。
近年来,有多种肿瘤特异性抗体批准临床应用,贝伐单抗是血管内皮生长因子A的抗体,西妥昔单是表皮生长因子受体的抗体,曲妥珠单抗是抗人表皮生长因子受体2的抗体。美国FDA已经批准这些抗体与近红外荧光团结合进行下一代NIR荧光显影剂的研究,贝伐单抗与IRDye 800CW构建的靶向荧光显影剂已经开始临床研究。多肽介导的核素和荧光成像已经取得成功,如环状精氨酸-甘氨酸-天冬氨酸(cRGD)多肽能够靶向整合素αVβ3,cRGD-ZW800-1靶向显影剂正在进行临床前期研究。总之,随着多种新型光学分子靶向显影剂和术中光学分子成像设备的不断进步和临床研究[12],预期将实现在分子水平精准识别术中残余肿瘤,将极大提高肿瘤外科手术的精准度。光学分子影像外科学必将成为继开放手术、微创外科之后第三代外科手术方式,必将成为未来精准外科诊疗一体化的前沿技术。
但FDA和欧盟药物管理局的临床实验研究委员会认为,这些诊疗技术在批准临床应用前还需要进行更加标准化的实验室研究、制定规范的生产条件和正规的临床研究。
4.2 光学分子影像外科学临床实践的基本要素可见光和窄谱内窥镜光学成像技术已经在医学诊断和外科手术中广泛应用,但光学分子影像与光学成像有着本质的区别,光学分子影像是将荧光成像技术和靶向光学分子显影剂有机结合进行特定靶细胞、靶组织的荧光成像。将光学分子影像学理论和技术应用到外科学领域,将使彻底改变外科医生识别血管、淋巴管和肿瘤组织的视觉方式,识别精准度达到分子水平,使外科手术的治疗效果发生质的飞跃,从而形成光学分子影像外科学新的学科。光学分子影像外科学将由光学分子成像医疗设备、靶向光学分子显影剂及其诊疗技术构成。荧光成像或光学分子成像外科手术设备主要由荧光激发光源、荧光发射光采集成像装置、图像处理软件等构成,见表 1。目前全世界不同厂家生产的荧光成像设备技术性能有很大差别,没有形成规范的国际标准。虽然荧光成像设备与CT、MRI等相比在技术上较容易生产,但呈现良好的荧光图像或分子影像并不容易,所以制定规范的行业、国家和国际标准是非常有必要的。国内有几家企业正在进行研发和生产,其中太原赛恩思生产的多光谱荧光成像仪获医疗器械注册许可(晋械注准20162220025),技术性能达到国际先进水平,而且敏感度显著提高。
类似腹腔镜的荧光成像系统主要是加拿大的Novadaq, s Firefly®,该设备主要进行ICG的荧光成像,性价比不相称,应用受到一定局限性。
具有国药准字号的非靶向近红外荧光染料主要是注射用ICG,国内仅有2家企业生产。目前ICG主要用于眼科的眼底血管造影,术中荧光成像的临床应用尚属初期,使用剂量、注射方法和临床成像的诊疗标准还有待进一步研究。
乳腺癌前哨淋巴结活检术中,ICG从注射后到腋窝淋巴结显影的时间是1~10 min,有研究认为ICG的识别率是100%,亚甲蓝是93%。但有几种因素影响ICG前哨淋巴结的近红外荧光成像,其一是ICG的使用剂量,一般是0.01~6.4 mmol/L。Sevick-Muraca等[21]认为ICG的最低用量是0.01 mmol/L,Mieog等认为前哨淋巴结显像最亮时的浓度是0.4~0.8 mmol/L ICG(注射1.6 ml)[22];其次是ICG还可以越过前哨淋巴结到达第二列淋巴结,或者直接扩散到皮下组织中[23]。为避免这种现象的发生,在注射ICG后要迅速成像,此外,近红外荧光的穿透深度、身体质量指数都影响成像效果。
皮肤癌前哨淋巴结示踪的临床研究中发现,42例皮肤癌患者成功进行了前哨淋巴结示踪,识别率达93%~100%,皮内注射ICG后立刻皮下淋巴管显像,15 min后前哨淋巴结显影,可视化持续时间大约3 h[24]。
ICG排泄进入胆道,在胆囊切除时能够实时近红外荧光胆管成像。这种技术将能进行胆道系统成像,有效提示外科医生避免损伤胆管。Abdalla等认为如果胆管肿瘤浸润或血栓堵塞将会引起胆汁淤积,从而使肝脏表面局限性ICG荧光信号增强,这种荧光信号特征将有助于评估胆管肿瘤的浸润程度[25]。
在肝肿瘤切除术中,静脉注射ICG,由于正常肝实质内ICG排泄完毕,而肿瘤组织内或肿瘤边缘仍有ICG滞留,荧光成像有助于肝肿瘤边缘的识别,最好的观察时间窗是注射ICG 24 h之后。
在结直肠癌肝脏转移瘤切除的标本中发现,98.1%~100%的肿瘤病灶能够采用近红外荧光成像识别,ICG荧光在肝胆外科手术中具有一定的使用价值[26]。
目前研究认为,IRDye 800CW近红外荧光染料的成像效果优于ICG,这些染料还可以和白蛋白或纳米粒子共轭延长淋巴结的停留时间。IRDye 800CW还能与多种抗体、多肽等靶向载体构成肿瘤靶向特异的光学分子显影剂,这些显影剂的临床应用,将会使现代微创外科发生巨大变化,光学分子影像引导的靶向外科新时代即将来临。
| [1] | 杨晓峰, 申鹏飞, 亢全寅, 等. 复发性膀胱移行细胞癌10年随访结果分析[J]. 中华泌尿外科杂志, 1998, 19(9): 530–33. [ Yang XF, Shen PF, Kang QY, et al. Ten year follow-up of recurrent bladder cancer[J]. Zhonghua Mi Niao Wai Ke Za Zhi, 1998, 19(9): 530–33. ] |
| [2] | Heney NM, Ahmed S, Flanagan MT, et al. Superficial bladder cancer: Progression and recurrence[J]. J Urol, 1983, 130(6): 1083–6. DOI:10.1016/S0022-5347(17)51695-X |
| [3] | 杨晓峰. 术中荧光引导技术在泌尿外科应用的现状[J]. 世界复合医学, 2015, 1(1): 79–84. [ Yang XF. Intraoperative fluorescenceguidance in urology[J]. Shi Jie Fu He Yi Xue, 2015, 1(1): 79–84. ] |
| [4] | Nguyen QT, Tsien RY. Fluorescence-guided surgery with live molecular navigation-a new cutting edge[J]. Nat Rev Cancer, 2013, 13(9): 653–62. DOI:10.1038/nrc3566 |
| [5] | De Boer E, Harlaar NJ, Taruttis A, et al. Optical innovations in surgery[J]. Br J Surg, 2015, 102(2): e56–72. DOI:10.1002/bjs.9713 |
| [6] | Alander JT, Kaartinen I, Laakso A, et al. A review of indocyanine green fluorescent imaging in surgery[J]. Int J Biomed Imaging, 2012, 2012: 940585. |
| [7] | 杨晓峰, 武未, 王国安. 可见光和近红外荧光分光融合成像外科手术导航系统的研制[J]. 生物医学工程学杂志, 2015, 32(2): 455–9. [ Yang XF, Wu W, Wang GA. Development of a surgical navigation system with beam split and fusion of the visble and near infrared fluorescence[J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 2015, 32(2): 455–9. DOI:10.7507/1001-5515.20150082 ] |
| [8] | Vahrmeijer AL, Hutteman M, van der Vorst JR, et al. Image-guided cancer surgery using near-infrared fluorescence[J]. Nat Rev Clin Oncol, 2013, 10(9): 507–18. DOI:10.1038/nrclinonc.2013.123 |
| [9] | Ashitate Y, Stockdale A, Choi HS, et al. Real-time simultaneous near-infrared fluorescence imaging of bile duct and arterial anatomy[J]. J Surg Res, 2012, 176(1): 7–13. DOI:10.1016/j.jss.2011.06.027 |
| [10] | van Dam GM, Themelis G, Crane LM, et al. Intraoperative tumor-specific fluorescence imaging in ovarian cancer by folate receptor-α targeting: first in-human results[J]. Nat Med, 2011, 17(10): 1315–9. DOI:10.1038/nm.2472 |
| [11] | Glatz J, Varga J, Garcia-Allende PB, et al. Concurrent video-rate color and near-infrared fluorescence laparoscopy[J]. J Biomed Opt, 2013, 18(10): 101302. DOI:10.1117/1.JBO.18.10.101302 |
| [12] | de Boer E, Harlaar NJ, Taruttis A, et al. Optical innovations in surgery[J]. Br J Surg, 2015, 102(2): e56–72. DOI:10.1002/bjs.9713 |
| [13] | Sonn GA, Behesnilian AS, Jiang ZK, et al. Fluorescent Image-Guided Surgery with an Anti-Prostate Stem Cell Antigen (PSCA) Diabody Enables Targeted Resection of Mouse Prostate Cancer Xenografts in Real-Time[J]. Clin Cancer Res, 2016, 22(6): 1403–12. DOI:10.1158/1078-0432.CCR-15-0503 |
| [14] | Volpi D, Tullis IDC, Barber PR, et al. Electrically tunable fluidic lens imaging system for laparoscopic fluorescence-guided surgery[J]. Biomed Opt Express, 2017, 8(7): 3232–47. DOI:10.1364/BOE.8.003232 |
| [15] | Vahrmeijer AL, Hutteman M, van der Vorst JR, et al. Image-guided cancer surgery using near-infrared fluorescence[J]. Nat Rev Clin Oncol, 2013, 10(9): 507–18. DOI:10.1038/nrclinonc.2013.123 |
| [16] | Narasaki H, Noji T, Wada H, et al. Intraoperative real-time assessment of liver function with near-infrared fluorescence imaging[J]. Eur Surg Res, 2017, 58(5-6): 235–45. DOI:10.1159/000477347 |
| [17] | Kato K. A novel screening method to establish tumor-targeting antibodies reliable for drug delivery system[J]. Yakugaku Zasshi, 2013, 133(9): 931–8. DOI:10.1248/yakushi.13-00190-2 |
| [18] | Zhu B, Sevick-Muraca EM. A review of performance of near-infrared fluorescence imaging devices used in clinical studies[J]. Br J Radiol, 2015, 88(1045): 20140547. DOI:10.1259/bjr.20140547 |
| [19] | Satou S, Ishizawa T, Masuda K, et al. Indocyanine green fluorescent imaging for detecting extrahepatic metastasis of hepatocellular carcinoma[J]. J Gastroenterol, 2013, 48(10): 1136–43. DOI:10.1007/s00535-012-0709-6 |
| [20] | Yamaguchi S, De Lorenzi F, Petit JY, et al. The "perfusion map" of the unipedicled TRAM flap to reduce postoperative partial necrosis[J]. Ann Plast Surg, 2004, 53(3): 205–9. DOI:10.1097/01.sap.0000116284.51679.ea |
| [21] | Sevick-Muraca EM. Translation of near-infrared fluorescence imaging technologies: emerging clinical applications[J]. Annu Rev Med, 2012, 63: 217–31. DOI:10.1146/annurev-med-070910-083323 |
| [22] | Mieog JS, Troyan SL, Huttemen M, et al. Toward optimization of imaging system and lymphatic tracer for near-infrared fluorescent sentinel lymph node mapping in breast cancer[J]. Ann Surg Oncol, 2011, 18(9): 2483–9. DOI:10.1245/s10434-011-1566-x |
| [23] | Choi HS, Gibbs SL, Lee JH, et al. Targeted zwitterionic near -infrared fluorophores for improved optical imaging[J]. Nat Biotechnol, 2013, 31(2): 148–53. DOI:10.1038/nbt.2468 |
| [24] | Clary BM, Brady MS, Lewis JJ, et al. Sentinel lymph node biopsy in the management of patients with primary cutaneous melanoma: Review of a large single-institutional experience with an emphasis on recurrence[J]. Ann Surg, 2001, 233(2): 250–8. DOI:10.1097/00000658-200102000-00015 |
| [25] | Abdalla EK, Vauthey JN, Ellis LM, et al. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases[J]. Ann Surg, 2004, 239: 818–25. DOI:10.1097/01.sla.0000128305.90650.71 |
| [26] | Ishizawa T, Fukushima N, Shibahara J, et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging[J]. Cancer, 2009, 115(11): 2491–504. DOI:10.1002/cncr.v115:11 |
 2018, Vol. 45
2018, Vol. 45