文章信息
- 沉默MCM7基因介导AKT信号通路参与黑色素瘤细胞增殖及凋亡的实验
- MCM7 Knockdown Inhibits Migration and Invasion While Induces Apoptosis of Cutaneous Malignant Melanoma Cells Through AKT Signaling Pathway
- 肿瘤防治研究, 2018, 45(10): 739-745
- Cancer Research on Prevention and Treatment, 2018, 45(10): 739-745
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0318
- 收稿日期: 2018-03-09
- 修回日期: 2018-07-13
2. 550002 贵阳,贵州省人民医院整形外科
2. Department of Orthopedic Surgery, Guizhou Provincial People's Hospital, Guiyang 550002, China
黑色素瘤是一种高发病率、高死亡率的皮肤癌,可在早期应用手术治疗的方式控制疾病的发展,然而在晚期的疾病中,传统形式的治疗效果并不理想[1]。近年来的研究表明,转移性皮肤黑色素瘤(cutaneous melanoma, CM)的平均存活期仍不超过10月。最近,虽然针对CM的一些靶向治疗和免疫疗法在抗肿瘤领域中发挥着重要作用,延长了CM患者存活期[2-3],但寻求新的CM靶向治疗仍至关重要。
微染色体维持蛋白7(Minichromosome maintenance protein 7, MCM7)是MCM2-7复合体的亚基,是DNA复合物的重要组成成分,并且在真核生物DNA复制开始时起关键作用。MCM7在正常组织中无表达或低表达,但是包括肝癌在内的多种恶性肿瘤中高表达[4]。MCM7的表达水平与肿瘤的发生发展息息相关,例如鳞状细胞癌、前列腺癌等[5]。MCM7在成神经细胞瘤、宫颈癌和下咽癌等多种肿瘤中表达上调,而在上皮祖细胞中过度表达的MCM7有助于肿瘤的形成和转移[6]。
此外,CM的病因仍然存在争议,尤其是紫外线辐射(ultraviolet radiation, UVR)是CM的主要环境风险[7]。当蛋白激酶B,又称AKT被UVR激活时,诱导细胞周期转变,同时减少细胞凋亡,增加细胞增殖能力,从而导致晚期皮肤癌变[8]。本研究通过沉默MCM7基因及抑制AKT信号通路探究其是如何影响CM的发生,进一步为CM患者提供了一种潜在的治疗方法。
1 材料与方法 1.1 RNAi表达载体构建选择由上海吉凯基因公司构建提供的同时带有绿色荧光标记蛋白和嘌呤霉素抗性筛选标记的MCM7基因沉默重组慢病毒颗粒LV-shRNA-MCM7及对照慢病毒颗粒LV-shRNA-NC,LV-shRNA-MCM7干扰序列为:5'-GGACTCAA-TTTGTGGAAT-3',NC(negative control)干扰序列为:5'-TTCTCCGA-ACGTGTCACGT-3',分别作为实验组(siRNA转染组)和阴性对照组(siRNA NC转染组)转染基因。其中shRNA靶点已在前期试验中验证,该病毒转染效率 > 95%。
1.2 细胞培养及分组转染将购自美国ATCC公司的人皮肤黑色素瘤细胞株A375用含10%胎牛血清、100 u/ml青霉素和100 μg/ml链霉素的Dulbecco's Modified Eagle Medium(DMEM)培养液培养,置于37℃、95%O2、5%CO2的恒温培养箱中。细胞贴壁生长后,传代使用0.25%的胰蛋白酶消化,取对数生长期细胞,细胞计数按照每孔含1×105个A375黑色素瘤细胞接种至6孔板中,每孔含2 ml DMEM完全培养基。将A375黑色素瘤细胞分为四组:Control组(不进行任何处理)、Empty vector转染组(空载质粒转染组)、siRNA(LV-shRNA-MCM7)转染组、siRNA NC(LV-shRNA-MCM7 negative control)转染组。转染过程按照吉凯公司(上海)提供的慢病毒MCM7转染说明书进行。转染采用脂质体法,参照Lipofectamine 2000说明书中转染步骤。
转染后第二天加入嘌呤霉素(吉凯公司,上海)筛选,每隔24 h更换一次含嘌呤霉素的培养基(浓度约2 μg/ml),每隔两天传代一次,药筛式筛选传代4代后收集稳定转染细胞。
1.3 MTT法绘制生长曲线当细胞密度达到30%~50%,于DMEM完全培养基继续培养24 h进行同步化处理。调整细胞悬液浓度为1×105个每毫升,96孔板中每孔接种细胞悬液100 μl,按实验分组分别进行转染处理,每组设3个复孔,同时设空白对照组(仅加培养基),待细胞生长至70%融合后,每孔加入5 mg/ml MTT液(ST316,中国碧云天生物技术研究所)10 μl,置于37℃培养箱孵育4 h,弃上清液,PBS清洗1次,每孔加入DMSO(D5879,美国Sigma公司)100 μl,摇床振荡10 min,各组细胞分别接种培养24、48、72 h后在酶标仪492 nm处检测吸光度OD值。细胞活性=(OD实验孔-OD空白孔)/OD空白孔。实验重复3次,取平均值。
1.4 流式细胞仪检测细胞凋亡率分组及转染处理同前,转染后第二天以0.25%胰酶消化细胞,用含10%胎牛血清的DMEM完全培养基终止消化,1 000 r/min离心机离心5 min,弃上清液。4℃预冷的70%乙醇固定,调整细胞浓度为1×106个每毫升,加入Annexin V-FITC/PI(556547,上海硕嘉生物技术有限公司)染色10 ml,置于4℃冰箱中染色15~30 min,置流式细胞仪(XL型,Conlter公司,美国)上检测。激发波长为480 nm,530 nm检测FITC和大于575 nm检测PI。左上、左下两个象限表示正常细胞,右上、右下两个象限分别表示早期凋亡细胞和晚期凋亡细胞,细胞凋亡率以凋亡细胞所占细胞总数的百分比表示。
取对数生长期的四组转染细胞,0.25%胰蛋白酶消化,调整细胞密度为3×105个每毫升,接种于6孔板中,培养48 h。PBS清洗2次,取单细胞悬液,1 000 r/min离心5 min后弃上清液。加入70%的冰乙醇溶液-20℃固定1 h,1 000 r/min离心5 min后弃上清液。加入200 μl预冷的PBS洗涤2次。加入20 μl的RNA酶,37℃反应30 min。再加入400 μl的PI染液(C0080,Solarbio),冰上避光孵育15 min。
1.5 划痕实验检测各组细胞的迁移能力细胞转染48 h后收集各组细胞,0.25%胰酶消化细胞,用PBS缓冲液洗涤2次,无细胞培养基重悬细胞,制成单细胞悬液。以6×105个每孔的细胞密度将细胞悬液接种于6孔板,待细胞汇合度达80%时,使用200 μl无菌枪头划痕。用PBS缓冲液洗去漂浮细胞。每孔加入DMEM培养基2 ml至培养板中,倒置显微镜下观察各组细胞0、48 h的划痕距离,并在倒置显微镜下摄像记录。
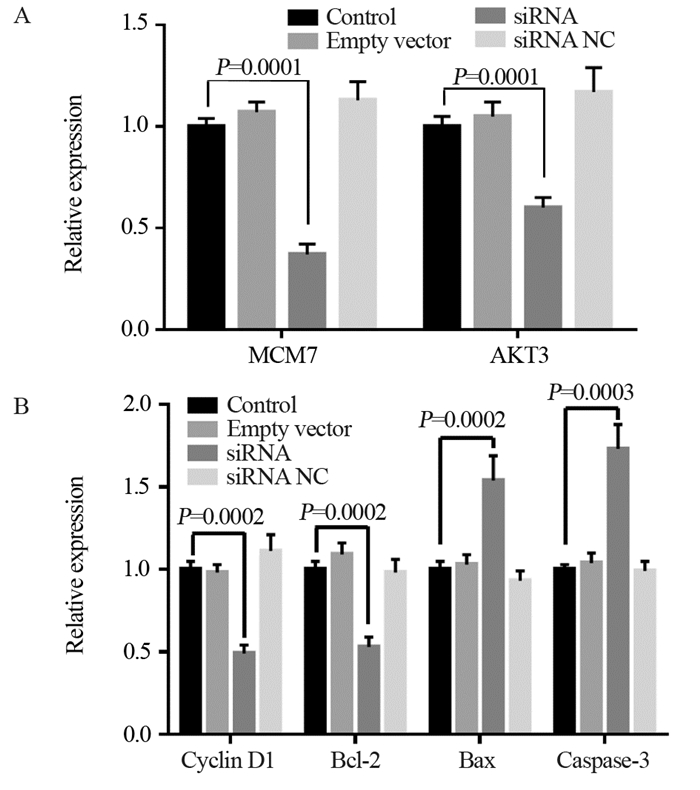
1.6 qRT-PCR检测各组细胞的表达水平分组及转染处理同1.2,转染后24 h利用TRIzol裂解液(Sigma公司,美国)提取各组细胞总RNA,分光光度法和琼脂糖凝胶电泳测定浓度、纯度及鉴定完整性。按照反转录试剂盒说明书(北京全式金公司)在PCR扩增仪上进行反转录反应,合成cDNA模版,设计MCM7、AKT3、Cyclin D1、Bcl-2、Bax、caspase-3和GAPDH的引物,见表 1,交由上海生工设计并合成。反转录实验体系20 μl,参照EasyScript First-Strand cDNA Synthesis SuperMix(目录号AE301-02,北京全式金公司)说明书进行。反应条件如下:cDNA合成50℃ 10 min,95℃ 10 min。取反应液进行实时荧光定量PCR,参照SYBR®Premix Ex TaqTM Ⅱ试剂盒(TaKaRa公司,大连)说明书进行荧光定量PCR操作,反应体系为20 μl:10 μl SYBR Premix、cDNA模板2 μl,上下游引物各0.6 μl及DEPC水6.8 μl。应用美国ABI公司的7500型荧光定量PCR进行实时荧光定量PCR(Real-time quantitative PCR, RT-PCR)实验。反应设定条件为:95℃预变性30 s,95℃变性30 s,退火20 s,72℃延伸30 s,40个循环,检测MCM7、AKT3、Cyclin D1、Bcl-2、Bax、caspase-3和GAPDH表达水平。2-ΔΔCt表示实验组与对照组目的基因表达的倍比关系,公式如下:ΔCt=CT目的基因-CT内参、ΔΔCt=ΔCt实验组-ΔCt对照组。Ct为反应的实时荧光强度达到设定的阈值时所经过的扩增循环数,此时扩增是呈对数期增长。计算细胞中MCM7、AKT3、Cyclin D1、Bcl-2、Bax、caspase-3和GADPH表达量。
溶解RIPA裂解液(P0013B,碧云天生物技术有限公司,上海)混合适量PMSF(苯甲基磺酰氟),使PMSF终浓度为1 mmol/L。450 g离心5 min,收集培养24 h后的A375细胞,PBS洗涤,重悬。再离心取上清液,按照1×107个每毫升(取一定量的细胞悬液稀释,将稀释的细胞液滴在计数板上,在显微镜下计算四个方格的细胞数目,浓度=4个大格的细胞总数/4×稀释倍数×104)的浓度加入裂解混合液,轻摇重悬后4℃冰浴5 min,12 000 r/min离心10 min,取上清液,即为细胞总蛋白。取20 μg细胞总蛋白用10%SDS-PAGE凝胶电泳分离蛋白质,随后湿法(恒压100 V,转膜时间60~70 min)转到PVDF膜,使用5%的脱脂奶粉封闭2.5 h,每5 min TBST洗膜一次,加一抗MCM7(Abcam公司,英国,ab2360,1:50,鼠抗)、AKT3(Abcam公司,英国,1:500,鼠抗)、p-AKT3(Abcam公司,英国,1:5000,兔抗)、cyclin D1(Abcam公司,英国,ab139260,1/1000,鼠抗)、Bcl-2(Abcam公司,英国,ab692,1:500,鼠抗)、Bax(Abcam公司,英国,ab77566,1/1000,鼠抗)、caspase-3(Abcam公司,英国,ab2171,1:100,兔抗)、β-actin(Abcam公司,英国,ab8226,1:500,鼠抗)。TBST洗膜3次,每次20 min,之后加入对应HRP(辣根过氧化物酶)标二抗IgG(Abcam公司,英国,ab6789,1:2000,羊抗鼠),IgG(Abcam公司,英国,ab6721,1:2000,羊抗兔)室温温育2 h,TBST洗涤3次,每次20 min;放入ECL发光液(ECL808-25,Biomiga公司,美国)显色,SmartView Pro 2000(UVCI-2100,Major Science公司,美国)拍照。利用Quantity One软件进行蛋白条带灰度分析。
1.8 统计学方法使用SPSS21.0软件包对数据进行分析并计算出平均值和标准差,所有实验均至少重复3次。组间数据分析使用T-test。多组数据分析采用One-way ANOVA。P < 0.05为差异有统计学意义。
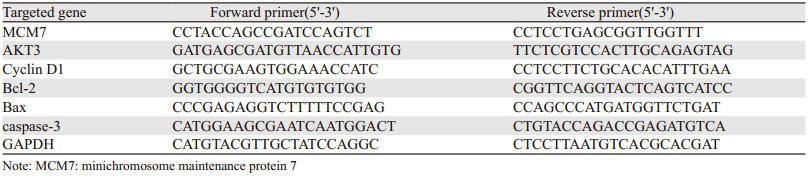
2 结果 2.1 细胞的增殖结果MTT增殖检测各组细胞吸光度值和生长曲线,结果见图 1,与Control组相比,siRNA转染后的细胞在24、48、72 h下的吸光度值均显著降低(P=0.0001),这表明siRNA转染后细胞的增殖受到抑制,而NC组和空载组无明显变化。
|
| NC: negative control; *: P < 0.0001, compared with control group 图 1 各组细胞MTT检测结果 Figure 1 MTT assay results of each group |
运用Annexin V-FITC/PI结合流式细胞仪检测各组A375细胞凋亡情况,见图 2。与Control组相比,Empty vector、siRNA NC两组细胞凋亡率差异无统计学意义(P > 0.05),经过siRNA转染处理后的A375细胞凋亡率显著上升(P=0.0001)。

|
| 图 2 流式细胞仪检测各组细胞凋亡的结果 Figure 2 Cell apoptosis of each group detected by flow cytometry |
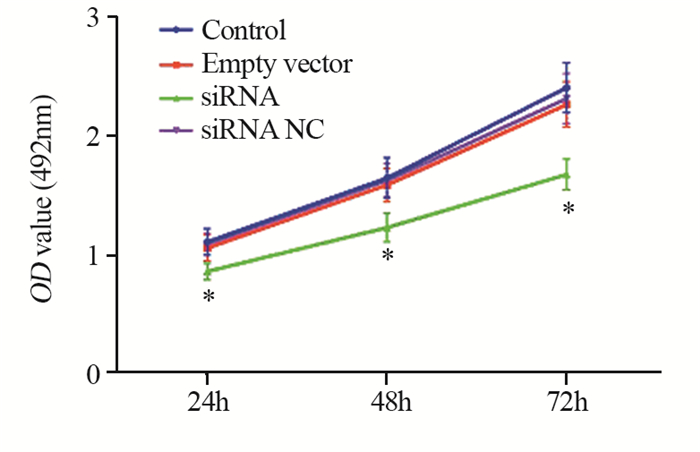
运用PI结合流式细胞仪检测各组A375细胞周期情况,见图 3。与Control组相比,Empty vector、siRNA NC两组G0/G1期、S期、G2期细胞数目差异无统计学意义(P > 0.05),经过siRNA转染处理G0/G1期细胞数目明显增多,S期细胞数目明显减少,提示沉默MCM7基因可能通过将A375黑色素瘤细胞阻滞在G1期而使细胞增殖减缓(P=0.0008)。
|
| 图 3 流式细胞仪检测各组细胞周期的结果 Figure 3 Cell cycle of each group detected by flow cytometry |
与Control组相比,siRNA组细胞在24 h划痕宽度较宽,划痕愈合区域面积较少,表明细胞的迁移能力明显降低(P < 0.05),Control组、Empty vector组、siRNA NC组细胞划痕宽度差异无统计学意义,见图 4。

|
| 图 4 划痕实验检测各组细胞迁移能力的结果 Figure 4 Cell migration of each group detected by scratch test |
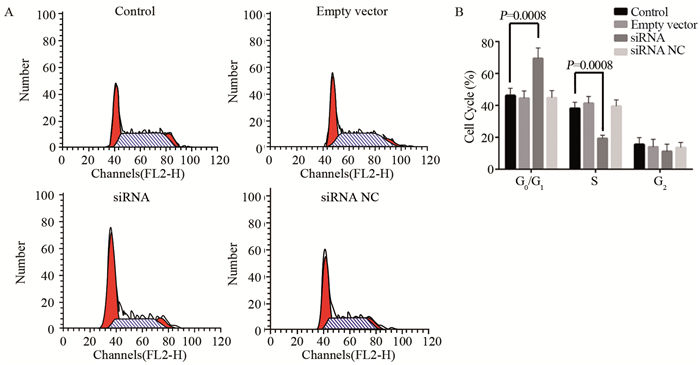
运用反转录结合定量PCR检测各组细胞中MCM7、AKT通路相关基因(AKT3)、Cyclin D1、细胞凋亡相关基因(Bcl-2、Bax、caspase-3)的mRNA相对表达量,2-ΔΔCt法定量分析结果见图 5。Control、Empty vector、siRNA NC三组间MCM7的表达差异无统计学意义(P > 0.05),MCM7在siRNA组的表达较Control组显著下调(P=0.0001)。与Control组相比,siRNA组AKT3、Cyclin D1的mRNA水平均有不同程度下调,Control、Empty vector、siRNA NC三组间差异无统计学意义(P > 0.05)。Bcl-2、Bax、caspase-3在Control、Empty vector、siRNA NC三组间的表达差异无统计学意义(P > 0.05),Bcl-2在siRNA组的表达较Control组显著下调(P=0.0002),Bax、caspase-3 mRNA在siRNA组的表达较Control组上调。
|
| 图 5 qRT-PCR检测各组细胞相关基因mRNA相对表达量的结果 Figure 5 mRNA levels of related genes in each group detected by qRT-PCR |
利用免疫印迹法检测各组A375细胞中MCM7、AKT信号通路相关蛋白(AKT3、p-AKT3)、Cyclin D1、细胞凋亡相关蛋白(Bcl-2、Bax、caspase-3)相对表达量见图 6。与Control组相比,MCM7蛋白水平在siRNA组中表达降低(P=0.0001),Control、Empty vector、siRNA NC三组间差异无统计学意义;与Control组相比,siRNA组中AKT3表达无明显差异,p-AKT3蛋白表达量也显著降低(P=0.0003),Control组、Empty vector组、siRNA NC三组差异无统计学意义,表明MCM7基因通过抑制AKT3蛋白磷酸化水平从而抑制AKT信号通道的激活。与Control组相比,siRNA组中Cyclin D1蛋白表达量下调(P=0.0001),而Control、Empty vector、siRNA NC三组间差异无统计学意义。与Control组相比,Bax、caspase-3在siRNA组中的表达显著上调(P < 0.05),Bcl-2在siRNA组的表达显著下调(P=0.0002),Control、Empty vector、siRNA NC三组间差异无统计学意义(P > 0.05)。
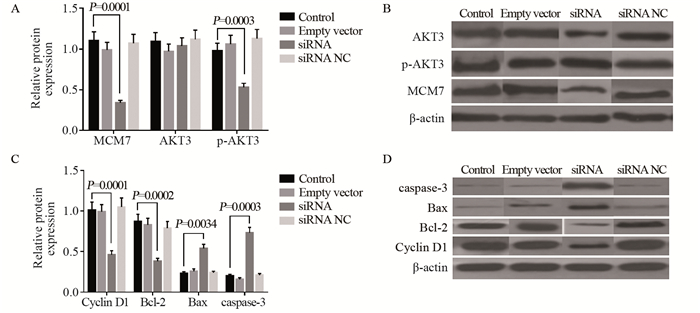
|
| 图 6 Western blot检测各组A375细胞基因蛋白相对表达量 Figure 6 p-AKT3, Cyclin D1, Bcl-2, Bax and caspase-3 proteins expressions of A375 cells in each group detected by Western blot |
微染色体维持(MCM)蛋白在DNA复制过程中起重要作用,并且是多种癌症的预后标志物[3]。大量的研究表明了MCM7对癌症的影响。MCM蛋白可以通过各种细胞功能及DNA合成和转录的调节来促进肿瘤发生[9]。MCM7有助于甲状腺肿瘤细胞增殖和侵袭[10]。在食管鳞状细胞癌中,MCM7与不良存活率呈正相关[5]。此外,MCM7可能是宫颈癌的生物标志物[11]。因此提示,MCM7是一种与肿瘤发生相关的基因,在食管鳞状细胞癌、宫颈癌和子宫内膜癌等多种肿瘤中,MCM7基因多为过表达[11-13]。在弥散性恶性淋巴瘤中,研究者也发现了MCM7的过度表达[14]。本研究的目的是证明沉默MCM7可以调节CM的发展,实验结果表明沉默MCM7可以抑制AKT3信号通路从而促进CM细胞的凋亡,抑制CM细胞的增殖和迁移。
AKT是一种丝氨酸/苏氨酸激酶,广泛分布于组织中,参与细胞代谢、增殖、存活和肿瘤生长[15]。有研究者通过研究MCM7在食管癌变过程中的扩增和过表达的作用和机制,发现MCM7不仅高表达,同时在使用两种siRNA和敲减MCM7后,显著抑制体外KYSE510和EC9706细胞的增殖、集落的形成和迁移情况。值得注意的是,研究者通过进一步的研究发现沉默MCM7抑制了KYSE510和EC9706细胞中AKT的磷酸化水平,并减少了细胞周期调控蛋白cyclin D1、cyclin E2和CDK2[16]。因此,MCM7是通过磷酸化AKT底物来激活下游信号转导途径的重要致癌基因。本研究结果也证明,通过减少AKT3的磷酸化,产生了MCM7沉默基因对AKT3信号转导途径失活的影响。先前的发现揭示,通过阻断AKT/mTOR信号转导途径能阻止CM细胞的侵袭和增殖[17],通过抑制AKT/mTOR途径促进癌细胞凋亡[18],PI3K/AKT/mTOR通路还能调节细胞自噬[19]。
总之,MCM7沉默基因是细胞增殖和迁移的有力抑制剂,同时也是CM细胞凋亡的诱导剂。这些活动与抑制AKT3信号转导途径有关。因此,本研究为CM患者提供了有前途的靶向治疗,而MCM7沉默基因的确切抗肿瘤活性还有待进一步讨论。
| [1] | 罗小美, 陈继冰, 牛立志. 靶向免疫治疗联合放射治疗在晚期黑色素瘤中的研究进展[J]. 中国肿瘤临床, 2015, 42(4): 255–8. [ Luo XM, Chen JB, Niu LZ. Research progress in targeted immunotherapy combined with radiotherapy for stage Ⅲ/Ⅳ melanomas[J]. Zhongguo Zhong Liu Lin Chuang, 2015, 42(4): 255–8. DOI:10.3969/j.issn.1000-8179.20141968 ] |
| [2] | 岳双磊, 周秋锋, 石光跃, 等. 黑色素瘤的靶向治疗[J]. 现代生物医学进展, 2016, 16(6): 1172–4, 1186. [ Yue SL, Zhou QF, Shi GY, et al. Targeted therapy for Melanoma[J]. Xian Dai Sheng Wu Yi Xue Jin Zhan, 2016, 16(6): 1172–4, 1186. ] |
| [3] | Jin H, Wan C, Zou Z, et al. Tumor Ablation and Therapeutic Immunity Induction by an Injectable Peptide Hydrogel[J]. Acs Nano, 2018, 12(4): 3295–310. DOI:10.1021/acsnano.7b08148 |
| [4] | Liu J, Tian L, Chen BA, et al. Biological effects of lentivirus-mediated silencing of minichromosome maintenance protein 7 with shRNA on the liver cancer MHCC-97H cells[J]. Int J Clin Exp Med, 2015, 8(6): 8433–41. |
| [5] | 胡月, 卢利, 姜菲菲, 等. MCM7及HPV在上颌窦鳞状细胞癌中的表达及临床意义[J]. 中国口腔颌面外科杂志, 2017, 15(5): 392–6. [ Hu Y, Lu L, Jiang FF, et al. Expression and clinical significance of MCM7 and HPV in squamous cell carcinoma of the maxillary sinus[J]. Zhongguo Kou Qiang He Mian Wai Ke Za Zhi, 2017, 15(5): 392–6. ] |
| [6] | Honeycutt KA, Chen Z, Koster MI, et al. Deregulated minichromosomal maintenance protein MCM7 contributes to oncogene driven tumorigenesis[J]. Oncogene, 2006, 25(29): 4027–32. DOI:10.1038/sj.onc.1209435 |
| [7] | 王同帅, 王超鹏, 周美娟. 紫外线对黑色素瘤细胞A375自噬与凋亡诱导效应[J]. 实用医学杂志, 2017, 33(8): 1223–7. [ Wang TS, Wang CP, Zhou MJ. The effect of autophagy and crosstalk with apoptosis induced by Ultraviolet in A375[J]. Shi Yong Yi Xue Za Zhi, 2017, 33(8): 1223–7. DOI:10.3969/j.issn.1006-5725.2017.08.008 ] |
| [8] | Strozyk E, Kulms D. The role of AKT/mTOR pathway in stress response to UV-irradiation: implication in skin carcinogenesis by regulation of apoptosis, autophagy and senescence[J]. Int J Mol Sci, 2013, 14(8): 15260–85. DOI:10.3390/ijms140815260 |
| [9] | Qu K, Wang Z, Fan H, et al. MCM7 promotes cancer progression through cyclin D1-dependent signaling and serves as a prognostic marker for patients with hepatocellular carcinoma[J]. Cell Death Dis, 2017, 8(2): e2603. DOI:10.1038/cddis.2016.352 |
| [10] | 史琳, 张安文, 赵时梅, 等. 细胞周期增殖指标在甲状腺乳头状癌中的诊断价值[J]. 广西医学, 2014, 35(1): 13–5. [ Shi L, Zhang AW, Zhao SM, et al. Value of Proliferation Biomarkers of Cell Cycle in Diagnosis of Papillary Thyroid Carcinoma[J]. Guangxi Yi Xue, 2014, 35(1): 13–5. ] |
| [11] | 李瑶, 刘丽娜, 杨永秀. MCM7、Ki67在宫颈鳞状细胞癌及其癌前病变中的表达及临床意义[J]. 中国妇幼保健, 2014, 29(13): 2085–8. [ Li Y, Liu LN, Yang YX. Expressions of MCM7 and Ki67 in cervical squamous cell carcinoma and cervical precancerous lesion and their clinical significances[J]. Zhongguo Fu You Bao Jian, 2014, 29(13): 2085–8. ] |
| [12] | 张琼, 李甸源. MCM7和P53在食管癌组织中的表达及临床意义[J]. 中国继续医学教育, 2015, 7(4): 173–5. [ Zhang Q, Li DY. The Expression and Clinical Significance of the MCM7 and P53 in Esophageal Tissue[J]. Zhongguo Ji Xu Yi Xue Jiao Yu, 2015, 7(4): 173–5. DOI:10.3969/j.issn.1674-9308.2015.04.150 ] |
| [13] | 任占平, 石喆, 张芫. 子宫内膜样腺癌组织中p27、MCM7蛋白的表达及意义[J]. 肿瘤防治研究, 2011, 38(1): 73–6. [ Ren ZP, Shi Z, Zhang Y. Expression and Significance of p27 and MCM7 Proteins in Endometrioid Adenocarcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2011, 38(1): 73–6. DOI:10.3971/j.issn.1000-8578.2011.01.021 ] |
| [14] | Deraco M, Cabras A, Baratti D, et al. Immunohistochemical Evaluation of Minichromosome Maintenance Protein 7 (MCM7), Topoisomerase Ⅱα, and Ki-67 in Diffuse Malignant Peritoneal Mesothelioma Patients Using Tissue Microarray[J]. Ann Surg Oncol, 2015, 22(13): 4344–51. DOI:10.1245/s10434-015-4498-z |
| [15] | Nitulescu GM, Margina D, Juzenas P, et al. Akt inhibitors in cancer treatment: The long journey from drug discovery to clinical use (Review)[J]. Int J Oncol, 2016, 48(3): 869–85. DOI:10.3892/ijo.2015.3306 |
| [16] | Qiu YT, Wang WJ, Zhang B, et al. MCM7 amplification and overexpression promote cell proliferation, colony formation and migration in esophageal squamous cell carcinoma by activating the AKT1/mTOR signaling pathway[J]. Oncol Rep, 2017, 37(6): 3590–6. DOI:10.3892/or.2017.5614 |
| [17] | 范世珍, 陈旭娜, 于波海, 等. 姜黄素通过抑制PI3K/Akt/mTOR促进SiHa细胞自噬[J]. 中国实验诊断学, 2017, 21(5): 897–900. [ Fan SZ, Chen XN, Yu BH, et al. Curcumin inhibits PI3K/Akt/mTOR pathway to induce SiHa cells autophagy[J]. Zhongguo Shi Yan Zhen Duan Xue, 2017, 21(5): 897–900. DOI:10.3969/j.issn.1007-4287.2017.05.044 ] |
| [18] | 张春, 李清漪, 董海影, 等. PI3K/AKT/mTOR信号通路在诱导胶质瘤细胞凋亡中的作用[J]. 中国新药杂志, 2016, 25(16): 1909–12. [ Zhang C, Li QY, Dong HY, et al. Curcumol induces apoptosis of U87 cells via the PI3K/AKT/mTOR pathway[J]. Zhongguo Xin Yao Za Zhi, 2016, 25(16): 1909–12. ] |
| [19] | 陈明, 王举涛, 吴珍妮, 等. 半枝莲总黄酮通过PI3K/AKT/mTOR通路诱导肿瘤细胞自噬的体内实验研究[J]. 中国中药杂志, 2017, 42(7): 1358–64. [ Chen M, Wang JT, Wu ZN, et al. Effect of total flavonoids in Scutellaria barbata in mediating autophagy in tumor cells via PI3K/AKT/mTOR pathway[J]. Zhongguo Zhong Yao Za Zhi, 2017, 42(7): 1358–64. ] |
 2018, Vol. 45
2018, Vol. 45