文章信息
- 阿瑞匹坦对妇科恶性肿瘤化疗相关不良反应的影响
- Effect of Aprepitant on Chemotherapy-induced Adverse Reactions in Gynecological Malignancy Patients
- 肿瘤防治研究, 2018, 45(11): 913-916
- Cancer Research on Prevention and Treatment, 2018, 45(11): 913-916
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0265
- 收稿日期: 2018-02-28
- 修回日期: 2018-06-26
化疗相关性恶心呕吐(chemotherapy-induced nausea and vomiting, CINV)是肿瘤患者化疗过程中最常见的不良反应之一[1]。恶心和呕吐不仅对患者的情感、心理产生明显的负面影响, 降低患者对治疗的依从性, 还会影响患者的营养摄入及生活质量[2]。而化疗患者的营养摄入差可能加重贫血程度。有研究显示, 贫血程度与恶性肿瘤患者的疗效和生存期有关[3-4]。目前有研究显示阿瑞匹坦可有效降低铂类药物所致恶心、呕吐, 改善化疗患者的营养状况及生活质量[5]。本研究通过回顾性分析阿瑞匹坦止吐方案治疗患者恶心、呕吐、头晕头痛发生情况及化疗前后患者血红蛋白水平和外周血象的变化情况。
1 资料与方法 1.1 研究对象收集2013年7月—2017年6月我院收治的85例妇科生殖系统恶性肿瘤患者作为研究对象。纳入标准:年龄18岁以上; 接受紫杉醇+顺铂方案化疗, 紫杉醇使用剂量135~175 mg/m2, 顺铂使用剂量70~75 mg/m2; 既往未行放化疗治疗; KPS评分大于60;至少接受3疗程化疗; 肝肾功能基本正常, 无中枢神经系统疾病及严重内科疾病。排除标准:颅内高压、放疗、胃肠梗阻、手术治疗等其他原因引起的呕吐; 精神疾病患者; 妊娠或哺乳期患者; 水肿和血栓患者; 化疗前24 h内呕吐或者用过止吐药者。入组患者均签署知情同意书。该治疗方案经医院医学伦理委员会批准通过。
1.2 研究方法根据患者止吐药物使用情况分为阿瑞匹坦组(34例)和对照组(51例), 阿瑞匹坦组止吐用药为阿瑞匹坦+5-HT3受体拮抗剂+地塞米松, 对照组止吐药为5-HT3受体拮抗剂+地塞米松。阿瑞匹坦用法:第二天铂类药物输注前1 h口服, 第二、三天口服时间均与前一天间隔24 h。5-HT3受体拮抗剂用法用量:托烷司琼4 mg, 静滴, d1~3, 第1天化疗前30 min及第2、3天上午各给药1次; 地塞米松用法:第1天化疗前30 min给予10 mg。从化疗第一天开始至该次住院化疗结束, 研究人员每日填写病例报告表, 详细记录并观察研究对象的服药情况、临床效果、患者头晕头痛呕吐的次数、是否使用挽救治疗及所有不良反应。
1.3 疗效评价本研究观察的主要指标胃肠道不良反应、神经系统不良反应发生率及化疗后血红蛋白下降程度、外周血象变化。本次研究将胃肠道反应的评价标准分为5个等级, 0级:无恶心、呕吐; Ⅰ级:食欲正常, 呕吐1次/24小时; Ⅱ级:食欲明显下降, 但能进食, 呕吐2~5次/24小时; Ⅲ级:无食欲, 呕吐6~10次/24小时; Ⅳ级:呕吐 > 10次/24小时, 需胃肠支持治疗。两组患者的胃肠道反应由经治医师及管床护士负责记录并进行统计。患者化疗开始前清晨抽取静脉血查血常规, 纪录血红蛋白水平, 三疗程紫杉醇+铂类药物化疗后, 于清晨再次抽取静脉血查血常规, 纪录血红蛋白水平。比较阿瑞匹坦组和对照组两组患者间血红蛋白变化情况。
1.4 统计学方法采用SPSS19.0统计软件进行分析, 定量资料组间比较采用t检验, 定性资料组间比较采用卡方检验。P < 0.05为差异有统计学意义。
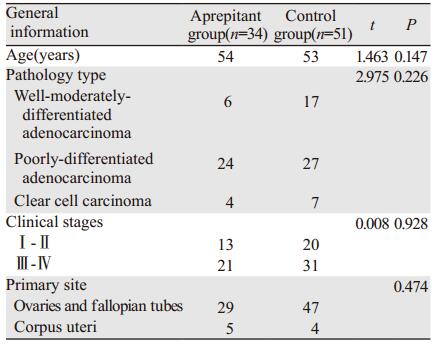
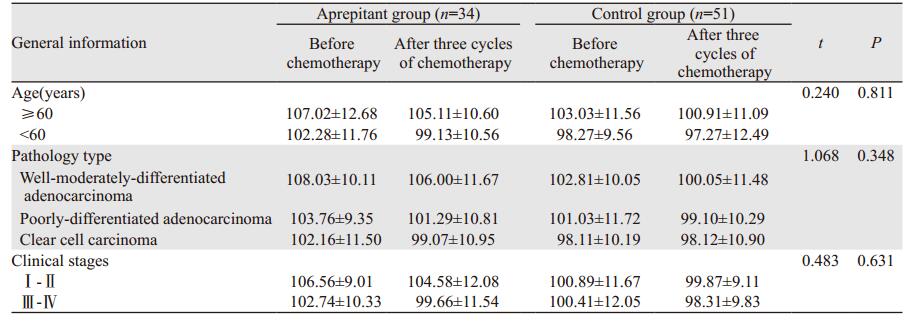
2 结果 2.1 一般情况共入组85例女性恶性肿瘤患者, 年龄26~79岁。两组患者在年龄、病理类型、肿瘤分期等方面的基线特征基本类似, 差异无统计学意义(P > 0.05), 见表 1。
|
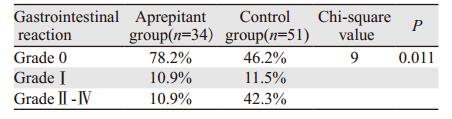
化疗后两组0级胃肠道反应发生率比较差异有统计学意义(P < 0.05), 具体结果见表 2。在化疗期间, 阿瑞匹坦组和对照组相比无严重恶心呕吐患者所占比例分别为89.1%、57.7%, 表明阿瑞匹坦组89.1%的患者恶心、呕吐程度低, 化疗期间可以进食水, 有利于营养摄入, 保证生活质量。
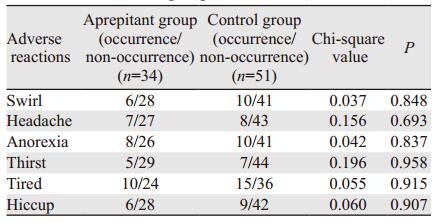
化疗后两组患者在头晕、头痛、厌食、便秘等其他止吐药主要不良反应的发生率相当, 差异均无统计学意义, 见表 3。
|
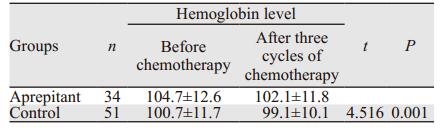
化疗前, 两组患者的血红蛋白(hemoglobin, Hb)水平比较, 差异无统计学意义(P > 0.05);三疗程化疗后, 两组患者的Hb水平均较化疗前明显下降, 两组下降程度差异有统计学意义(P < 0.05), 见表 4。按年龄、病理类型、临床分期分组比较, 各组患者化疗前后Hb值差异均无统计学意义(P > 0.05), 见表 5。
|
|
以上结果表明阿瑞匹坦组患者化疗后恶心、呕吐发生率低, 对患者食欲及营养摄入影响较小, 通过饮食补充造血所需营养物质, 化疗后贫血发生程度相对减弱。
3 讨论化疗是妇科恶性肿瘤综合治疗中的重要组成部分, 特别是晚期卵巢癌患者, 需行多个疗程化疗。近几年临床中紫杉醇+铂类化疗方案广泛应用于妇科恶性肿瘤的治疗[6], 同时铂类也是主要高致吐性化疗药物之一[7], 而化疗引起的恶心呕吐(CINV)是主要的不良反应, 严重影响了癌症患者的治疗疗效[8-9]。阿瑞匹坦作为高选择性NK-1受体拮抗剂, 能够阻断P物质与NK-1受体结合, 通过中枢作用抑制高致吐细胞毒性药物引起的恶心呕吐[10]。本研究中, 阿瑞匹坦组和对照组患者0级及Ⅰ级胃肠道反应的发生率分别为89.1%和57.7%, 提示加用阿瑞匹坦在改善化疗引起的胃肠道反应疗效显著。本组患者中阿瑞匹坦组化疗期间89.1%的患者可以进食水, 一定程度上避免了营养不良、电解质紊乱等情况的发生, 增加了患者营养摄入及治疗的依从性, 保证化疗的顺利进行。
已有研究显示, 随着血红蛋白的下降, 化疗的疗效也下降, 提示贫血与化疗疗效之间具有相关性[10]。因为随着贫血的加重, 瘤体内的乏氧细胞增多, 降低了化疗药物对增殖期肿瘤细胞的杀伤作用, 另外乏氧导致应激保护基因作用增强, 影响药物和癌症细胞的结合[11]。
肿瘤患者发生贫血原因很多, 目前公认的影响因素有以下几种:营养不良、出血或者血细胞破坏如溶血等、放化疗导致的骨髓抑制、炎性反应介质引起的内源性促红素减少等[12]。有研究证实, 分期越晚, 发生贫血的概率越大[13-14]。在接受放化疗的癌症患者中, 贫血发生率可高达70%~90%。相关文献指出, 化疗对贫血的影响最显著。化疗后患者恶心、呕吐及食欲减退导致营养不良、生活质量差也影响造血功能的恢复[15]。
通过研究妇科肿瘤患者三疗程化疗前后Hb值的改变, 我们发现, Hb值改变与阿瑞匹坦的使用具有相关性。化疗致恶心、呕吐及食欲减退导致营养不良、生活质量差加重贫血的程度。通过使用阿瑞匹坦使患者恶心、呕吐程度减弱, 尽早恢复食欲开始进食, 补充造血所需营养物质, 有利于血红蛋白的生成, 减弱化疗所致贫血程度。
因此, 口服阿瑞匹坦, 对晚期癌症患者的症状、预防耐药、提高疗效、改善生存质量及延长晚期癌症患者的生存时间均有积极意义。
| [1] | Ruhlmann CH, Herrstedt J. Safety evaluation of aprepitant for the prevention of chemotherapy-induced nausea and vomiting[J]. Expert Opin Drug Saf, 2011, 10(3): 449–62. DOI:10.1517/14740338.2011.563235 |
| [2] | Rapoport BL. Efficacy of a triple antiemetic regimen with aprepitant for the prevention of chemotherapy-induced nausea and vomiting:effects of gender, age, and region[J]. Curr Med Res Opin, 2014, 30(9): 1875–81. DOI:10.1185/03007995.2014.925866 |
| [3] | 高艳, 许崇安, 刘殊, 等. 癌性贫血对恶性肿瘤患者生活质量及生存期的影响[J]. 中华肿瘤防治杂志, 2009, 16(24): 1957–60. [ Gao Y, Xu CA, Liu S, et al. Influence of malignant tumor anemia on the malignancy patients' quality of life and survival[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2009, 16(24): 1957–60. ] |
| [4] | de U Vries, Reif K, Petermann F. Tumorbedingte Fatigue und ihre psychosozialen Belastungen[J]. Der Urol, 2012, 51(3): 413–21. DOI:10.1007/s00120-012-2844-3 |
| [5] | Hamada S, Hinotsu S, Kawai K, et al. Antiemetic efficacy and safety of a combination of palonosetron, aprepitant, and dexamethasone in patients with testicular germ cell tumor receiving 5-day cisplatin-based combination chemotherapy[J]. Support Care Cancer, 2014, 22(8): 2161–6. DOI:10.1007/s00520-014-2182-7 |
| [6] | 葛鲁倩, 孙文洲, 赵欣瑶, 等. 新辅助化疗联合间隔肿瘤细胞减灭术对晚期卵巢癌耐药性和生存时间的影响及耐药性影响因素分析[J]. 实用妇产科杂志, 2017, 33(1): 43–7. [ Ge LQ, Sun WZ, Zhao XY, et al. Effect of neoadjuvant chemotherapy combined with interval of tumor cells to destroy the loss(NACT-IDS) on drug resistance and survival time of advanced ovarian cancer and analysis of drug resistance[J]. Shi Yong Fu Chan Ke Za Zhi, 2017, 33(1): 43–7. ] |
| [7] | 陈怡雯, 倪丽萍. 1例阿瑞匹坦用于化疗后Ⅲ级呕吐的观察与护理[J]. 齐齐哈尔医学院学报, 2014, 35(22): 3429–30. [ Chen YW, Ni LP. One case of his minions horse temple used to grade Ⅲ vomiting after chemotherapy of observation and nursing care[J]. Qiqihaer Yi Xue Yuan Xue Bao, 2014, 35(22): 3429–30. ] |
| [8] | 裴丽, 罗艳, 黄显金, 等. 阿瑞匹坦的用药风险与合理应用[J]. 中国药物应用与监测, 2015, 12(5): 310–2. [ Pei L, Luo Y, Huang XJ, et al. Risk and rational use of aripitant[J]. Zhongguo Yao Wu Ying Yong Yu Jian Ce, 2015, 12(5): 310–2. ] |
| [9] | 董爽, 王俊, 胡胜, 等. 女性肺癌和乳腺癌患者中阿瑞匹坦与奥氮平预防多日化疗所致延迟性恶心呕吐的疗效观察[J]. 肿瘤防治研究, 2017, 44(5): 356–9. [ Dong S, Wang J, Hu S, et al. Aprepitant versus Olanzapine for Prevention of Nausea and Vomiting Induced by Multiday Chemotherapy in Female Lung Cancer or Breast Cancer Patients[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(5): 356–9. DOI:10.3971/j.issn.1000-8578.2017.05.009 ] |
| [10] | Chawla SP, Grunberg SM, Gralla RJ, et al. Establishing the dose of the oral NK1 antagonist aprepitant for the prevention of chemotherapy-induced nausea and vomiting[J]. Cancer, 2003, 97(9): 2290–300. DOI:10.1002/(ISSN)1097-0142 |
| [11] | 陈文艳, 熊建萍. 肿瘤缺氧及其靶向治疗研究进展[J]. 国际肿瘤学杂志, 2006, 33(1): 8–11. [ Chen WY, Xiong JP. Advances in tumor hypoxia and its targeted therapy[J]. Guo Ji Zhong Liu Xue Za Zhi, 2006, 33(1): 8–11. DOI:10.3760/cma.j.issn.1673-422X.2006.01.004 ] |
| [12] | 韩金凤, 王芳. 癌性贫血的研究进展[J]. 辽宁中医药大学学报, 2009, 11(10): 198–9. [ Han JF, Wang F. Advances in research on carcinogenic anemia[J]. Liaoning Zhong Yi Yao Da Xue Xue Bao, 2009, 11(10): 198–9. ] |
| [13] | 许崇安, 李琳, 高艳, 等. 癌性贫血对肺癌患者生活质量及预后的影响[J]. 中华肿瘤防治杂志, 2010, 17(10): 763–6. [ Xu CA, Li L, Gao Y, et al. Impact of malignant tumor anemia on quality of life and prognosis in patients with lung cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2010, 17(10): 763–6. ] |
| [14] | 陈洪琴, 周容. 妊娠期与产褥期贫血临床处理[J]. 实用妇产科杂志, 2016, 32(9): 645–7. [ Chen HQ, Zhou R. Clinical treatment of gestational and puerperal anemia[J]. Shi Yong Fu Chan Ke Za Zhi, 2016, 32(9): 645–7. ] |
| [15] | Shah N, Andrews J, Goodnough LT. Transfusions for anemia in adult and pediatric patients with malignancies[J]. Blood Rev, 2015, 29(5): 291–9. DOI:10.1016/j.blre.2015.02.001 |
 2018, Vol. 45
2018, Vol. 45