文章信息
- 不同剂量率高能X射线对宫颈癌HeLa细胞生物学效应的影响
- Effect of High Energy X-rays at Different Dose Rates on Biological Effects of Cervical Cancer HeLa Cells
- 肿瘤防治研究, 2018, 45(11): 870-873
- Cancer Research on Prevention and Treatment, 2018, 45(11): 870-873
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0256
- 收稿日期: 2018-02-26
- 修回日期: 2018-03-29
2. 610041 成都,四川省肿瘤医院放疗中心
2. Department of Radiation Oncology, Sichuan Cancer Hospital, Chengdu 610041, China
调强放射治疗(Intensity-modulated radiation therapy, IMRT)因为能够在给予肿瘤靶区高剂量的同时,减少肿瘤周围重要脏器或组织的剂量,而广泛地应用于各种肿瘤的放射治疗中。随着调强放疗技术的发展,特别是静态/动态调强放疗、容积调强放疗、断层调强放疗技术的出现,图像引导的调强放射治疗到剂量引导的调强放射治疗的转变,治疗模式与以往常规照射有明显差异。技术的进展使直线加速器的剂量率得到了极大提高,从常规的2 Gy/min已能高达20 Gy/min。剂量率改变很可能导致放疗分割方式的改变,因此研究剂量率对肿瘤治疗的影响具有重要意义。本研究通过对人宫颈癌HeLa细胞株高能X射线不同剂量率照射后生物学效应的影响,初步探讨了调强放射治疗的放射生物学基础。
1 材料与方法 1.1 宫颈癌细胞株及试剂人宫颈腺癌HeLa细胞株由广西医科大学肿瘤研究所提供,RPMI1640培养基购自美国Gibco公司,胎牛血清购自兰州明海生物工程公司,CO2培养箱购自美国Thermo公司,超净工作台由苏州净化设备公司提供,50 ml一次性培养瓶购自美国Corning公司。
1.2 细胞传代、计数显微镜下观察到细胞贴壁几乎长满时即可传代,约3~4天传代一次。细胞计数采用血细胞板计数方法,对压线细胞采取“记上不记下,记左不记右”的原则。
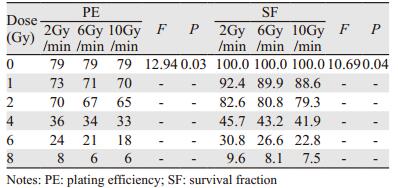
1.3 细胞接种通过预实验初步描绘HeLa细胞存活曲线,根据应种细胞数:未照射的对照组细胞接种数/该剂量下的细胞存活率,计算出各剂量点应接种细胞数。本研究所接种细胞数取近似整数以确保细胞接种时的准确性。各剂量点接种细胞数,见表 1。
选择三种不同剂量率梯度分别设为2、6和10 Gy/min三组,照射各组不同剂量点已接种相应细胞数的培养瓶于24 h后照射,射野大小设20 cm×15 cm,采用瓦里安直线加速器(Novalis Tx)6MV X线照射,照射方式为机架旋转180℃,培养瓶下垫2.0 cm厚组织补偿垫(固体水)以利于剂量建成(经物理师核定符合照射均匀剂量),组织补偿垫与培养瓶底面之间紧密衔接,源至瓶底距离为100 cm。将HeLa细胞分别按0、1、2、4、6、8 Gy剂量点急速照射一次后放入37℃、5%CO2恒温恒湿培养箱内培养12天。每个剂量点设三组平行样本,且实验重复3次。
1.5 细胞克隆计数方法细胞培养12天后,从培养箱中取出细胞培养瓶。去除培养基后加入0.5%结晶紫2 ml进行细胞固定染色。5 min后用自来水冲洗培养瓶,除去残余结晶紫,显微镜下计数每个克隆中细胞个数。照射结束后存活的细胞集落数即为大于50个细胞的克隆数,并计算照射结束后克隆形成率(PE=克隆形成数/100×100%),细胞存活率(SF=大于50个细胞克隆数/(接种细胞个数×PE)×100%)。
1.6 数据处理及统计学方法计算三个高能X射线不同剂量率组照射各剂量点细胞数后得出的克隆形成率(PE)和细胞存活率(SF)。采用GraphPad Prism5.0软件处理各剂量率组的存活率,以单靶多击数学模型拟合曲线,公式为:SF=1-(1-e-D/D0)N,e为自然对数的底,近似等于2.7,logN=Dq/D0,分别求出3组细胞放射生物学参数平均致死剂量D0、准阈剂量Dq、外推数N值;以线性二次方程数学模型拟合曲线,公式为:SF=e-αD-βDˆ2,分别求出3个剂量率组细胞放射生物学参数α、β值。采用SPSS19.0统计软件分别对三个剂量率照射组中克隆形成率,百分存活率,放射生物学参数数据进行统计分析,组间比较采用随机区组方差分析。
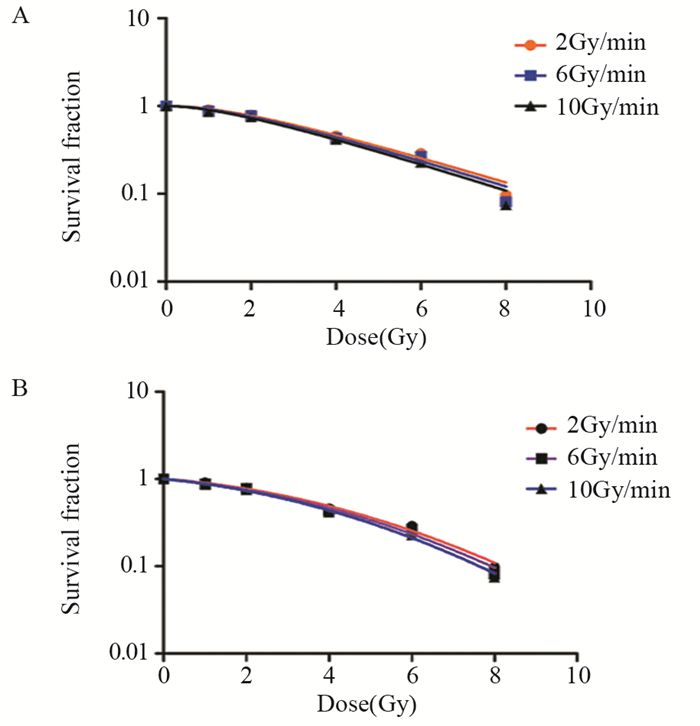
2 结果 2.1 三个剂量率组高能X射线细胞克隆形成率及存活率照射后形成的集落数明显减少,且形态不规则,见图 1~2。HeLa细胞2、6、10 Gy/min组分别在0、1、2、4、6、8 Gy各剂量点照射后的细胞克隆形成率及存活率,见表 2,可见随剂量增加,HeLa细胞存活率逐渐降低,随剂量率增加,各平行剂量组细胞存活率也相应逐渐降低。随机区组方差分析结果,剂量率和剂量对PE的影响F值分别为12.94和2266.93,P值分别为0.03和0.000,剂量率和剂量对SF的影响F值分别为10.69和2378.87,P值分别为0.04和0.000,故可认为剂量率和剂量对HeLa细胞PE和SF的影响差异均具有统计学意义。
|
| 图 1 HeLa细胞照射前后集落图 Figure 1 Colony images of HeLa cells before and after irradiation |

|
| 图 2 HeLa细胞镜下照射前后单个集落 Figure 2 Single colony under microscope before and after irradiation |
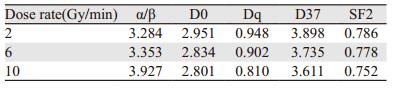
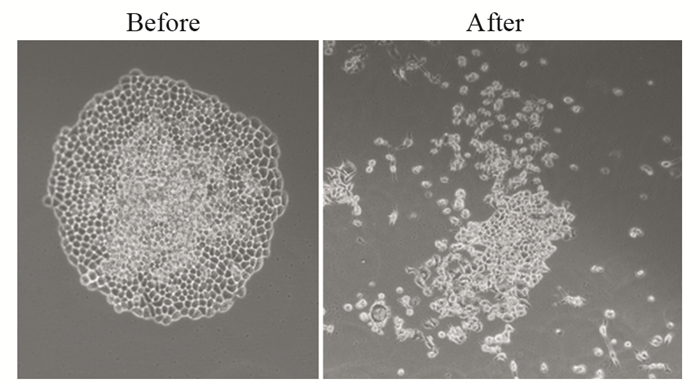
采用GraphPad Prism 5.0软件,分别选取各剂量率组多个剂量点细胞存活分数以单靶多击模型拟合曲线,得出HeLa细胞放射生物学参数。拟合曲线图上可见三条近似曲线在低剂量处存在一下降肩区,高剂量区为一近似斜向下直线,无明显的肩区和斜率变化。以线性二次方程模型拟合曲线,见图 3,随着剂量率增加,α/β值逐渐增大,见表 3。随机区组方差分析三种剂量率比较F值为0.142,P值为0.87,故可认为三组剂量率对生物学参数α/β、D0、Dq、D37、SF2(单次照射2 Gy时的细胞存活分数)的影响差异无统计学意义。
|
| 图 3 单靶多击模型(A)和线性二次方程模型(B)拟合曲线 Figure 3 Single-target multi-hit model(A) and linear quadratic equation model(B) fitting curves |
IMRT放疗技术在临床的使用提高靶区物理适形性的同时也可能改变剂量输出模式,单次剂量输出时间的长短取决于剂量率的大小。Azimi等[1-2]揭示了10种正常组织在照射时间延长时生物学效应的变化情况,研究发现在外照射超过30 min时,细胞存活分数明显增加。Shibamoto等[3]研究也发现鼠肿瘤细胞株E14T6和SCCVⅡ在照射时间延长2 min,亚致死损伤修复就已经开始发生,在延长5 min后,EMT6细胞株存活比率上升了13%,SCCVⅡ细胞株上升了18%。Wang等[4]研究人前列腺肿瘤株(α/β=3.1Gy)在体外照射时间延长时细胞存活比率随之变化,发现对于低α/β值的肿瘤,单次照射的总时间对生物效应有着更大的影响。Calugaru等[5-6]研究了9个人类肿瘤细胞株,结果提示照射时间大于20 min就将影响到肿瘤细胞的百分存活比率。
尽管诸多研究提示剂量率是决定特定剂量所产生的一系列生物反应的主要因素,剂量率降低可导致放射生物效应下降。在使用调强照射技术时,照射时间的延长对细胞的存活分数有着一定程度的影响。而高能X射线不同固定剂量率传输时间对细胞放射生物学效应的研究甚少。
细胞克隆形成法能准确反映细胞辐射后具有无限增殖能力的细胞数,至今仍被认为是评价离体细胞放射生物效应最好的手段。单靶多击数学模型拟合曲线所得参数中,最终斜率D0反映细胞在相对高剂量区对射线的敏感度,D0值越大,细胞对射线越抗拒。Dq值表示细胞亚致死性损伤修复能力的大小,Dq值越大,表明细胞亚致死性损伤修复能力越大。LQ模型中的α值代表起始斜率,决定低剂量照射下对细胞的损伤程度。β值代表超线性效应部分,随照射剂量增加而加大,当线性部分与平方部分对细胞杀灭的贡献相等时,其照射剂量等于α/β值,它也反映细胞亚致死性损伤修复能力的大小,α/β值越大,细胞亚致死性损伤修复能力越小[7]。
线性二次数学方程(LQ)模型为放射生物效应的研究及临床放射治疗计划分割模式的等效生物剂量之间转换提供了可行的方法[8]。但LQ模型也有其局限性,离体细胞实验没有充分考虑到细胞再增殖、再氧化、乏氧及其他外界环境等因素的影响,相对于体内复杂的生物机制试验模型显得简单,能否反应活体内细胞对剂量率的实际生物学效应,还有待于大量的动物试验及临床研究进一步证实。
众所周知,IMRT的技术优势集中体现在对于靶区的精确定位及高度适形性上[9],这种“精确和完美”是通过改变射束方向、移动床角、增加子野数量来实现的。在输出剂量率不变的情况下无疑会延长治疗时间,进一步会使单位时间内组织的吸收剂量降低。多项研究认为治疗时间延长会降低肿瘤细胞放射生物学效应,同时会引起器官运动变化而造成靶区剂量的不确定性[10-13]。单次剂量输出时间的长短依赖于剂量率的大小,随着放射物理技术的飞速发展,直线加速器的输出最大剂量率与常规治疗比较不断提高,因此治疗模式下输出剂量率的改变对细胞生物学效应的影响是我们迫切需要了解的问题。Kamer等[14]研究了不同分割剂量,剂量率对细胞放射敏感度的影响,也发现随着剂量分割和照射时间的增加,细胞的存活分数不断增大,可能与亚致死损伤修复有关。Paganetti等[15]认为治疗时间超过20 min才需考虑剂量率效应,也证明了细胞存活分数随输出时间延长而增加。沈捷等[16]研究了三种宫颈癌细胞株不同剂量点照射后,MTT法检测2~8 Gy/min剂量率变化对SF2影响差异无统计学意义。本研究中HeLa细胞在2、6、10 Gy/min高能X射线剂量率照射后,剂量率对SF的影响差异有统计学意义,对各组间生物学参数影响差异无统计学意义。
高能X射线三种不同剂量率照射HeLa细胞后,随着剂量率增大,HeLa细胞百分存活率趋势逐渐下降,生物学效应逐渐增加,初步为临床IMRT治疗提供了放射生物学依据。由于本研究仅纳入三种剂量率,且仅研究了人宫颈腺癌HeLa细胞株,对其他输出剂量率梯度及细胞株的影响尚不明确,且缺乏活体组织的研究基础。在未来的研究中可进一步改变剂量率梯度,并且进行更多的动物实验及临床研究深入探讨剂量率对宫颈癌细胞生物学效应的影响。
| [1] | Azimi R, Alaei P, Spezi E, et al. Characterization of an orthovoltage biological irradiator used for radiobiological research[J]. J Radiat Res, 2015, 56(3): 485–92. DOI:10.1093/jrr/rru129 |
| [2] | Xu XG. An exponential growth of computational phantom research in radiation protection, imaging, and radiotherapy: a review of the fifty-year history[J]. Phys Med Biol, 2014, 59(18): R233–302. DOI:10.1088/0031-9155/59/18/R233 |
| [3] | Shibamoto Y, Ito M, Sugie C, et al. Recovery from sublethal damage during intermittent exposures in cultured tumor cells: implications for dose modification inradiosurgery and IMRT[J]. Int J Radiat Oncol Biol Phys, 2009, 59(5): 1484–90. |
| [4] | Wang JZ, Li XA, D'Souza WD, et al. Impact of prolonged fraction delivery times on tumor control: a note of caution for intensity-modulated radiation therapy (IMRT)[J]. Int J Radiat Oncol Biol Phys, 2003, 57(2): 543–52. DOI:10.1016/S0360-3016(03)00499-1 |
| [5] | Calugaru V, Nauraye C, Noël G, et al. Radiobiological characterization of two therapeutic proton beams with different initial energy spectra used at the Institut Curie Proton Therapy Center in Orsay[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): 1136–43. DOI:10.1016/j.ijrobp.2010.09.003 |
| [6] | Kim SS, Choo DW, Shin D, et al. In vivo radiobiological characterization of proton beam at the National Cancer Center in Korea: effect of the Chk2 mutation[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2): 559–62. DOI:10.1016/j.ijrobp.2010.08.010 |
| [7] | 沈瑜, 糜福顺. 肿瘤放射生物学[M]. 第1版. 北京: 医药科技出版社, 2002: 219.] [ Shen Y, Yan FS. Cancer radiobiology[M]. First Edition. Beijing: Medical Science and Technology Press, 2002: 219. ] |
| [8] | 李夏东, 吴稚冰, 马胜林, 等. 放射生物LQ线性二次模型的数理基础及临床意义[J]. 中国医学物理学杂志, 2012, 29(1): 3188–93. [ Li XD, Wu ZB, Ma SL, et al. The Mathematic and Physical Base of Radiobiology LQ Line Quadratic Model and Its Clinical Significance[J]. Zhongguo Yi Xue Wu Li Xue Za Zhi, 2012, 29(1): 3188–93. DOI:10.3969/j.issn.1005-202X.2012.01.027 ] |
| [9] | 何爱琴, 李咏, 刘继斌, 等. 宫颈癌组织ICAM-1和VEGF表达与放疗敏感相关性研究[J]. 中华肿瘤防治杂志, 2014, 21(4): 284–8. [ He AQ, Li W, Liu JB, et al. Relationship between expression of intercellular adhesion molecule-1 and vascular perme-ability factor and radiosensitivity in human cervical squamous cancer tissues[J]. Zhonghu Zhong Liu Fang Zhi Za Zhi, 2014, 21(4): 284–8. DOI:10.3969/j.issn.1673-5269.2014.04.010 ] |
| [10] | Hrycushko BA, Gutierrez AN, Goins B, et al. Radiobiological characterization of post-lumpectomy focal brachytherapy with lipid nanoparticle-carried radionuclides[J]. Phys Med Biol, 2011, 56(3): 703–19. DOI:10.1088/0031-9155/56/3/011 |
| [11] | Malone S, Croke J, Roustan-Delatour N, et al. Postoperative radiotherapy for prostate cancer: a comparison of four consensus guidelines and dosimetric evaluation of 3D-CRT versus tomotherapy IMRT[J]. Int J Radiat Oncol Biol Phys, 2012, 84(3): 725–32. DOI:10.1016/j.ijrobp.2011.12.081 |
| [12] | Pajonk F, Vlashi E. Characterization of the stem cell niche and its importance in radiobiological response[J]. Semin Radiat Oncol, 2013, 23(4): 237–41. DOI:10.1016/j.semradonc.2013.05.007 |
| [13] | 叶伟军, 曹新平, 欧阳翼. 局部晚期宫颈癌三维CT引导下加速超分割后装治疗临床观察[J]. 中华肿瘤防治杂志, 2014, 21(8): 626–9. [ Ye WJ, Cao XP, Ou YY. 3D CT-guided accelerated hyperfractioned brachytherapy treated for locally advanced cervical carcinoma[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2014, 21(8): 626–9. DOI:10.3969/j.issn.1673-5269.2014.08.013 ] |
| [14] | Kamer S, Ren Q, Dicker AP. Differential radiation sensitization of human cervical cancer cell lines by the proteasome inhibitor velcade (bortezomib, PS-341)[J]. Arch Gynecol Obstet, 2009, 279(1): 41–6. DOI:10.1007/s00404-008-0667-7 |
| [15] | Paganetti H. Changes in tumor cell response due to prolonged dose delivery times in fractionated radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2005, 63(3): 892–900. DOI:10.1016/j.ijrobp.2005.07.953 |
| [16] | 沈捷, 明越, 汤贤超, 等. 不同剂量和剂量率对宫颈癌细胞的放射敏感性[J]. 协和医学杂志, 2013, 4(4): 383–6. [ Shen J, Ming Y, Tang XC, et al. Radiosensitivity of Cervical Cancer Cells to Different Radiation Doses and Dose Rates[J]. Xie He Yi Xue Za Zhi, 2013, 4(4): 383–6. DOI:10.3969/j.issn.1674-9081.2013.04.008 ] |
 2018, Vol. 45
2018, Vol. 45