文章信息
- 重视肿瘤生酮治疗的研究
- Putting More Efforts on Cancer Ketogenic Therapy Research
- 肿瘤防治研究, 2018, 45(4): 193-198
- Cancer Research on Prevention and Treatment, 2018, 45(4): 193-198
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0233
- 收稿日期: 2018-02-23
- 修回日期: 2018-03-09
新近研究发现,肿瘤代谢重编程是肿瘤的核心特征[1-2],于是,调节异常代谢自然成为肿瘤治疗的一个新方向[3-4]。Warburg效应是肿瘤代谢重编程中最核心的特征,这种低效率的有氧糖酵解代谢方式需要消耗大量葡萄糖,葡萄糖代谢因而成为代谢调节的首要关注点。研究发现,减少葡萄糖供给,选择性切断肿瘤细胞的能量供应,可以显著抑制多种肿瘤细胞的增殖,抑制肿瘤生长,对正常细胞及机体(宿主)却无不良影响[5]。控制葡萄糖也就成为肿瘤代谢调节治疗的基石性要求。减少碳水化合物时,为了维持机体的能量需求、避免蛋白质糖异生,必然要求提高脂肪供能比例。以低糖、高脂肪及适量蛋白质为特征的生酮饮食(ketogenic diet, KD)符合这一要求,肿瘤生酮疗法(cancer ketogenic therapy, CKT)由此应运而生,并成为近年来肿瘤研究的一个热点[6-8]。生酮疗法(ketogenic therapy, KT)作为一种代谢调节治疗,其治疗适应证由早期的儿童癫痫、后来的多种良性疾病、扩大到现在的恶性肿瘤。随着肿瘤代谢与营养研究的深入和发展,近年来受到专业人士及肿瘤患者的广泛关注。
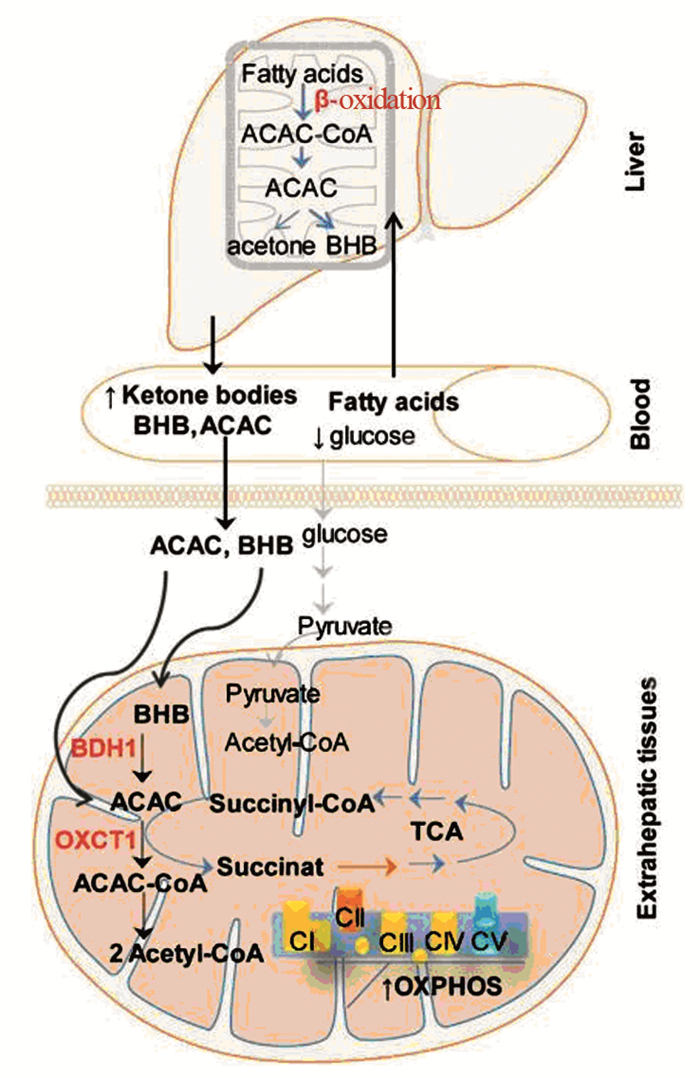
1 酮体的产生与代谢当葡萄糖摄入量 < 100g/d或 < 2g/(kg·d)时,机体利用脂肪酸在肝脏产生酮体。饥饿情况下机体脂肪组织分解产生的脂肪酸、生酮饮食条件下饮食摄入的脂肪酸,进入肝脏经β-氧化产生乙酰辅酶A,乙酰辅酶A首先被转化成乙酰乙酸(acetoacetate, AcAc),之后被催化变成β-羟基丁酸(β-hydroxybutyrate, β-HB),少量乙酰乙酸脱羧产生丙酮(acetone, Ac)。丙酮不能被继续代谢产生腺嘌呤核苷三磷酸(adenosine triphosphate, ATP),AcAc与β-HB进入血液循环被肝脏以外组织摄取、利用,为细胞供能。葡萄糖缺乏条件下,正常细胞可以很好地利用酮体供能,而多数肿瘤细胞不能利用酮体供能,肿瘤细胞的这个特点正是肿瘤生酮治疗的理论基础。影响酮体利用的因素很多,但是主要取决于:(1)酮体的转运蛋白,酮体依靠单羧酸转运载体(monocarboxylate transporter, MCT)将酮体从血液循环中转运至细胞(线粒体)内;(2)酮体代谢关键酶,经MCT转运至细胞内的β-HB和AcAc分别依靠3羟基丁酸盐脱氢酶1(3-hydroxybutyrate dehydrogenase 1, BDH1)、3-酮酸辅酶A转移酶(3-oxoacid CoA-transferase 1, OXCT1),也称琥珀酰辅酶A-3-酮酸辅酶A转移酶(succiny-CoA-3-oxoacid CoA transferase, SCOT),代谢供能,BDH1、OXCT1是酮体代谢关键酶[9],见图 1。
生酮疗法通过减少体内葡萄糖水平,提高酮体水平,选择性饥饿肿瘤细胞,调节细胞异常代谢而达到治疗目的。肿瘤患者(宿主)可以利用脂肪酸(酮体)供能,而肿瘤细胞依赖葡萄糖作为主要能量来源。据此,提供足够脂肪、限制葡萄糖的饮食,即生酮饮食,理论上可以治疗肿瘤[10-12]。肿瘤生酮疗法最先始于脑胶质瘤,随后拓展到脑部其他肿瘤,进而用于治疗胰腺癌、肺癌、乳腺癌、胃癌、结直肠癌、前列腺癌、黑色素瘤、肝癌、耳鼻喉肿瘤、黑色素瘤、宫颈癌等,而且其治疗对象(肿瘤类型)还在继续扩大。
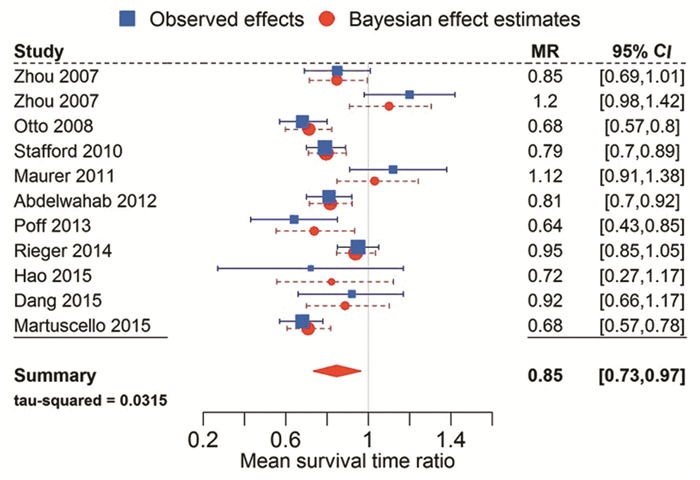
2.1 动物实验肿瘤生酮疗法研究目前较多地集中在动物实验中,结果喜人。最新Meta分析发现生酮饮食显著降低了风险比值、延长了荷瘤动物生存时间[13],见图 2。早在1987年Tisdale等[14]就发现,MAC16结肠癌恶液质小鼠喂养高脂肪饮食后,小鼠体重丢失减少,肿瘤占小鼠体重比例下降,小鼠实际载肉量(carcass mass)升高,血浆游离脂肪酸水平下降,血浆酮体(乙酰乙酸和β-羟基丁酸)水平升高,提示生酮饮食可以逆转荷瘤小鼠恶液质。Mavropoulos等[15]给免疫缺陷小鼠接种LNCaP细胞、建立前列腺癌移植瘤模型,然后随机分为高脂无糖组、低脂高糖组及高脂中糖组,3组动物的总能量及蛋白质摄入量相同,均不限制热量,结果显示高脂无糖组动物体重显著高于其他实验组动物,生存时间显著延长。Nakamura等[16]最近在结肠癌细胞株小鼠模型上发现,生酮饮食可以有效抑制肿瘤生长,抑制炎性反应,从而预防肿瘤恶液质。
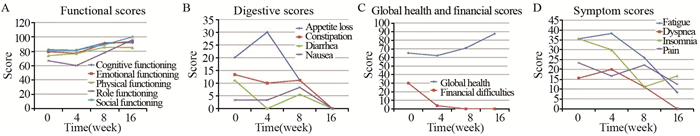
临床上以病例报告为主,缺少设计严密的对照研究。Zuccoli等[17]报道1例多形性胶质母细胞瘤患者,在实施标准抗肿瘤治疗同时摄入低热量生酮饮食,经过2月治疗,患者体重丢失20%,肿瘤病灶消失;停止生酮饮食后10周,肿瘤复发。说明生酮饮食可抑制肿瘤细胞生长。Tan-Shalaby等[18]报告了17例没有化疗的进展期肿瘤患者实施生酮治疗情况,其中11例可评价,生酮治疗4周后,患者功能及整体健康评分明显升高,消化道及症状评分显著降低,未见严重不良反应,见图 3;3例坚持生酮饮食 > 16周的患者分别生存80、116及131周,显著长于其他患者。Schmidt等[19]在没有常规抗肿瘤治疗的进展期肿瘤转移患者中有相类似发现,提示即使是进展期肿瘤患者生酮疗法也是可行的、安全的,可以有效改善生活质量。Klement和Sweeney[20]最近报告了6例患者接受生酮饮食+放疗的结果,5例病灶缩小,1例进展,全部患者肌肉保持稳定。作为一种饮食治疗方式,肿瘤生酮疗法在脑部肿瘤,尤其是脑胶质瘤的作用已经有较多数据支持,据此,《中国肿瘤营养治疗指南》推荐:脑部恶性肿瘤患者在接受标准治疗的同时,可考虑尝试代谢调节治疗,给予能量限制性生酮饮食[21]。
毋庸讳言,肿瘤生酮疗法作为一种新手段、一个新尝试,目前面临诸多困难与挑战,笔者认为应该重点在如下几个方面加强努力。
3.1 重视临床研究尽管肿瘤生酮治疗在荷瘤动物实验中取得了确切的疗效,但是距离临床广泛推广应用仍然很远。目前国际上已经有20多个注册研究正在进行[22-25],美国国立卫生研究院也已经资助多项生酮饮食干预肿瘤的临床研究。在我国,对肿瘤生酮疗法的探索,肿瘤患者、生产企业已经先行一步,我国目前有近万名肿瘤患者自发地实施不同方式及不同程度的生酮治疗,企业界已经生产出生酮制剂产品,专业肿瘤及营养工作者反而相对滞后。因而急需广泛开展临床研究,指导肿瘤患者的规范应用。
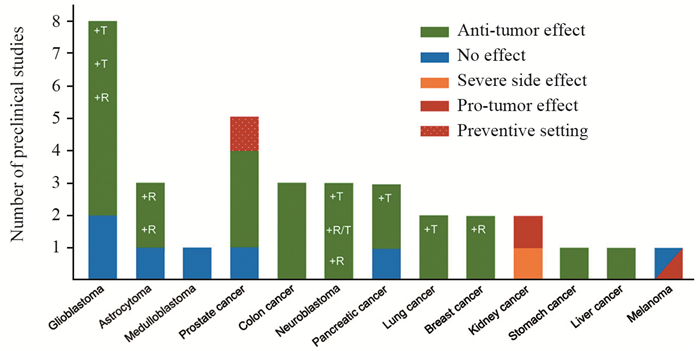
3.2 探询疗效差异原因尽管多数研究已经肯定了肿瘤生酮疗法的有效作用[13, 26],但是也有部分研究显示生酮饮食抗肿瘤疗效不一致、不确定,甚至相反[27],见图 4。有人认为生酮饮食的疗效不是酮体的作用,而是中链脂肪酸所致,或是低热量的效果[28]。有些相同处理的研究得到阴性结论,体内酮体水平升高,血糖浓度下降,但是肿瘤的体积并没有缩小,生存时间也没有明显改善[29]。理论上,肿瘤细胞不能利用酮体供能,生酮治疗应该有效,但是实际并非完全如此,提示肿瘤细胞的酮体代谢模式有极强的个体异质性。这些互相矛盾的研究结果,要求我们认真分析疗效差异的原因。希望通过对不同肿瘤患者代谢模式异质性分析,找到生酮治疗疗效差异的原因;希望通过对不同肿瘤患者代谢模式进行分类,筛选出适合生酮治疗的患者。
动物实验发现,生酮治疗既可以单独使用,也可以与其他肿瘤治疗方法联合使用。Poff等[30]报道,联合使用生酮饮食、酮体口服及高压氧治疗,效果更好,显著延长了荷瘤小鼠的生存时间。Allen等[31]给接种肺癌NCI-H292或A549细胞的小鼠喂养普通饮食或生酮饮食,然后分别给予放疗或放疗+化疗,发现与普通饮食+放疗相比,生酮饮食联合放疗或者联合放疗+化疗小鼠肿瘤生长速度减慢、生存时间延长。Woolf等[7]将自己的观察结合他人的报告认为:生酮饮食可以有效增敏放、化疗效果。这些联合使用的动物研究结果为临床肿瘤生酮治疗提供了有力的数据支持,生酮饮食联合放疗、化疗可能是目前最为现实的临床方案[32]。
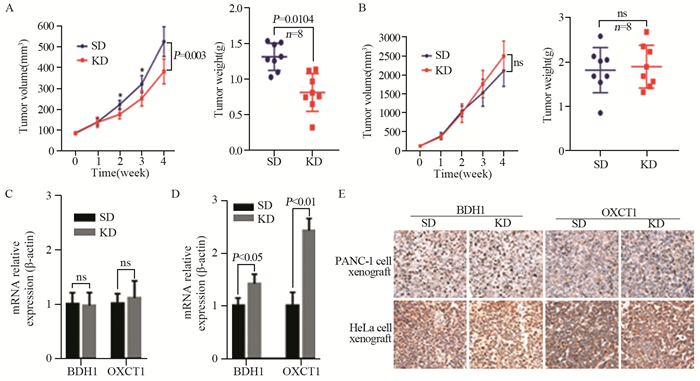
4 我们的探索我们的团队近年来一直关注肿瘤生酮治疗[32-35]。前期研究中,我们采用RT-qPCR检测了33株肿瘤细胞中BDH1、OXCT1的表达情况,发现不同细胞表达差异显著;根据结果选择BDH1、OXCT1高表达的宫颈癌HeLa细胞以及低表达的胰腺癌PANC-1细胞,在不同浓度β-HB的低糖培养基中观察细胞增殖情况,发现:与正常糖浓度的对照组相比,低糖组HeLa细胞和PANC-1细胞增殖明显抑制;在低糖培养基加入β-HB后,HeLa细胞增殖明显好转,而PANC-1细胞增殖无显著改善;荷瘤鼠生酮饮食喂养实验中,KD显著抑制PANC-1移植瘤的生长,但对HeLa移植瘤的生长无抑制作用;同时敲低BDH1、OXCT1的HeLa细胞对KD治疗的敏感度显著提高。我们还发现肺癌细胞株H1299的BDH1、OXCT1基础表达水平很低,与PANC-1类似,但是H1299移植瘤对生酮治疗并不敏感;检测KD干预后H1299细胞内酮体代谢关键酶表达水平发现,生酮治疗可以明显诱导H1299细胞BDH1、OXCT1表达。上述研究结果显示:肿瘤生酮治疗敏感度存在显著差异,酮体代谢关键酶BDH1、OXCT1低表达,并且不受生酮治疗诱导表达的肿瘤细胞对生酮治疗敏感,BDH1、OXCT1高表达的肿瘤对生酮肿瘤不敏感;说明肿瘤生酮疗法的敏感度与BDH1、OXCT1基础表达及诱导表达差异有关,BDH1、OXCT1基础表达及诱导表达差异可能是生酮肿瘤敏感度差异的重要原因[36-37],见图 5。BDH1、OXCT1表达增强,肿瘤细胞可以更好地利用酮体供能,从而促进肿瘤生长,表现为肿瘤生酮疗法的敏感度降低或无效;反之,BDH1、OXCT1表达下降,使肿瘤细胞酮体利用供能不足或障碍,肿瘤生长被抑制,表现为肿瘤生酮疗法的敏感度增强。肿瘤生酮疗法的敏感度高低与BDH1、OXCT1表达高低负相关。
Chang等[38]通过活检观察了22例脑肿瘤患者(17例脑胶质瘤、3例星形细胞瘤及2例少突星形细胞瘤)瘤体中BDH1、OXCT1表达情况,发现多数肿瘤细胞二者表达显著降低,但是异质性明显;BDH1/OXCT1极低表达、低表达、正常表达例数(百分比)分别为12(55%)/10(45%)、9(41%)/5(23%)、1(5%)/7(32%)。进一步研究发现,BDH1、OXCT1表达水平低、而且未能诱导表达的脑胶质瘤细胞利用酮体障碍,生酮饮食治疗可获得较好的疗效[39]。这些研究结果充分肯定了我们的推测和发现,肿瘤酮体代谢的高度异质性可能是导致不同肿瘤对生酮饮食反应不同和疗效差异的原因。
5 展望综述目前的肿瘤生酮治疗研究,一方面充分肯定了生酮治疗的有效性,为临床肿瘤生酮疗法奠定了坚实的证据基础;另一方面明确发现了生酮治疗的差异性,为今后的生酮治疗研究指明了努力的方向。肿瘤细胞株及其荷瘤动物的发现,不仅需要肿瘤PDX模型在体实验的继续验证,而且需要临床肿瘤患者的应用证明;不仅需要继续探讨生酮治疗的有效性,更需要加快探明疗效差异的原因,以期寻找新的、能够指导KD治疗的分子标志物,建立预测肿瘤生酮治疗敏感度的分子诊断方法,发掘提高肿瘤生酮治疗疗效的干预靶点,为促进精准生酮治疗进入临床应用提供理论和实验依据,从而进一步提高肿瘤治疗效果。
| [1] | Ward PS, Thompson CB. Metabolic reprogramming: a cancer hallmark even warburg did not anticipate[J]. Cancer Cell, 2012, 21(3): 297–308. DOI:10.1016/j.ccr.2012.02.014 |
| [2] | Vander Heiden MG, DeBerardinis RJ. Understanding the intersections between metabolism and cancer biology[J]. Cell, 2017, 168(4): 657–69. DOI:10.1016/j.cell.2016.12.039 |
| [3] | Asati V, Mahapatra DK, Bharti SK. PI3K/Akt/mTOR and Ras/Raf/MEK/ERK signaling pathways inhibitors as anticancer agents: Structural and pharmacological perspectives[J]. Eur J Med Chem, 2016, 109: 314–41. DOI:10.1016/j.ejmech.2016.01.012 |
| [4] | Mahapatra DK, Asati V, Bharti SK. MEK inhibitors in oncology: a patent review (2015-Present)[J]. Expert Opin Ther Pat, 2017, 27(8): 887–906. DOI:10.1080/13543776.2017.1339688 |
| [5] | Foster R, Griffin S, Grooby S, et al. Multiple metabolic alterations exist in mutant PI3K cancers, but only glucose is essential as a nutrient source[J]. PLoS One, 2012, 7(9): e45061. DOI:10.1371/journal.pone.0045061 |
| [6] | Chung HY, Park YK. Rationale, feasibility and acceptability of ketogenic diet for cancer treatment[J]. J Cancer Prev, 2017, 22(3): 127–34. DOI:10.15430/JCP.2017.22.3.127 |
| [7] | Woolf EC, Syed N, Scheck AC. Tumor metabolism, the ketogenic diet and β-hydroxybutyrate: novel approaches to adjuvant brain tumor therapy[J]. Front Mol Neurosci, 2016, 9: 122. |
| [8] | 石汉平. 肿瘤新疗法—代谢调节治疗[J]. 肿瘤代谢与营养电子杂志, 2014, 1(1): 3–5. [ Shi HP. Neo-therapy for cancer: Metabolism regulation[J]. Zhong Liu Dai Xie Yu Ying Yang Dian Zi Za Zhi, 2014, 1(1): 3–5. ] |
| [9] | Vidali S, Aminzadeh S, Lambert B, et al. Mitochondria: The ketogenic diet--A metabolism-based therapy[J]. Int J Biochem Cell Biol, 2015, 63: 55–9. DOI:10.1016/j.biocel.2015.01.022 |
| [10] | Vergati M, Krasniqi E, Monte GD, et al. Ketogenic diet and other dietary intervention strategies in the treatment of cancer[J]. Curr Med Chem, 2017, 24(12): 1170–85. |
| [11] | Smyl C. Ketogenic diet and cancer-a perspective[J]. Recent Results Cancer Res, 2016, 207: 233–40. DOI:10.1007/978-3-319-42118-6 |
| [12] | Bozzetti F, Zupec-Kania B. Toward a cancer-specific diet[J]. Clin Nutr, 2016, 35(5): 1188–95. DOI:10.1016/j.clnu.2015.01.013 |
| [13] | Klement RJ, Champ CE, Otto C, et al. Anti-tumor effects of ketogenic diets in mice: a meta-analysis[J]. PLoS One, 2016, 11(5): e0155050. DOI:10.1371/journal.pone.0155050 |
| [14] | Tisdale MJ, Brennan RA, Fearon KC. Reduction of weight loss and tumour size in a cachexia model by a high fat diet[J]. Br J Cancer, 1987, 56(1): 39–43. DOI:10.1038/bjc.1987.149 |
| [15] | Mavropoulos JC, Buschemeyer WC 3rd, Tewari AK, et al. The effects of varying dietary carbohydrate and fat content on survival in a murine LNCaP prostate cancer xenograft model[J]. Cancer Prev Res (Phila), 2009, 2(6): 557–65. DOI:10.1158/1940-6207.CAPR-08-0188 |
| [16] | Nakamura K, Tonouchi H, Sasayama A, et al. A ketogenic formula prevents tumor progression and cancer cachexia by attenuating systemic inflammation in colon 26 tumor-bearing mice[J]. Nutrients, 2018, 10(2): pii: E206. DOI:10.3390/nu10020206 |
| [17] | Zuccoli G, Marcello N, Pisanello A, et al. Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: Case Report[J]. Nutr Metab (Lond), 2010, 7: 33. DOI:10.1186/1743-7075-7-33 |
| [18] | Tan-Shalaby JL, Carrick J, Edinger K, et al. Modified Atkins diet in advanced malignancies-final results of a safety and feasibility trial within the Veterans Affairs Pittsburgh Healthcare System[J]. Nutr Metab (Lond), 2016, 13: 52. DOI:10.1186/s12986-016-0113-y |
| [19] | Schmidt M, Pfetzer N, Schwab M, et al. Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: A pilot trial[J]. Nutr Metab (Lond), 2011, 8(1): 54. DOI:10.1186/1743-7075-8-54 |
| [20] | Klement RJ, Sweeney RA. Impact of a ketogenic diet intervention during radiotherapy on body composition: Ⅰ. Initial clinical experience with six prospectively studied patients[J]. BMC Res Notes, 2016, 9: 143. DOI:10.1186/s13104-016-1959-9 |
| [21] | 中国抗癌协会肿瘤营养与支持治疗专业委员会. 中国肿瘤营养治疗指南[M]. 北京: 人民卫生出版社, 2015: 289-96.] [ China Anti-Cancer Association, Chinese Society for Oncological Nutrition and Supportive Care. Chin ese nutrition therapy guidelines for cancer patients[M]. Beijing: People' s Medical PublishingHouse, 2015: 289-96. ] |
| [22] | Schwartz K, Chang HT, Nikolai M, et al. Treatment of glioma patients with ketogenic diets: report of two cases treated with an IRB-approved energy-restricted ketogenic diet protocol and review of the literature[J]. Cancer Metab, 2015, 3: 3. DOI:10.1186/s40170-015-0129-1 |
| [23] | Martin-McGill KJ, Marson AG, Tudur Smith C, et al. Ketogenic diets as an adjuvant therapy in glioblastoma (the KEATING trial): study protocol for a randomised pilot study[J]. Pilot Feasibility Stud, 2017, 3: 67. DOI:10.1186/s40814-017-0209-9 |
| [24] | Klement RJ, Sweeney RA. Impact of a ketogenic diet intervention during radiotherapy on body composition:Ⅱ. Protocol of a randomised phase I study (KETOCOMP)[J]. Clin Nutr ESPEN, 2016, 12: e1–e6. DOI:10.1016/j.clnesp.2015.11.001 |
| [25] | Zahra A, Fath MA, Opat E, et al. Consuming a ketogenic diet while receiving radiation and chemotherapy for locally advanced lung cancer and pancreatic cancer: the university of iowa experience of two phase 1 clinical trials[J]. Radiat Res, 2017, 187(6): 743–54. DOI:10.1667/RR14668.1 |
| [26] | Nakamura K, Tonouchi H, Sasayama A, et al. A ketogenic formula prevents tumor progression and cancer cachexia by attenuating systemic inflammation in colon 26 tumor-bearing mice[J]. Nutrients, 2018, 10(2): pii: E206. DOI:10.3390/nu10020206 |
| [27] | Weber DD, Aminazdeh-Gohari S, Kofler B. Ketogenic diet in cancer therapy[J]. Aging (Albany NY), 2018, 10(2): 164–5. |
| [28] | Augustin K, Khabbush A, Williams S, et al. Mechanisms of action for the medium-chain triglyceride ketogenic diet in neurological and metabolic disorders[J]. Lancet Neurol, 2018, 17(1): 84–93. DOI:10.1016/S1474-4422(17)30408-8 |
| [29] | De Feyter HM, Behar KL, Rao JU, et al. A ketogenic diet increases transport and oxidation of ketone bodies in RG2 and 9L gliomas without affecting tumor growth[J]. Neuro Oncol, 2016, 18(8): 1079–87. DOI:10.1093/neuonc/now088 |
| [30] | Poff AM, Ward N, Seyfried TN, et al. Non-toxic metabolic management of metastatic cancer in vm mice: novel combination of ketogenic diet, ketone supplementation, and hyperbaric oxygen therapy[J]. PLoS One, 2015, 10(6): e0127407. DOI:10.1371/journal.pone.0127407 |
| [31] | Allen BG, Bhatia SK, Buatti JM, et al. Ketogenic diets enhance oxidative stress and radio-chemo-therapy responses in lung cancer xenografts[J]. Clin Cancer Res, 2013, 19(14): 3905–13. DOI:10.1158/1078-0432.CCR-12-0287 |
| [32] | 王晓琳, 饶本强, 江波, 等. 生酮饮食联合疗法治疗恶性肿瘤研究进展[J]. 肿瘤代谢与营养电子杂志, 2016, 3(4): 255–60. [ Wang XL, Rao BQ, Jiang B, et al. Ketogenic diet in combination with other therapies in cancer[J]. Zhong Liu Dai Xie Yu Ying Yang Dian Zi Za Zhi, 2016, 3(4): 255–60. ] |
| [33] | 鲁运新, 石汉平. 生酮饮食与肿瘤治疗[J]. 肿瘤代谢与营养电子杂志, 2015, 2(1): 61–6. [ Lu YX, Shi HP. Ketogenic diet and cancer treatment[J]. Zhong Liu Dai Xie Yu Ying Yang Dian Zi Za Zhi, 2015, 2(1): 61–6. ] |
| [34] | 石汉平. 肿瘤生酮疗法[J]. 肿瘤代谢与营养电子杂志, 2016, 3(2): 66–70. [ Shi HP. Cancer ketogenic therapy[J]. Zhong Liu Dai Xie Yu Ying Yang Dian Zi Za Zhi, 2016, 3(2): 66–70. ] |
| [35] | 曲芊诺, 饶本强, 石汉平. 生酮饮食的抗肿瘤机制[J]. 肿瘤代谢与营养电子杂志, 2016, 3(3): 191–4. [ Qu QN, Rao BQ, Shi HP. Anti-tumor mechanism of ketogenic diet[J]. Zhong Liu Dai Xie Yu Ying Yang Dian Zi Za Zhi, 2016, 3(3): 191–4. ] |
| [36] | 张杰, 丛明华, 高云, 等. 肿瘤生酮代谢疗法敏感性依赖于酮体代谢酶水平[J]. 肿瘤代谢与营养电子杂志, 2017, 4(4): 421–30. [ Zhang J, Cong MH, Gao Y, et al. The sensitivity of the ketogenic metabolic therapy in cancer depends on the expression of ketolytic key enzymes[J]. Zhong Liu Dai Xie Yu Ying Yang Dian Zi Za Zhi, 2017, 4(4): 421–30. ] |
| [37] | Zhang J, Jia PP, Liu QL, et al. Low ketolytic enzyme levels in tumors predict ketogenic diet responses in cancer cell lines in vitro and in vivo[J]. J Lipid Res, 2018: pii: jlr.M082040. |
| [38] | Chang HT, Olson LK, Schwartz KA. Ketolytic and glycolytic enzymatic expression profiles in malignant gliomas: implication for ketogenic diet therapy[J]. Nutr Metab (Lond), 2013, 10(1): 47. DOI:10.1186/1743-7075-10-47 |
| [39] | Maurer GD, Brucker DP, Bähr O, et al. Differential utilization of ketone bodies by neurons and glioma cell lines: a rationale for ketogenic diet as experimental glioma therapy[J]. BMC Cancer, 2011, 11: 315. DOI:10.1186/1471-2407-11-315 |
 2018, Vol. 45
2018, Vol. 45