文章信息
- 天然免疫检查点CD47-SIRPα在恶性肿瘤中的研究进展
- Research Progress of CD47-SIRPα Signaling Axis as An Innate Immune Checkpoint in Cancer
- 肿瘤防治研究, 2018, 45(8): 604-608
- Cancer Research on Prevention and Treatment, 2018, 45(8): 604-608
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0217
- 收稿日期: 2018-02-14
- 修回日期: 2018-04-28
2. 430060 武汉,武汉大学人民医院肿瘤一科
2. Department of Oncology I, Renmin Hospital of Wuhan University, Wuhan 430060, China
正常情况下,机体具有免疫监视功能,通过天然和获得性免疫进行识别和杀伤最终清除机体损伤或发生突变的细胞。肿瘤细胞通过上调免疫检查点及其配体,抑制T细胞的免疫活性,引起肿瘤免疫逃逸[1]。因而阻断检查点与其配体的结合可打破免疫耐受,促进肿瘤细胞的免疫清除。目前已有伊匹单抗(Ipilimumab,抗CTLA-4抗体)、派姆单抗(Pembrolizumab,抗PD-1抗体)、纳武单抗(Nivolumab,抗PD-1抗体)等多个免疫检查点抑制剂获批用于临床抗肿瘤治疗。尽管免疫检查点抑制剂在多种肿瘤(如黑色素瘤、非小细胞肺癌、肾透明细胞癌等)中取得临床疗效,但其仍存在局限性,如对部分患者无效或较易产生耐药[2]。因此,发现和研究新的免疫检查点及其抑制剂尤为重要。本文将两个新的免疫检查点:分化群47(cluster of differentiation 47, CD47)和信号调节蛋白α(signal regulatory proteins α, SIRPα)及其抑制剂的研究进展进行综述。
2 CD47和SIRPα简介CD47又叫整合素相关蛋白(integrin associated protein, IAP),相对分子质量为50 kD, 属于免疫球蛋白超家族(immunoglobulins superfamily, IgSF),是一个广泛表达于正常组织细胞的膜蛋白,结构包括:一个单独的IgV样的N末端,五个高度疏水延伸的跨膜片段和一个短的选择性拼接的羧基段胞质C末端。CD47最初发现于胚盘细胞,它与整合素ανβ3蛋白相结合,因此称之为IAP。无论是血液系统肿瘤还是实体瘤,肿瘤细胞胞膜上的CD47都呈现出过表达的状态[3]。
SIRPα亦称为包含SH2结构域的蛋白酪氨酸磷酸酶底物1(SH2domain-containing protein tyrosine phosphatase substrate-1, SHPS-1),属于IgSF的跨膜蛋白,其胞外区含有三个IgSF结构域——一个NH2末端V样结构域和两个C1样IgSF结构域,其中NH2末端结构域与CD47相结合。胞外区通过一个跨膜区域与胞内含免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibition motif, ITIM)的结构域相连接。SIRPα在髓系细胞胞膜上呈高表达,比如巨噬细胞、粒细胞、单核细胞和髓样树突细胞[3]。
3 CD47-SIRPα轴的免疫调节作用CD47在所有正常细胞中都有表达,而SIRPα只表达于髓系细胞(单核细胞、巨噬细胞、粒细胞、骨髓树突状细胞)和中枢神经系统的神经元细胞。SIRPα是CD47的一种重要的表面受体,CD47与SIRPα结合后,将SIRPα尾端的两个典型ITIMs酪氨酸残基磷酸化。随后,磷酸化的ITIM能招募和激活蛋白质酪氨酸磷酸酶,特别是Src同源区域SHP-1和SHP-2。磷酸酶SH-2域与SIRPα自身磷酸化的ITIMs相互作用打乱了它们酪氨酸蛋白磷酸酯酶域的抑制使酶具有活性,这导致多种近端基板上磷酸化酪氨酸残基脱磷酸化,进而阻断依赖酪氨酸磷酸化的信号传递途径,限制吞噬功能[4],见图 1。CD47-SIRPα信号通路在免疫系统中表现为负性调节作用。
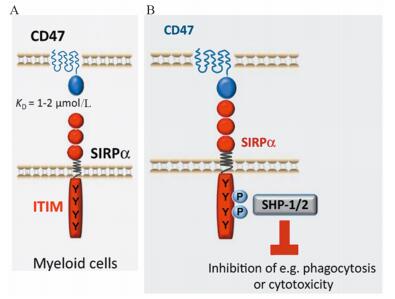
|
| A: CD47 contains one N-terminal extracellular IgV-like domain and five transmembrane spanning segments. SIRPα contains three extracellular IgSF domains, one transmembrane spanning region and intracellular domain with ITIMs; B: after the binding of CD47 to SIRPα, two ITIMs in the cytoplasmic tail of SIRPα become phosphorylated, and then recruit and activate phosphatases, especially SHP-1/2. Eventually, it blocks the pathway and inhibits various cellular processes, including inhibition of phagocytosis or cytotoxicity 图 1 CD47与SIRPα结构及两者结合后的作用机制[4] Figure 1 Structure of CD47 and SIRPα and their interactions[4] |
CD47可作为癌症天然免疫检查点的基础是体内正常的CD47-SIRPα轴可维持稳态。Oldenborg等研究发现CD47可作为细胞表面“自我”标记调节巨噬细胞的吞噬功能[5]。缺乏CD47的红细胞输注到正常小鼠体内后可被脾中巨噬细胞迅速清除,而正常红细胞可通过细胞表面的CD47与巨噬细胞上受体SIRPα相互作用抑制其吞噬活性。机体内巨噬细胞可根据该机制释放CD47表达较高的年轻红细胞,清除CD47下调的衰老红细胞。随后Ishikawa-Sekigami等将正常红细胞输入SIRPα受体突变型(缺乏ITIMs)小鼠,将很快被吞噬和清除,再次证实CD47-SIRPα轴参与了体内红细胞的吞噬和清除[6]。进一步的机制研究显示CD47与SIRPα结合导致与红细胞吞噬作用相关的肌球蛋白IIA的灭活,而它是发挥吞噬作用的重要因素[7]。
斯坦福大学的Weissman教授团队发现肿瘤细胞中CD47也可以作为“不要吃我”的信号逃避免疫监视和巨噬细胞的吞噬。研究显示几乎所有肿瘤细胞表面都会高表达CD47,与巨噬细胞表面的SIRPα结合后抑制其吞噬肿瘤细胞的功能,而抗CD47单克隆抗体的使用能够抑制肿瘤的生长和转移[8]。其他一些实验室在不同类型的血液肿瘤及实体瘤中采用各种方法和试剂针对CD47-SIRPα轴的研究结果得到了相似的结论。有单独阻断CD47-SIRPα轴的研究,还有一些研究是阻断CD47-SIRPα轴的同时联合了其他药物,例如利妥昔单抗、曲妥珠单抗、西妥昔单抗、细胞毒性药物[9],甚至与其他检查点抑制剂联用[10]。
4.2 抑制CD47-SIRPα轴对免疫系统的影响越来越多的研究显示单独阻断CD47诱导抗肿瘤免疫能力有限,第二刺激如调节抗体或其他促吞噬作用的刺激可能是必需的[11]。但也有一部分报道中显示单独使用CD47抗体也有效果。
由于NOD-SCID IL-2受体γ无效(NOD-SCID IL-2 receptor gamma null, NSG)老鼠模型的局限性(缺乏T、B、NK细胞),目前大多数研究侧重于观察阻断CD47-SIRPα轴后天然免疫系统的反应。通常认为阻断CD47-SIRPα轴可增强巨噬细胞的吞噬作用,事实上除了巨噬细胞,中性粒细胞也表达SIRPα。中性粒细胞参与调节抗体依赖性细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxic effects, ADCC),在同系和异种小鼠癌症模型中对体内抗体治疗的效果有直接贡献[12]。在体外将抗CD47、SIRPα的抗体或F(ab)2抗体联合曲妥珠单抗使用可增强中性粒细胞介导的对乳腺癌细胞的杀伤作用[13],而单独阻断CD47-SIRPα轴没有效果。
为了验证阻断CD47-SIRPα轴后对获得性免疫应答是否有影响,有几组实验选用了有免疫能力的实验动物。有研究发现阻断CD47-SIRPα轴后,巨噬细胞能通过激活CD8+T细胞和抑制CD4+T细胞来提高效应T细胞的抗肿瘤效应[14]。Liu等采用了一个特殊的小鼠模型,其体内的巨噬细胞是首次暴露于经体外CD47抗体封闭的表达卵清蛋白(ovalbumin, OVA)的肿瘤。与之前实验结果不同的是,该研究发现促进CD47抑制剂发挥治疗作用的主要是树突状细胞(dendritic cells, DC)而不是巨噬细胞。进一步实验表明阻断CD47-SIRPα轴后其抗肿瘤作用依赖于CD8+T细胞与DC(而不是巨噬细胞)交叉引发[15]。CD47-SIRPα轴诱导肿瘤特异性细胞毒性T细胞应答的确切机制仍是未知的,但可以确定的是增强树突状细胞对肿瘤成分的摄取可改善抗原呈递和(或)促吞噬作用共刺激信号的产生。此外,CD47抗体对肿瘤细胞的抗体调节也可能有助于诱导T细胞介导的抗肿瘤免疫[16-17]。
4.3 CD47-SIRPα轴相关检查点抑制剂 4.3.1 抗CD47抗体临床前研究多采用与SIRPα交互的CD47抗体—B6H12[15],结果表明B6H12有效增强了体外及NSG模型体内巨噬细胞的吞噬作用从而抑制肿瘤生长[18-19]。阻断CD47的完整抗体不仅可以对抗CD47-SIRPα轴,还有可能同时调节了存在IgG Fc受体表达的细胞,如巨噬细胞、中性粒细胞甚至NK细胞(不表达SIRPα)对肿瘤细胞的ADCC,从而创建了一个双重杀伤信号[20]。Zhao等通过阻断(而非调节)F(ab′)2碎片证实:至少在体外条件下,B6H12对于血液和实体瘤肿瘤细胞的调节作用是必须的[21]。更重要的是,这表明B6H12与F(ab′)2片段本身不促进中性粒细胞或单核细胞介导的对肿瘤细胞的破坏,但它们确实加强了其他调节抗体的作用。为了避免完整的CD47抗体FcγR介导的效应,Liu等开发出了带有IgG4 Fc片段的抗体—Hu5F9-G492[22],并且现在已将它投入到了血液和实体瘤的临床试验中。因为IgG4抗体仍有可能有效地与高亲和性人类FcγRI受体结合[23],因此Hu5F9-G4仍可能造成潜在的不良反应。此外,最近报道了一种针对CD47和CD20的双特异性抗体[24]。这种双特异性抗体与CD47有相对较低的亲和力,从而对表达CD47的细胞的结合整体减少,但它同时保留了对CD20的结合能力。在异种基因小鼠模型的体内实验中,与单独使用利妥昔单抗相比,双特异性抗体与单一抗体联用同样增强了对淋巴瘤细胞的清除[24]。然而,这项研究并没有显示出这种双特异性抗体是否可以有选择性地针对体内的淋巴瘤细胞。
Theocharides等将CD47的NH2终端与一个IgG4 Fc融合,得到的融合物在体外可有效地促进巨噬细胞对急性髓性白血病细胞的吞噬作用,在NSG小鼠体内可诱导对急性髓性白血病细胞的清除[25]。这种制剂目前正在临床试验中。Weiskopf等使用一种修饰了的人类重组SIRPα蛋白质(CV1),这种蛋白与CD47的亲和力是原蛋白质的50 000倍[9]。尽管我们可以利用它有效地阻断CD47-SIRPα轴,但无论在体内还是体外条件下都无法促进肿瘤细胞的破坏。但是当这一单体与单抗联合使用时,如与利妥昔单抗、阿仑单抗联用,它可能会导致体内Raji Burkitt淋巴瘤细胞的破坏。当它与曲妥珠单抗联用时可破坏NSG模型中HER2阳性乳腺癌细胞。这些研究结果明确支持了之前提到的二次打击模型:即阻断CD47-SIRPα轴和肿瘤细胞调节抗体对于有效地破坏肿瘤细胞都是必需的[13]。另外,体内Raji细胞的清除也可以通过将CV1与IgG4 Fc片段相结合来实现,但是这种蛋白质也可以造成相当的毒性,特别是它可以引起贫血。更先进的多特异性融合蛋白也被开发出来针对CD47-SIRPα检查点:一个对SIRPα亲和力最佳的单体与利妥昔单抗的结合区域CD20关联后,再与包括IgG4在内不同的Fc子类型融合,可观察到这个融合物增强了巨噬细胞对Raji Burkit淋巴瘤细胞的吞噬作用[9]。Piccione等进一步研究发现在一个体外小鼠巨噬细胞吞噬试验中,FcγR是吞噬作用发生的绝对必要条件[24]。
4.3.2 抗SIRPα抗体阻断CD47的替代疗法是开发并使用针对SIRPα的抗体,因为CD47表达广泛且其生物功能十分复杂,替代疗法也许可以克服抗原沉淀[26]及体内潜在毒性等难题。SIRPα抗体在体外条件下可有效增强效应中性粒细胞对曲妥珠单抗调节的乳腺癌细胞的ADCC[14]。针对SIRPα的另一种方法是使用CD47可溶性蛋白质[27]。
最后应该注意的是存在一些制剂已被证明对肿瘤细胞的生长起到了直接的作用。例如,在几个血液系统肿瘤的细胞膜上触发CD47可直接抑制肿瘤细胞生长或导致体外半胱天冬酶依赖或非依赖的凋亡性细胞死亡[28-29]。还有一种直接针对SIRPα的抗体可触发胞膜表面有SIRPα表达的急性髓系白血病细胞的非半胱天冬酶依赖的凋亡。这种抗体还可与各种化疗药物协同作用触发细胞死亡[30]。
4.4 抑制CD47-SIRPα轴与其他药物联用 4.4.1 抑制CD47-SIRPα轴与化疗药物联用研究发现,CD47的上调与肝细胞癌对索拉非尼、多柔比星和顺铂的耐药性增加有关,体外HCC细胞系中的CD47敲除后,其耐药性可以逆转[31-32]。此外,有证据表明化疗药物(尤其是环磷酰胺和紫杉醇)在同基因癌症模型中使用后不久如果加用CD47抗体,则可以协同促进抗肿瘤免疫及免疫记忆的形成[15]。但如果先使用CD47抗体再加用化疗药物,则会干扰免疫介导的癌症清除,因此给药时机很重要,这同时也证实了功能性免疫系统对CD47抗体的抗癌活性很重要。
4.4.2 抑制CD47-SIRPα轴与单克隆抗体联用我们目前面临的挑战是通过一些手段创建对肿瘤细胞的特异性治疗,例如将CD47-SIRPα轴抑制剂与癌症特异性单克隆抗体联合使用。大量研究已对这种方法进行了直接测试,例如在非霍奇金淋巴瘤的异种移植物小鼠模型中,抗CD47抗体与利妥昔单抗协同作用促进对人类淋巴瘤细胞的清除[33]。Weiskopf等使用高亲和性SIRPα CV1变异体证明了在NSG异种移植模型中这个拮抗剂可以强效协同多个治疗性抗体,包括利妥昔单抗,阿仑单抗,曲妥珠单抗,减少肿瘤负荷并且增加生存率[9]。值得我们注意的是,这与最小毒性有关。阻断CD47-SIRPα轴可能因此会成为一种增强单抗治疗效果的通用方法。
4.4.3 抑制CD47-SIRPα轴与免疫检查点抑制剂联用CD47-SIRPα轴是一个很有前途的天然免疫检查点。其他免疫检查点靶向抑制剂,如针对癌细胞膜上的PD-L1及激活的淋巴细胞表面的PD-1的抑制剂已经应用于临床上几类癌症的治疗[34-41]。有趣的是,在几种癌症细胞上发现CD47和PD-L1的表达都是通过重要的致癌转录因子MYC的活动来调节的,而这些关联明显可以帮助肿瘤细胞逃避天然免疫和获得性的抗肿瘤免疫应答[42]。最近,Sockolosky等对CD47和PD-L1的联合靶向进行了研究,结果证明联合用药确实有助于消除癌症[10]。这些检查点抑制剂的组合提供了广泛的研究前景,我们有必要了解这些个体和联合治疗的工作机制[43]。
5 总结及前景总的来说,近年来一系列报道已经确定了CD47-SIRPα轴可作为一个有前途的癌症天然免疫检查点。阻断CD47-SIRPα轴为目前肿瘤的治疗提供了一种治疗方向。目前多种CD47抑制剂已投入到临床研究或者仍处于临床前开发阶段。然而CD47-SIRPα轴抑制剂还存在一些悬而未决的问题,如CD47-SIRPα轴抑制剂诱导肿瘤细胞破坏的确切机制;安全性和有效性等。这将成为我们进一步研究的方向。相信随着新的抑制剂的开发以及技术的不断成熟,CD47-SIRPα轴作为癌症免疫治疗的一个重要突破点将成为未来快速延伸和发展的领域。
| [1] | Chen L, Files DB. Molecular mechanisms of T cells co-stimulation and co-inhibition[J]. Nat Rev Immunol, 2013, 13(4): 227–42. DOI:10.1038/nri3405 |
| [2] | Rizvi NA, Hellmann MD, Snyder A, et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348(6230): 124–8. DOI:10.1126/science.aaa1348 |
| [3] | Ratnikova NM, Lezhnin YN, Frolova EI, et al. CD47 receptor as a primary target for cancer therapy[J]. Mol Biol (Mosk), 2017, 51(2): 251–61. DOI:10.1134/S0026893317020133 |
| [4] | Matlung HL, Szilagyi K, Barclay NA, et al. The CD47-SIRPalpha signaling axis as an innate immune checkpoint in cancer[J]. Immunol Rev, 2017, 276(1): 145–64. DOI:10.1111/imr.2017.276.issue-1 |
| [5] | Oldenborg PA, Zheleznyak A, Fang YF, et al. Role of CD47 as a marker of self on red blood cells[J]. Science, 2000, 288(5473): 2051–4. DOI:10.1126/science.288.5473.2051 |
| [6] | Ishikawa-Sekigami T, Kaneko Y, Saito Y, et al. Enhanced phagocytosis of CD47-deficient red blood cells by splenic macrophages requires SHPS-1[J]. Biochem Biophys Res Commun, 2006, 343(4): 1197–200. DOI:10.1016/j.bbrc.2006.03.094 |
| [7] | Tsai RK, Discher DE. Inhibition of "self" engulfment through deactivation of myosin-Ⅱ at the phagocytic synapse between human cells[J]. J Cell Biol, 2008, 180(5): 989–1003. DOI:10.1083/jcb.200708043 |
| [8] | Jaiswal S, Jamieson CH, Pang WW, et al. CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis[J]. Cell, 2009, 138(2): 271–85. DOI:10.1016/j.cell.2009.05.046 |
| [9] | Weiskopf K, Ring AM, Ho CC, et al. Engineered SIRPalpha variants as immunotherapeutic adjuvants to anticancer antibodies[J]. Science, 2013, 341(6141): 88–91. DOI:10.1126/science.1238856 |
| [10] | Sockolosky JT, Dougan M, Ingram JR, et al. Durable antitumor responses to CD47 blockade require adaptive immune stimulation[J]. Proc Natl Acad Sci U S A, 2016, 113(19): E2646–54. DOI:10.1073/pnas.1604268113 |
| [11] | Chao MP, Jaiswal S, Weissman-Tsukamoto R, et al. Calreticulin is the dominant pro-phagocytic signal on multiple human cancers and is counterbalanced by CD47[J]. Sci Transl Med, 2010, 2(63): 63ra94. |
| [12] | Albanesi M, Mancardi DA, Jönsson F, et al. Neutrophils mediate antibody-induced antitumor effects in mice[J]. Blood, 2013, 122(18): 3160–4. DOI:10.1182/blood-2013-04-497446 |
| [13] | Zhao XW, van Beek EM, Schornagel K, et al. CD47-signal regulatory protein-alpha (SIRPalpha) interactions form a barrier for antibody-mediated tumor cell destruction[J]. Proc Natl Acad Sci U S A, 2011, 108(45): 18342–7. DOI:10.1073/pnas.1106550108 |
| [14] | Tseng D, Volkmer JP, Willingham SB, et al. Anti-CD47 antibody-mediated phagocytosis of cancer by macrophages primes an effective antitumor T-cell response[J]. Proc Natl Acad Sci U S A, 2013, 110(27): 11103–8. DOI:10.1073/pnas.1305569110 |
| [15] | Liu X, Pu Y, Cron K, et al. CD47 blockade triggers T cell-mediated destruction of immunogenic tumors[J]. Nat Med, 2015, 21(10): 1209–15. DOI:10.1038/nm.3931 |
| [16] | DiLillo DJ, Ravetch JV. Differential Fc-Receptor Engagement Drives an Anti-tumor Vaccinal Effect[J]. Cell, 2015, 161(5): 1035–45. DOI:10.1016/j.cell.2015.04.016 |
| [17] | DiLillo DJ, Ravetch JV. Fc-Receptor Interactions Regulate Both Cytotoxic and Immunomodulatory Therapeutic Antibody Effector Functions[J]. Cancer Immunol Res, 2015, 3(7): 704–13. DOI:10.1158/2326-6066.CIR-15-0120 |
| [18] | Goto H, Kojima Y, Matsuda K, et al. Efficacy of anti-CD47 antibody-mediated phagocytosis with macrophages against primary effusion lymphoma[J]. Eur J Cancer, 2014, 50(10): 1836–46. DOI:10.1016/j.ejca.2014.03.004 |
| [19] | Cioffi M, Trabulo S, Hidalgo M, et al. Inhibition of CD47 Effectively Targets Pancreatic Cancer Stem Cells via Dual Mechanisms[J]. Clin Cancer Res, 2015, 21(10): 2325–37. DOI:10.1158/1078-0432.CCR-14-1399 |
| [20] | Zhao XW, Matlung HL, Kuijpers TW, et al. On the mechanism of CD47 targeting in cancer[J]. Proc Natl Acad Sci U S A, 2012, 109(42): E2843, E2844–5. |
| [21] | Zhao XW, Kuijpers TW, van den Berg TK. Is targeting of CD47-SIRPalpha enough for treating hematopoietic malignancy?[J]. Blood, 2012, 119(18): 4333–5. DOI:10.1182/blood-2011-11-391367 |
| [22] | Liu J, Wang L, Zhao F, et al. Pre-Clinical Development of a Humanized Anti-CD47 Antibody with Anti-Cancer Therapeutic Potential[J]. PLoS One, 2015, 10(9): e0137345. DOI:10.1371/journal.pone.0137345 |
| [23] | Bruhns P, Jonsson F. Mouse and human FcR effector functions[J]. Immunol Rev, 2015, 268(1): 25–51. DOI:10.1111/imr.12350 |
| [24] | Piccione EC, Juarez S, Liu J, et al. A bispecific antibody targeting CD47 and CD20 selectively binds and eliminates dual antigen expressing lymphoma cells[J]. MAbs, 2015, 7(5): 946–56. DOI:10.1080/19420862.2015.1062192 |
| [25] | Theocharides AP, Jin L, Cheng PY, et al. Disruption of SIRPalpha signaling in macrophages eliminates human acute myeloid leukemia stem cells in xenografts[J]. J Exp Med, 2012, 209(10): 1883–99. DOI:10.1084/jem.20120502 |
| [26] | Piccione EC, Juarez S, Tseng S, et al. SIRPalpha-Antibody Fusion Proteins Selectively Bind and Eliminate Dual Antigen-Expressing Tumor Cells[J]. Clin Cancer Res, 2016, 22(20): 5109–19. DOI:10.1158/1078-0432.CCR-15-2503 |
| [27] | Ho CC, Guo N, Sockolosky JT, et al. "Velcro" engineering of high affinity CD47 ectodomain as signal regulatory protein alpha (SIRPalpha) antagonists that enhance antibody-dependent cellular phagocytosis[J]. J Biol Chem, 2015, 290(20): 12650–63. DOI:10.1074/jbc.M115.648220 |
| [28] | Martinez-Torres AC, Quiney C, Attout T, et al. CD47 agonist peptides induce programmed cell death in refractory chronic lymphocytic leukemia B cells via PLCgamma1 activation: evidence from mice and humans[J]. PLoS Med, 2015, 12(3): e1001796. DOI:10.1371/journal.pmed.1001796 |
| [29] | Kaur S, Elkahloun AG, Singh SP, et al. A function-blocking CD47 antibody suppresses stem cell and EGF signaling in triple-negative breast cancer[J]. Oncotarget, 2016, 7(9): 10133–52. |
| [30] | Irandoust M, Alvarez Zarate J, Hubeek I, et al. Engagement of SIRPalpha inhibits growth and induces programmed cell death in acute myeloid leukemia cells[J]. PLoS One, 2013, 8(1): e52143. DOI:10.1371/journal.pone.0052143 |
| [31] | Lo J, Lau EY, Ching RH, et al. Nuclear factor kappa B-mediated CD47 up-regulation promotes sorafenib resistance and its blockade synergizes the effect of sorafenib in hepatocellular carcinoma in mice[J]. Hepatology, 2015, 62(2): 534–45. DOI:10.1002/hep.v62.2 |
| [32] | Lee TK, Cheung VC, Lu P, et al. Blockade of CD47-mediated cathepsin S/protease-activated receptor 2 signaling provides a therapeutic target for hepatocellular carcinoma[J]. Hepatology, 2014, 60(1): 179–91. DOI:10.1002/hep.v60.1 |
| [33] | Chao MP, Alizadeh AA, Tang C, et al. Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate non-Hodgkin lymphoma[J]. Cell, 2010, 142(5): 699–713. DOI:10.1016/j.cell.2010.07.044 |
| [34] | Sharma P, Allison JP. The future of immune checkpoint therapy[J]. Science, 2015, 348(6230): 56–61. DOI:10.1126/science.aaa8172 |
| [35] | Eggermont AM, Chiarion-Sileni V, Grob JJ, et al. Adjuvant ipilimumab versus placebo after complete resection of high-risk stage Ⅲ melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2015, 16(5): 522–30. DOI:10.1016/S1470-2045(15)70122-1 |
| [36] | Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2015, 373(17): 1627–39. DOI:10.1056/NEJMoa1507643 |
| [37] | Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial[J]. Lancet, 2016, 387(10030): 1837–46. DOI:10.1016/S0140-6736(16)00587-0 |
| [38] | Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018–28. DOI:10.1056/NEJMoa1501824 |
| [39] | Motzer RJ, Escudier B, Mcdermott DF, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma[J]. N Engl J Med, 2015, 373(19): 1803–13. DOI:10.1056/NEJMoa1510665 |
| [40] | Rizvi NA, Mazières J, Planchard D, et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial[J]. Lancet Oncol, 2015, 16(3): 257–65. DOI:10.1016/S1470-2045(15)70054-9 |
| [41] | Weber JS, D'Angelo SP, Minor D, et al. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial[J]. Lancet Oncol, 2015, 16(4): 375–84. DOI:10.1016/S1470-2045(15)70076-8 |
| [42] | Casey SC, Tong L, Li Y, et al. MYC regulates the antitumor immune response through CD47 and PD-L1[J]. Science, 2016, 352(6282): 227–31. DOI:10.1126/science.aac9935 |
| [43] | Matlung HL, Szilagyi K, Kuijpers TW, et al. Immune checkpoint blockade: Which switches to hit and how much?[J]. Immunol Lett, 2016, 180: 73–4. DOI:10.1016/j.imlet.2016.08.014 |
 2018, Vol. 45
2018, Vol. 45


