文章信息
- 神经生长因子及受体与早期宫颈癌嗜神经侵袭的相关性
- Correlation of Nerve Growth Factor and Its Receptors Expression with Perineural Invasion in Early-stage Cervical Cancer
- 肿瘤防治研究, 2018, 45(10): 781-785
- Cancer Research on Prevention and Treatment, 2018, 45(10): 781-785
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0216
- 收稿日期: 2018-02-14
- 修回日期: 2018-04-14
嗜神经侵袭(perineural invasion, PNI)是指肿瘤细胞在神经纤维周围沿着神经或进入神经束膜内沿着束膜扩展的局部浸润转移现象,被认为是恶性肿瘤经典的四种(淋巴、血液、直接蔓延、种植)转移途径之外的第五种转移方式。PNI在多种恶性肿瘤如头颈[1]、胰腺[2]、胃肠道肿瘤[3]均有发生,而且被认为与肿瘤患者的不良预后密切相关。PNI现象发生的相关原因和机制是多方面的,目前认为PNI的发生可能与神经生长因子(nerve growth factor, NGF)和其受体有关,但是其相关分子机制尚不完全清楚。
目前的研究表明宫颈癌也存在嗜神经现象,宫颈癌PNI的发生与一些临床病理高危因素密切相关,而且预示着不良预后[4-7]。我们的前期研究也得到相同的结果[8]。但是,宫颈癌PNI的发生与NGF和受体是否关联,目前还没有确切的文献报道。本研究通过检测NGF及其受体酪氨酸激酶A(tropomyosin receptor kinase, TrkA)、神经营养素受体p75在宫颈癌组织中的表达水平,来探讨NGF及其受体与PNI发生的相关性。
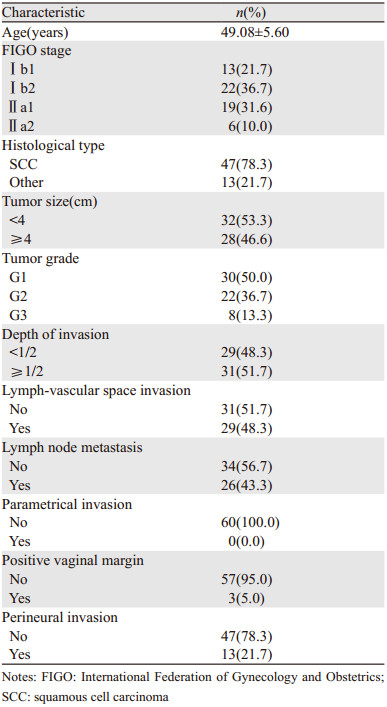
1 资料与方法 1.1 病例选择及一般资料选取2010年1月至2014年6月期间在广西医科大学附属肿瘤医院妇瘤科行手术治疗,且符合纳入标准的宫颈癌患者,从中随机抽取60例作为研究对象,所有患者的临床病理资料,见表 1。纳入的患者符合下列要求:(1)经病理学检查确诊为宫颈癌;(2)2009年国际妇产科联盟分期(International Federation of Gynecology and Obstetrics,FIGO)分期Ⅰb~Ⅱa2期;(3)行标准的根治性全子宫切除术+盆腔淋巴结清扫,加或不加腹主动脉旁淋巴结切除、双侧附件切除;(4)年龄20~70岁;(5)临床病理资料完整。
|
由两位经验丰富的病理科医师对纳入患者的病理切片进行重新阅片,复核术后临床病理资料,包括年龄、临床分期、病理类型、分化程度、肿瘤大小、间质浸润深度、淋巴脉管间隙浸润(lymph-vascular space invasion, LVSI)、淋巴结转移、宫旁浸润、切缘阳性,并且对石蜡标本重新切片,厚度3 μm,切取部位为宫颈和宫旁。
免疫组织化学染色:PNI采用鼠抗人S-100单克隆抗体(浓度为1:50);NGF及其受体采用兔抗人多克隆抗体NGF(浓度为1:200)、TrkA(浓度为1:200)和p75(浓度1:150)。所有的抗体、Max Vision两步法试剂盒、DAB显色试剂盒均购自福州迈新生物技术开发有限公司。操作步骤按试剂盒说明书进行。
PNI的评判:当发现宫颈癌细胞浸润神经外膜、神经束膜或神经内膜中的任意一层,或肿瘤细胞接近神经并包绕1/3以上的神经周径即判断为PNI阳性[9]。
NGF、TrkA、p75表达情况采用半定量和定量两种方法评估。半定量法即根据染色阳性细胞的百分比进行记分。阳性细胞定义为细胞膜或细胞质中出现棕黄色的颗粒,每张片随机取5个400×高倍镜视野,每个视野下计数100个肿瘤细胞,阳性细胞数0~5%为0分;> 5%~25%为1分;> 25%~50%为2分;> 50%为3分。2~3分为高表达;0~1分为低表达。定量分析法采用病理图像分析仪(Leica Dmrq 550,德国)计算免疫组织化学染色阳性的面积。每张片随机取10个100×倍镜视野,镜下计算每个视野里染色阳性面积的百分比,取其平均值。
1.3 统计学方法应用SPSS17.0软件进行统计分析,计量资料采用(x±s)表示,比较采用t检验,计数资料采用χ2检验,以P < 0.05为差异有统计学意义。
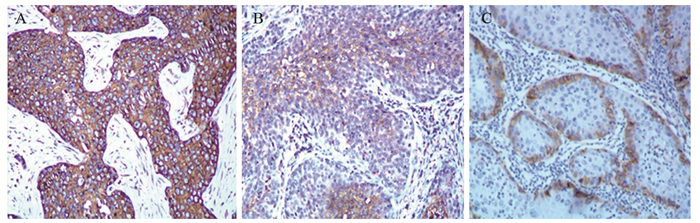
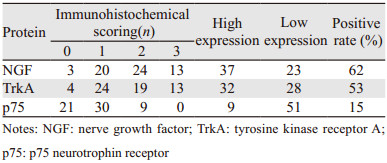
2 结果 2.1 NGF、TrkA和p75在宫颈癌中的表达情况纳入研究的60例患者中,PNI阳性13例(21.7%),PNI阴性47例(78.3%)。NGF、TrkA的阳性表达主要位于癌细胞的胞质和胞膜,见图 1A~1B,而p75的阳性表达主要位于癌巢的基底细胞见图 1C。60例标本中,NGF高表达37例(62%);TrkA高表达32例(53%);而p75高表达9例(15%),见表 2。
|
| A: NGF; B: TrkA; C: p75 图 1 免疫组织化学染色法检测宫颈癌组织中NGF、TrKA和p75的表达(×200) Figure 1 Expression of NGF, TrKA and p75 in cervical cancer tissues detected by immunohistochemical method (×200) |
|
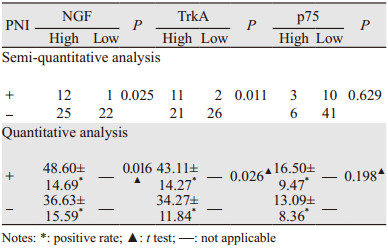
半定量分析显示,13例PNI阳性组中观察到12例(92%)NGF的高表达,而47例PNI阴性组只有25例(53%)高表达,差异有统计学意义(P=0.025);TrkA的高表达在PNI阳性组中有11例(85%),而在PNI阴性组有21例(45%),差异也有统计学意义(P=0.011);而p75的高表达在PNI阳性组中有3例(23%),在PNI阴性组中有6例(13%)差异无统计学意义(P=0.629),见表 3。
|
定量分析显示,NGF、TrkA在PNI阳性组中的阳性面积比与PNI阴性组中的阳性面积比比较,差异均有统计学意义(P=0.016, P=0.026);而p75在两组的表达情况差异无统计学意义(P=0.198),见表 3。
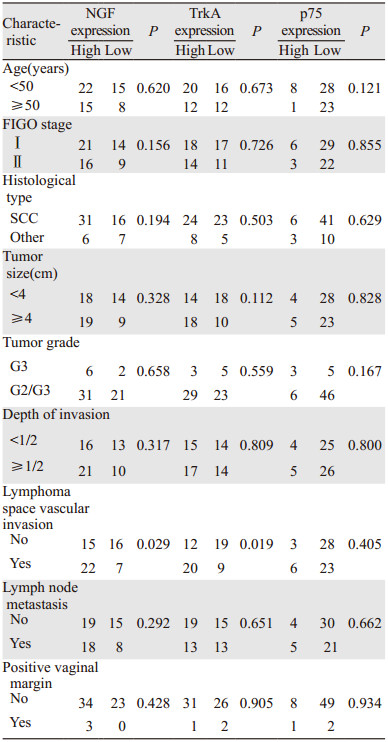
2.3 NGF、TrkA和p75的表达与临床病理因素的相关性NGF、TrkA的高表达与淋巴脉管间隙浸润有明显的关联性,差异有统计学意义(P=0.029和P=0.019),而与临床分期、病理类型、分化程度、肿瘤大小、手术切缘阳性无关,差异均无统计学意义(均P > 0.05);p75的表达与临床病理因素均无明显相关,差异无统计学意义(均P > 0.05),见表 4。因纳入的早期宫颈癌患者术后病理没有宫旁浸润的发生,故宫旁浸润没有纳入分析。
|
神经营养因子家族(neurotrophins, NTs)是一种蛋白质家族,包括NGF、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)、NT-3和NT-4/5,它们的主要作用是促进神经生长、分化、维持和引导。NGF是第一个被发现的,也是NTs家族中最原始的成员。NGF主要有两种膜表面受体,即高亲和力受体TrkA和低亲和力受体p75。目前认为,当NGF与TrkA结合时,激活信号通路PI3-Akt和Ras-MAP以促进神经元生长和存活。相反,当NGF结合p75,信号通路NF-κB和JNK-p53-Bax激活调节细胞凋亡[10]。
由于这两种受体具有不同的调节功能,因此了解NGF及其受体在肿瘤组织中的表达情况对分析其对肿瘤细胞的调节机制有重要意义。在目前的研究中,NGF和TrkA在大多数恶性肿瘤中主要表现为高表达,包括腺样囊性癌[11-12]、口腔鳞状细胞癌[13]、乳腺癌[14],胰腺癌[15]中。相比之下,p75主要被检测为较低的表达。本研究也得到相似的结果,发现阳性NGF和TrkA染色主要存在于宫颈癌细胞的细胞质和细胞膜中,高表达率为62%和53%,而p75染色结果主要表现为弱表达。因此推测,在大多数恶性肿瘤中,癌细胞的增殖、扩散活跃,这种微环境可能导致p75下调表达。但是也有一些肿瘤例外,如p75在恶性黑色素瘤中表现为高表达[16]。目前,需要进一步研究来证实NGF、TrkA和p75对肿瘤的调控机制。
由于NGF与受体的结合有助于神经元生长和存活,所以目前研究认为肿瘤PNI发生机制可能与NGF及受体相关。据报道,NGF与受体TrkA的过表达与腺样囊性癌的PNI发生有密切关系[11];在口腔癌中,NGF与受体TrkA的表达明显增加,提示NGF和TrkA与导致PNI的机制有关[13, 17];在胰腺癌中,NGF刺激的胰腺癌细胞的生长,依赖于表达水平和TrkA与p75受体的比值,TrkA表达水平较高的患者表现出更常见的PNI发生和较高的疼痛程度,而p75的结果则相反[18]。然而,在肝外胆管癌中,NGF表达与PNI无关[19]。我们推测,NGF及受体是否促进PNI的发生、发展可能与肿瘤的类型有关。
为了解NGF的表达是否与子宫颈癌的PNI相关,我们采用免疫组织化学的方法检测宫颈癌组织中NGF、受体TrkA和p75的表达,并分析其表达情况在PNI阳性组和阴性组的不同。为了提高研究结果的准确性,采用两种分析方法同时对结果进行评估:对染色结果进行了评分、计算染色阳性区域的面积比。结果表明,NGF和TrkA表达与PNI的存在密切相关,PNI阳性组中NGF及TrkA的阳性面积明显高于PNI阴性组,而p75的表达两组没有明显差别。基于这些结果,我们认为NGF和TrkA影响了宫颈癌PNI的发展。
此外,我们发现NGF、TrkA的高表达也与宫颈脉管内癌栓浸润(lymph-vascular space invasion, LVSI)的存在有关。LVSI是一种影响宫颈癌预后的高危病理因素。我们的前期研究和一些报道发现,LVSI与PNI的存在有关[7, 20-21]。无论是PNI还是LVSI的发生,其根本原因都是通过肿瘤细胞的增殖、侵袭和迁移来实现的。鉴于此,我们推测NGF/TrkA可能与宫颈癌中肿瘤细胞的恶性生物学行为有密切关系。Zhu等[22]报道,NGF-TrkA相互作用是刺激胰腺癌细胞生长并扩散的重要因素;Bapat等报道[23],阻断NGF信号可以降低胰腺癌细胞的PNI的潜在行为;Li等[24]报道,NGF通过WNT/β-catenin通路调节卵巢肿瘤细胞的迁移。本研究尚处于初级阶段,我们计划进一步研究以验证我们的推测。
总之,本研究中发现了NGF及其受体TrkA在宫颈癌中呈现高表达,p75呈低表达。NGF/TrkA免疫组织化学染色与PNI的存在呈强相关性,提示NGF和TrkA可能参与了促进PNI发生的相关机制。相反,未发现p75的表达与PNI和其他病理因素有关。对NGF/TrkA信号通路进一步研究有利于了解宫颈癌细胞的侵袭和迁移相关分子机制,可为临床上寻找控制宫颈癌细胞侵袭、发展的新靶点,提供一定的理论依据。
| [1] | Ju J, Li Y, Chai J, et al. The role of perineural invasion on head and neck adenoid cystic carcinoma prognosis: a systematic review and meta-analysis[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2016, 122(6): 691–701. DOI:10.1016/j.oooo.2016.08.008 |
| [2] | Hirai I, Kimura W, Ozawa K, et al. Perineural invasion in pancreatic cancer[J]. Pancreas, 2002, 24(1): 15–25. DOI:10.1097/00006676-200201000-00003 |
| [3] | Knijn N, Mogk SC, Teerenstra S, et al. Perineural invasion is a strong prognostic factor in colorectal cancer: a systematic review[J]. Am J Surg Pathol, 2016, 40(1): 103–12. DOI:10.1097/PAS.0000000000000518 |
| [4] | Cui L, Shi Y, Zhang GN. Perineural invasion as a prognostic factor for cervical cancer: a systematic review and meta-analysis[J]. Arch Gynecol Obstet, 2015, 292(1): 13–9. DOI:10.1007/s00404-015-3627-z |
| [5] | Horn LC, Meinel A, Fischer U, et al. Perineural invasion in carcinoma of the cervix uteri--prognostic impact[J]. J Cancer Res Clin Oncol, 2010, 136(10): 1557–62. DOI:10.1007/s00432-010-0813-z |
| [6] | Tian N, Kuerban G. The significance of perineural invasion as a prognostic factor in cervical cancer patients of different ethnicities[J]. Int J Clin Exp Med, 2016, 9(10): 19634–43. |
| [7] | 张国楠, 阳燕, 朱熠, 等. 嗜神经侵袭对早期子宫颈癌患者预后的影响[J]. 中华妇产科杂志, 2015(9): 673–8. [ Zhang GN, Yang Y, Zhu Y, et al. Evidence of perineural invasion on early-stage cervical cancer and prognostic significance[J]. Zhonghua Fu Chan Ke Za Zhi, 2015(9): 673–8. DOI:10.3760/cma.j.issn.0529-567x.2015.09.007 ] |
| [8] | 龙颖, 姚德生, 韦有生. 嗜神经侵袭与早期宫颈癌预后相关性的Meta分析[J]. 中国循证医学杂志, 2017, 17(3): 334–9. [ Long Y, Yao DS, Wei YS. The prognostic significance of perineural invasion in early-stage cervical: a meta-analysis[J]. Zhongguo Xun Zheng Yi Xue Za Zhi, 2017, 17(3): 334–9. ] |
| [9] | Liebig C, Ayala G, Wilks JA, et al. Perineural invasion in cancer: a review of the literature[J]. Cancer, 2009, 115(15): 3379–91. DOI:10.1002/cncr.v115:15 |
| [10] | Molloy NH, Read DE, Gorman AM. Nerve growth factor in cancer cell death and survival[J]. Cancers(Basel), 2011, 3(1): 510–30. |
| [11] | Kobayashi K, Ando M, Saito Y, et al. Nerve Growth Factor Signals as Possible Pathogenic Biomarkers for Perineural Invasion in Adenoid Cystic Carcinoma[J]. Otolaryngol Head Neck Surg, 2015, 153(2): 218–24. DOI:10.1177/0194599815584762 |
| [12] | Wang L, Sun M, Jiang Y, et al. Nerve growth factor and tyrosine kinase A in human salivary adenoid cystic carcinoma: expression patterns and effects on in vitro invasive behavior[J]. J Oral Maxillofac Surg, 2006, 64(4): 636–41. DOI:10.1016/j.joms.2005.12.011 |
| [13] | Kolokythas A, Cox DP, Dekker N, et al. Nerve growth factor and tyrosine kinase A receptor in oral squamous cell carcinoma: is there an association with perineural invasion?[J]. J Oral Maxillofac Surg, 2010, 68(6): 1290–5. DOI:10.1016/j.joms.2010.01.006 |
| [14] | Davidson B, Reich R, Lazarovici P, et al. Altered expression and activation of the nerve growth factor receptors TrkA and p75 provide the first evidence of tumor progression to effusion in breast carcinoma[J]. Breast Cancer Res Treat, 2004, 83(2): 119–28. DOI:10.1023/B:BREA.0000010704.17479.8a |
| [15] | Ma J, Jiang Y, Jiang Y, et al. Expression of nerve growth factor and tyrosine kinase receptor A and correlation with perineural invasion in pancreatic cancer[J]. J Gastroenterol Hepatol, 2008, 23(12): 1852–9. DOI:10.1111/jgh.2008.23.issue-12 |
| [16] | Chan MM, Tahan SR. Low-affinity nerve growth factor receptor (P75 NGFR) as a marker of perineural invasion in malignant melanomas[J]. J Cutan Pathol, 2010, 37(3): 336–43. DOI:10.1111/cup.2010.37.issue-3 |
| [17] | Yu EH, Lui MT, Tu HF, et al. Oral carcinoma with perineural invasion has higher nerve growth factor expression and worse prognosis[J]. Oral Dis, 2014, 20(3): 268–74. DOI:10.1111/odi.12101 |
| [18] | Dang C, Zhang Y, Ma Q, et al. Expression of nerve growth factor receptors is correlated with progression and prognosis of human pancreatic cancer[J]. J Gastroenterol Hepatol, 2006, 21(5): 850–8. DOI:10.1111/jgh.2006.21.issue-5 |
| [19] | Urabe K, Murakami Y, Kondo N, et al. Nerve Growth Factor Expression Is Not Associated with Perineural Invasion in Extrahepatic Cholangiocarcinoma[J]. Dig Dis Sci, 2016, 61(3): 774–84. DOI:10.1007/s10620-015-3953-9 |
| [20] | 龙颖, 姚德生, 韦有生. 嗜神经侵袭与早期宫颈癌临床病理特征及预后的关系[J]. 临床肿瘤学杂志, 2017, 22(8): 712–7. [ Long Y, Yao DS, Wei YS. Clinicopathological and prognostic significance of perineural invasion in early-stage cervical cancer[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2017, 22(8): 712–7. DOI:10.3969/j.issn.1009-0460.2017.08.010 ] |
| [21] | Ozan H, Ozuysal S, Ediz B. Perineural invasion in early-stage cervical carcinoma[J]. Eur J Gynaecol Oncol, 2009, 30(4): 379–83. |
| [22] | Zhu ZW, Friess H, Wang L, et al. Nerve growth factor exerts differential effects on the growth of human pancreatic cancer cells[J]. Clin Cancer Res, 2001, 7(1): 105–12. |
| [23] | Bapat AA, Mumoz RM, Von Hoff DD, et al. Blocking nerve growth factor signaling reduces the neural invasion potential of pancreatic cancer cells[J]. PLoS One, 2016, 11(10): e0165586. DOI:10.1371/journal.pone.0165586 |
| [24] | Li B, Cai S, Zhao Y, et al. Nerve growth factor modulates the tumor cells migration in ovarian cancer through the WNT/β-catenin pathway[J]. Oncotarget, 2016, 7(49): 81026–48. |
 2018, Vol. 45
2018, Vol. 45


