文章信息
- 荧光原位杂交检测乳腺癌HER2(++)扩增状态及其与临床病理的相关性
- HER2 (++) Amplification in Breast Cancer Detected by Fluorescence in Situ Hybridization and Its Correlation with Clinicopathological Features
- 肿瘤防治研究, 2018, 45(9): 652-655
- Cancer Research on Prevention and Treatment, 2018, 45(9): 652-655
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0179
- 收稿日期: 2018-02-05
- 修回日期: 2018-05-23
临床研究[1]显示,HER2蛋白过表达和基因扩增的乳腺癌患者具有生存期较短、肿瘤负荷大、增殖指数高、激素受体阴性比例高、淋巴结转移率高、以及对放化疗和内分泌治疗较高耐药性等临床及病理特点。赫赛汀(Herceptin)是一种针对HER2的高度人源化的单克隆抗体,对于HER2蛋白过表达或基因扩增的患者,赫赛汀在术前新辅助化疗、术后辅助化疗、甚至局部晚期乳腺癌和(或)发生远处转移的病例中均能一定程度地提高治疗有效率[2]。因此,HER2蛋白过表达或者基因扩增不仅是乳腺癌患者的独立预后因素之一,同时也是分子靶向治疗的重要指标。明确HER2状态对于判断预后及指导治疗的意义不言而喻。
目前,检测HER2表达的方法主要有免疫组织化学(IHC)、荧光原位杂交(FISH)、比色原位杂交(CISH)、银染原位杂交(SISH)和实时荧光定量RT-PCR法等,其中临床最常用的是IHC法和FISH法。IHC法主要检测HER2的蛋白表达水平,FISH法主要检测HER2的基因扩增水平,NCCN乳腺癌诊疗指南提出:FISH法是目前检测HR2基因扩增的金标准[3]。根据中国乳腺癌HER2检测指南(2014版)所建议的方法规定:IHC检测HER2(+++)即可认定为HER2阳性,而对于IHC检测HER2(++)的标本有必要进一步行FISH检测以确认有无HER2基因扩增。报道[4-5]显示,FISH检测HER2(++)阳性率介于8%~27%之间,本研究通过回顾性研究对比分析两种检测方式的一致性以及扩增状况的HER2基因与临床病理相关因素之间关系,探讨分析影响FISH检测HER2(++)扩增的因素。
1 资料与方法 1.1 一般资料选取新疆医科大学附属肿瘤医院2013年l月至2015年12月收检的乳腺癌标本,HER2检测来源均为手术或粗针穿刺的石蜡标本。入组标准:(1)可获得足够病理标本的Ⅰ~Ⅳ期乳腺癌患者;(2)如行乳腺癌根治术、改良根治术或保乳手术,腋窝淋巴结清扫数目应超过10个;(3)IHC法检测HER2(++)患者。排除标准:(1)已行新辅助化疗、放疗及内分泌治疗的;(2)腋窝淋巴结清扫数目不足10个;(3)IHC检测HER2 0、+、+++的患者。共纳入325例,均为女性。收集患者的临床和病理资料,包括雌孕激素受体状态、ki67、组织学分级、肿瘤直径、肿瘤个数、有无淋巴转移、有无脉管瘤栓、病理类型、月经状态、临床分期、年龄、P53表达状况共12项以及HER2的IHC及FISH检测结果。所有的IHC和FISH结果均参照2016版ASCO/CAP HER2检测指南统一检测和判读[6]。
1.2 试剂和方法IHC法:将组织用13%中性福尔马林液35℃固定2 h,酒精梯度脱水(酒精浓度由低到高)、组织透明、浸蜡、包埋、制片,先后用二甲苯、酒精(酒精浓度由高到低)脱蜡,入水洗片,PBS缓冲液(pH7.4)冲洗3次,每次3 min;微波修复抗原,加入过氧化酶阻断溶液(试剂A),室温孵育15 min,PBS缓冲液冲洗3 min×3次;加入非免疫性动物血清(试剂B),室温孵育10 min,加入一抗,室温孵育60 min,PBS缓冲液冲洗5 min×3次,加入链霉菌抗生素-过氧化酶溶液(试剂D),室温孵育10 min;PBS缓冲液冲洗3 min×3次,切片加新配二氨基联苯(DAB)显色溶液,显微镜下观察3~10 min,阳性显色为棕黄色,自来水冲洗,苏木精对比染色,0.1%氨水或PBS缓冲液冲洗返蓝,DAB溶液显色,梯度酒精脱水干燥,二甲苯透明,中性树胶固封。
IHC结果判读:按照2017年ASCO/CAP最新评分标准:IHC(+++):> 10%浸润癌细胞呈现完整、均匀的细胞膜强染色;IHC(++):> 10%浸润癌细胞呈现不完整和(或)弱至中等强度细胞膜染色或≤10%浸润癌细胞呈现强而完整的细胞膜染色;IHC(+):> 10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;IHC(0):无染色或≤10%浸润癌细胞呈现不完整的、微弱的细胞膜染色。
FISH:组织切片,65℃过夜烘烤,二甲苯室温脱蜡2次,每次10 min,随后浸入100%乙醇中5 min,复水后50℃下30%酸性亚硫酸钠处理20~30 min,氯化钠、柠檬酸钠水溶液(2×SSC)漂洗2次,每次5 min,浸泡在蛋白酶K工作液中37℃下孵育7~8 min,2×SSC溶液漂洗后依次经-20℃预冷的70%、85%、100%乙醇各2 min脱水,丙酮浸泡2 min,干燥,加盖玻片至56℃ 3 min;将玻片在变性溶液中浸泡5 min,预冷的70%、85%、100%乙醇中各3 min梯度脱水,45℃~50℃预热2~5 min后与探针在42℃保温箱中过夜杂交;玻片用甲醛胺洗涤,暗处自然干燥后经二眯基苯基吲哚荧光染料(DAPI)复染,暗处放置20~30 min后荧光显微镜下选用合适的滤玻片观察。
FISH结果判读:(1)阳性结果:单探针平均HER2拷贝数≥6.0信号因子/细胞,双探针HER2/CEP17≥2.0;且平均HER2基因拷贝数≥4.0信号/细胞;(2)阴性结果:单探针平均HER2基因拷贝数 < 4.0信号因子/细胞,双探针HER2/CEP17比值< 2.0,且平均HER2基因拷贝数 < 4.0信号因子/细胞。
1.3 统计学方法采用SPSS19.0软件进行统计学分析,各项指标首先进行单因素分析(Pearson χ2或Fisher’s检验),对有统计学意义的指标再行多因素Logistic回归分析。检验水准α=0.05。
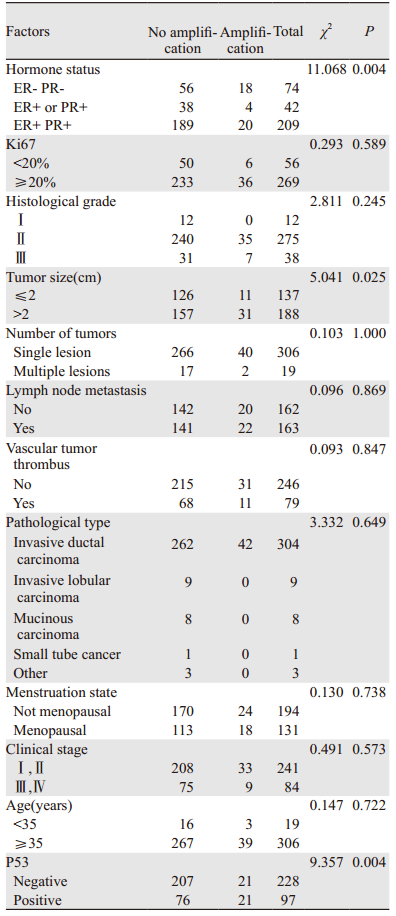
2 结果 2.1 单因素分析FISH和IHC检测HER2状态结果对比:实际统计病例325例,IHC的结果均为HER2(++),FISH结果提示HER2扩增率为12.9%(42/325)。对12项临床和病理指标进行单因素分析显示:HER2扩增状态与激素状态、肿瘤直径、P53显著相关,而与ki67表达、组织学分级、肿瘤个数、有无淋巴结转移、有无脉管瘤栓、病理类型、绝经状态、临床分期、年龄等因素均无相关性(P > 0.05),见表 1。
|
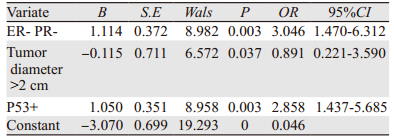
多因素Logistics回归分析系显示:雌孕激素阴性、肿瘤直径 > 2 cm、P53阳性是预测FISH检测HER2(++)扩增的独立因素,见表 2。
早在20世纪初期,临床诊治过程中公认的乳腺癌预后的指标有TNM分期、腋窝淋巴结转移情况、组织学类型以及激素受体表达状况。但是单纯通过上述指标尚无法反映所有乳腺癌的预后情况。例如,虽然大部分淋巴结阴性患者预后优于淋巴结阳性患者,但是仍有大约1/3腋窝淋巴结阴性患者会发生远处转移,而且预后更差。因此,寻找新的生物学预后指标成为热门。直到1987年,Salmon等[7]首次报道伴有HER2基因扩增和过表达的淋巴结转移的乳腺癌患者不仅复发和生存时间明显缩短,而且HER2阳性的乳腺癌患者平均生存期也比同期HER2阴性的乳腺癌患者短3~5年左右。因此,准确判断HER2状态,在乳腺癌治疗中有着非常重要的作用。
本研究主要选取本院收治的原发乳腺癌确诊病例,采用国际上通用的IHC及FISH两种方式分别检测,免疫组织化学法测定HER2均为(++),同时又进行二次FISH检测,结果显示扩增率仅有12.9%(42/325),扩增率低于文献[8]报道。但这也从一定程度上说明,临床上存在较多免疫组织化学测定HER2(++)可以不必要进行FISH检测,避免浪费大量的医疗资源,加重医疗成本。但如何将这部分为IHC检测HER2(++)同时FISH检测扩增的病例挑选出来,尤为重要。
本回顾性研究通过单因素分析发现,HER2基因扩增状态与激素状态、肿瘤直径、P53显著相关,同时多因素Logistic回归分析也发现雌孕激素阴性、肿瘤直径 > 2 cm、P53阳性是预测FISH检测IHC HER2(++)扩增的独立危险因素。该结论与相关文献[5, 9]报道一致,但国内有研究[10]显示HER2基因扩增与肿瘤大小无关,与本研究的结论不一致。Bansal等[11]研究显示,HER2与PR、ER间存在负相关的关系,与本研究的结论一致。方宇等[12-13]还报道HER2基因扩增还可能与组织学分级、淋巴结阳性、绝经后状态等因素相关,但本研究并未发现,也可能与样本量过小有关,需要扩大样本含量深入研究。巩雷等[14]研究提示p53蛋白过表达与肿瘤浸润性生长及预后不良相关,与HER2表达有一定的相关性,在患者预后的判定中起着重要作用,与本研究结论一致。
综上所述,结合实际情况,包括费用、仪器等限制,HER2状态的检测可采用IHC进行筛查,但IHC评分为(++)时,FISH仍是目前检测HER2有无扩增的最佳方法,在进行FISH检测病例筛选时,上述研究指标具有一定的参考价值,可以帮助预测HER2有无扩增,从而提高FISH检测的准确性,下一步的研究可以建立相关风险预测模型,对一些没有扩增的病例可以避免检测从而降低医疗成本。由于受到多方面条件限制,中国大陆地区仍没有相对客观的HER2扩增率统计,相信通过此方面的深入研究,对乳腺癌患者HER2状态的准确判断将会使得乳腺癌治疗的有效性大大提升。
| [1] | Jørgensen JT, Nielsen KV, Ejlertsen B. Pharmacodiagnostics and targeted therapies - a rational approach for individualizing medical anticancer therapy in breast cancer[J]. Oncologist, 2007, 12(4): 397–405. DOI:10.1634/theoncologist.12-4-397 |
| [2] | Hofmann M, Stoss O, Gaiser T, et al. Central HER2 IHC and FISH analysis in a trasluzumab (Herceptin)phase Ⅱ monotherapy study:assessment of test sensitivity and impact of chromosome 17 polysomy[J]. J Clin Pathol, 2008, 61(1): 89–94. |
| [3] | Cuadros M, Villegas R. Systematic review of HER2 breast cancer testing[J]. Appl Immunohistochem Mol Morphol, 2009, 17(1): 1–7. DOI:10.1097/PAI.0b013e318169fc1c |
| [4] | Fan YS, Casas CE, Peng J, et al. HER2 FISH classification of equivocal HER2 IHC breast cancers with use of the 2013 ASCO/CAP practice guideline[J]. Breast Cancer Res Treat, 2016, 155(3): 457–62. DOI:10.1007/s10549-016-3717-z |
| [5] | Zhang H, Ren G, Wang X, et al. HER-2 gene amplification by fluorescence in situ hybridization (FISH) compared with immunohistochemistry(IHC) in breast cancer: a study of 528 equivocal cases[J]. Breast Cancer Res Treat, 2012, 134(2): 743–9. DOI:10.1007/s10549-012-2101-x |
| [6] | Shah MV, Wiktor AE, Meyer RG, et al. Change in Pattern of HER2 Fluorescent in Situ Hybridization (FISH) results in breast cancers submitted for FISH testing: experience of a reference laboratory using us food and drug administration criteria and American Society of Clinical Oncology and College of American Pathologists Guidelines[J]. J Clin Oncol, 2016, 34(29): 3502–10. DOI:10.1200/JCO.2015.61.8983 |
| [7] | Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the Her-2/neu oncogene[J]. Science, 1987, 235(4785): 177–82. DOI:10.1126/science.3798106 |
| [8] | Payandeh M, Sadeghi M, Sadeghi E, et al. Is there any Concordance between of IHC with FISH in HER2-positive breast cancer patients?[J]. Int J Hematol Oncol Stem Cell Res, 2017, 11(1): 43–8. |
| [9] | 李慧慧, 马飞, 曾瑄, 等. 乳腺癌HER-2的表达与临床病理特征的关系[J]. 中华医学杂志, 2011, 91(2): 76–80. [ Li HH, Ma F, Zeng X, et al. Comparison of fluorescence in situ hybridization and immunohistochemistry assessment for Her-2 status in breast cancer and its relationship to clinicopathological characteristics[J]. Zhonghua Yi Xue Za Zhi, 2011, 91(2): 76–80. DOI:10.3760/cma.j.issn.0376-2491.2011.02.003 ] |
| [10] | 朱萌, 张宁. FISH和IHC法检测乳腺癌HER2基因一致性及其临床意义[J]. 宁夏医科大学学报, 2013, 35(9): 984–6. [ Zhu M, Zhang N. Consistency of HER2 gene detection in breast cancer using FISH and IHC methods and its clinical significance[J]. Ningxia Yi Ke Da Xue Xue Bao, 2013, 35(9): 984–6. ] |
| [11] | Bansal C, Sharma A, Pujani M, et al. Correlation of Hormone Receptor and Human Epidermal Growth Factor Receptor-2/neu Expression in Breast Cancer with Various Clinicopathologic Factors[J]. Indian J Med Paediatr Oncol, 2017, 38(4): 483–9. DOI:10.4103/ijmpo.ijmpo_98_16 |
| [12] | 方宇, 曾思恩, 肖胜军, 等. 荧光原位杂交对乳腺癌HER2基因的检测及临床应用[J]. 重庆医学, 2011, 40(5): 460–3. [ Fang Y, Zeng SE, Xiao SJ, et al. Detection of HER2 gene by fluorescence in situ hybridization and the clinical application in breast cancer[J]. Chongqing Yi Xue, 2011, 40(5): 460–3. DOI:10.3969/j.issn.1671-8348.2011.05.019 ] |
| [13] | 王鸿雁, 张学斌, 蒋伊娜, 等. 乳腺癌HER2基因扩增的临床病理意义[J]. 肿瘤防治研究, 2010, 37(11): 1264–8. [ Wang HX, Zhang XB, Jiang YN, et al. HER2 amplication in breast cancer and its dinicopathological implications[J]. Zhong Liu Fang Zhi Yan Jiu, 2010, 37(11): 1264–8. DOI:10.3971/j.issn.1000-8578.2010.11.014 ] |
| [14] | 巩雷, 陈萍, 程薇, 等. 荧光原位杂交(FISH)检测乳腺癌中HER-2基因状态与p53、Ki-67、TOPOⅡ表达的相关性[J]. 现代肿瘤医学, 2016, 24(21): 3382–6. [ Gong L, Chen P, Cheng W, et al. HER-2 gene status and its correlation with expression of p53, Ki-67, TOPOⅡ in breast cancer[J]. Xian Dai Zhong Liu Yi Xue, 2016, 24(21): 3382–6. DOI:10.3969/j.issn.1672-4992.2016.21.010 ] |
 2018, Vol. 45
2018, Vol. 45