文章信息
- miR-1269a调控HOXD10基因抑制胆管癌细胞侵袭的作用及其机制
- Role and Mechanism of miR-1269a on Targeted Regulation of HOXD10 in Invasion of Cholangiocarcinoma Cells
- 肿瘤防治研究, 2018, 45(11): 894-899
- Cancer Research on Prevention and Treatment, 2018, 45(11): 894-899
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0175
- 收稿日期: 2018-02-05
- 修回日期: 2018-08-27
2. 710038 西安, 第四军医大学肿瘤研究所;
3. 471003 洛阳, 河南科技大学第一附属医院病理科;
4. 710062 西安, 西安交通大学第一附属医院肿瘤内科
2. Cancer Institute of Fourth Military Medical University, Xi'an 710038, China;
3. Department of Pathology, First Affiliated Hospital of He'nan Science and Technology University, Luoyang 471003, China;
4. Department of Medical Oncology, First Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710062, China
胆管癌(cholangiocarcinoma)是发病率相对较低而死亡率甚高的一类恶性肿瘤, 占全部消化系统恶性肿瘤的3%, 总体5年生存率低于5%[1]。复发和转移是胆管癌患者死亡的重要原因, 即使行根治性切除术后仍有约60%的患者最终发生复发、转移[2]。因此, 深入理解胆管癌侵袭、转移的分子机制是寻找有效治疗方法的前提。
我们的前期研究发现, HOXD10(Homeobox D10)基因下调与胆管癌进展密切相关, 然而其机制仍不清楚[3]。因甲基化修饰是基因表达失活的重要调控机制[4], 我们在人胆管癌组织标本中检测了HOXD10基因启动子的甲基化状态, 结果发现HOXD10的甲基化修饰与蛋白表达并非完全对应, 提示有其他机制参与HOXD10的表达调控。
MicroRNAs是一类进化上保守的非编码小分子RNA, 可通过与靶基因mRNA的3’UTRs区域结合抑制靶基因的表达[5]。一个microRNA可以调控众多靶基因的活性, 其功能具有显著的组织及细胞特异性[6]。既往文献报道若干microRNA可调控HOXD10基因的表达[7-10], 然而在胆管癌中Mir-1269a与HOXD10基因的调控关系尚不清楚。本研究拟探讨其中的机制, 以证实miR-1269a/HOXD10在胆管癌的侵袭中的作用。
1 资料与方法 1.1 临床资料收集河南科技大学第一附属医院2011年3月—2014年5月手术切除并经病理证实的胆管细胞癌标本24例[11]。切除肿瘤区域和癌旁组织标本(距病灶2 cm), 置于液氮中快速冷冻, -80℃冰箱保存。本研究经河南科技大学第一附属医院伦理委员会批准, 所有患者签署知情同意书。依据第7版AJCC分期标准进行临床分期。
1.2 细胞培养人胆管癌RBE细胞购自上海拜力生物科技有限公司, 人胆管癌HCCC9810细胞购自武汉博士德生物工程有限公司。人胆管癌QBC939、Mz-CHA-1细胞由厦门大学生命科学院俞春东教授惠赠。人胆管癌RBE、HCCC9810、QBC939、Mz-CHA-1细胞均培养于含10%胎牛血清(美国Invitrogen公司)和含1%青霉素、链霉素的RPMI 1640培养液(美国Invitrogen公司)中, 将培养瓶置于培养箱(37%、5%CO2)中培养, 待细胞长至70%~80%后用胰蛋白酶消化后传代。
1.3 细胞转染及分组转染前1天将细胞接种于6孔板内, 待细胞密度达80%, 采用Lipofectamine 2000(美国Invitrogen公司)转染试剂盒将miR-1269a模拟物(miR-1269a mimic转染组)及其阴性对照(negative control, NC)(美国Applied Biosystems公司)转染至Mz-CHA-1、RBE细胞中, 48 h后胰蛋白酶消化收集细胞用于后续实验。采用同样的方法将Mir-1269a抑制剂(miR-1269a inhibitor转染组)及其阴性对照载体(anti-negative control, anti-NC)(美国Applied Biosystems公司)转染至HCCC9810、QBC939细胞中, 48 h后胰蛋白酶消化收集细胞用于后续实验。
1.4 实时荧光定量PCR(real-time PCR)RBE、HCCC9810、QBC939、Mz-CHA-1细胞转染48 h后, TRIzol(美国Thermo公司)法提取总RNA, 以A260/A280进行总RNA质控。按照TAKARA反转录试剂盒(大连宝生物工程有限公司)说明书进行miR-10a、miR-10b、miR-224、miR-23a、miR-1269a、miR-1269b和U6(内参)反转录合成cDNA。上述检测的microRNA和U6引物购自广州锐博公司。采用One Step SYBR@PrimeScriptTM RT-PCR Kit在7 300 real-time PCR System仪器上按照说明书进行real-time PCR操作。基因的相对表达量采用2-ΔΔCt表示, 样品中目的基因HOXD10的表达以GAPDH为内参, HOXD10引物序列参照本课题组已发表的文献[3]。
1.5 Western blot检测RBE、HCCC9810、QBC939、Mz-CHA-1细胞转染48 h后, 收集细胞并加入蛋白裂解液(碧云天生物技术有限公司), 室温裂解30 min后以12 000 r/min离心10 min, BCA法测定上清液中蛋白浓度, 向每组蛋白样品中加入上样缓冲液, 沸水加热5 min。每孔加入上样缓冲液20 μl, SDS-聚丙烯酰胺凝胶电泳分离蛋白, 湿转法将蛋白转移至PVDF膜, 5%脱脂奶粉室温封闭2 h后用HOXD10(美国Abgent公司)1:300稀释及β-actin一抗(美国Abcam公司)1:500稀释, 4℃孵育过夜。二抗(美国Santa Cruz公司)室温孵育1 h, ECL化学发光显色液(美国Pierce公司)进行显色, 并采用凝胶成像设备进行结果观察。
1.6 双荧光素酶报告基因实验使用工具细胞HEK-293T细胞进行实验。运用PGL6质粒(美国Promega公司)分别构建野生型及突变型HOXD10-3’非翻译区(3’UTR)的报告基因质粒(PGL6-HOXD10 WT及PGL6-HOXD10 mut), 将报告基因质粒、pRL-TK质粒、miR-1269a mimic及其阴性对照质粒(PGL6-NE)转染人Mz-CHA-1、RBE细胞中; 采用同样的方法将报告基因质粒、pRL-TK质粒、miR-1269a inhibitor及其阴性对照质粒(PGL6-anti NE)转染至HCCC9810、QBC939细胞中, 48 h后按照双荧光素酶(美国Promega公司)检测说明书进行实验。根据萤火虫荧光强度/海肾荧光强度比值来反映不同处理组的相对荧光强度。
1.7 Transwell实验实验分组情况同1.3。Transwell侵袭小室(美国Corning公司)上室加入无血清培养液转染48 h后的细胞制成的单细胞悬液, 计数后每室按30 000个细胞每100 μl接种。下层小室内加入700 μl含10%胎牛血清的RPMI 1640培养液, 培养24 h后吸去上室培养液, 使用1×PBS洗3遍, 每次5 min, 再用4%多聚甲醛固定细胞20 min后, 1×PBS洗3遍, 每次5 min, 使用0.1%结晶紫溶液染色15 min。倒置显微镜下采用10倍物镜观察, 随机选取3个不同视野计数。
1.8 划痕实验实验分组情况同1.3。2×106个/孔细胞接种于6孔板中培养, 用10 μl无菌枪头在6孔板底部轻划一条力度和角度一致、粗细均匀的直线(每组设3个重复, 每组实验重复3次)。分别于0、48 h在倒置相差显微镜下观察同一视野划痕的宽度并拍照。应用AxioVision software version 4.7量化划痕愈合情况(未愈合区域面积/对照划痕区域面积)。每组实验重复3次。
1.9 统计学方法采用SPSS21.0版软件进行统计学处理。数据采用(x±s)表示, 多组间比较采用单因素方差分析, 两组间的比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 TargetScan和miRNA.org预测调控HOXD10基因表达的miRNA为探讨在胆管癌中miRNA失调与HOXD10表达下调的关系, 首先采用生物信息学软件TargetScan和miRNA target prediction algorithms对可能调控HOXD10表达的miRNA进行预测, 结果显示HOXD10的3’UTR包含327个miRNA的连接位点, 两种软件共同预测的miRNA有23个, 见图 1。

|
| 图 1 生物信息学软件预测调控HOXD10表达的miRNA Figure 1 miRNAs which regulated HOXD10 expression predicted by TargetScan and microRNA target prediction algorithms |
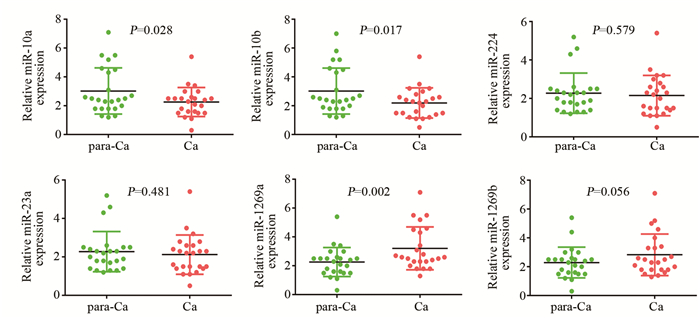
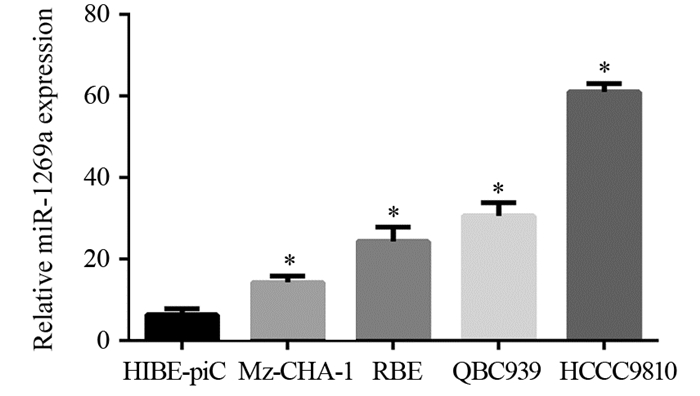
在上述预测的23个miRNAs中, 既往文献[7-10]报道有6个可调控HOXD10基因的表达, 分别为:miR-10a、miR-10b、miR-224、miR-23a、miR-1269a、miR-1269b, 且与肿瘤的侵袭、转移能力相关。因此, 我们在胆管癌组织及癌旁组织中分别检测这6个miRNA的表达情况, 结果发现, miR-10a、miR-10b、miR-1269a在胆管癌及癌旁组织中的表达差异具有统计学意义, miR-10a、miR-10b在胆管癌组织中表达低于癌旁组织, miR-1269a在胆管癌组织中的表达显著高于癌旁组织, 见图 2; Real-time PCR结果显示在4种胆管癌细胞系中miR-1269a的表达水平不同, 但均高于正常胆管上皮细胞, 见图 3。因此, 我们假设miR-1269a高表达是导致HOXD10表达下调的原因。
|
| para-Ca:para-carcinoma; Ca:carcinoma 图 2 miR-1269a在胆管癌组织及癌旁组织中的表达 Figure 2 miR-1269a expression in cholangiocarcinoma and adjacent para-carcinoma tissues |
|
| *:compared with HIBE-piC cell group, P < 0.05 图 3 胆管癌细胞及正常胆管细胞中miR-1269a表达 Figure 3 miR-1269a expression in cholangiocarcinoma and normal biliary epithelium cells |
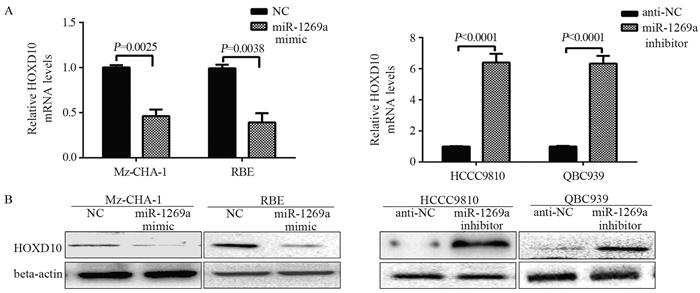
Real-time PCR分析显示, 相对阴性对照组(NC组)转染miR-1269a模拟物(mimic)的细胞(Mir-1269a mimic转染组)中HOXD10 mRNA表达水平显著减少(Mz-CHA-1:1.003±0.025 vs.0.463±0.071, P=0.0025;RBE 0.993±0.040 vs.0.393±0.101, P=0.0038), 而相对阴性对照载体组(anti-NC组)转染Mir-1269a抑制剂(inhibitor)的细胞(miR-1269a inhibitor转染组)中HOXD10mRNA表达水平显著增加(HCCC9810:1.003±0.015 vs.6.400±0.321, P < 0.0001;QBC939:0.993±0.023 vs.6.333±0.285, P < 0.0001), 见图 4A, Western blot分析显示HOXD10蛋白的表达与mRNA表达具有一致性, 见图 4B。该结果证实胆管癌中miR-1269a可调控HOXD10的表达。
|
| A:the expression of HOXD10 mRNA; B:the expression of HOXD10 protein 图 4 miR-1269a负性调节HOXD10 mRNA及蛋白的表达 Figure 4 Expression of HOXD10 mRNA and protein regulated negatively by miR-1269a |
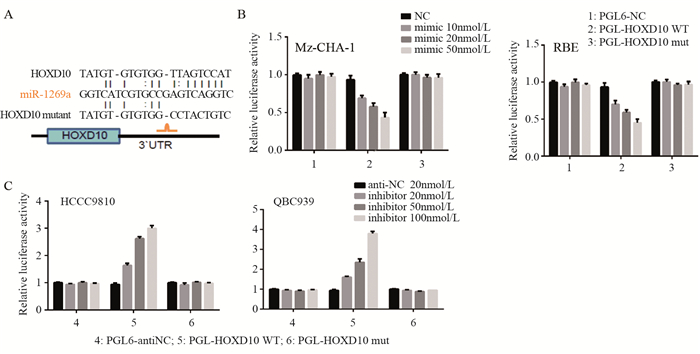
因编码HOXD10mRNA的3’UTR与miR-1269a具有互补元件, 两者可以靶向结合, 本实验构建HOXD10野生型及突变型的3’UTR双荧光素酶报告基因验证miR-1269a与HOXD10之间的靶向调控关系, 见图 5A。结果显示:miR-1269a模拟物转染胆管癌细胞后, 以剂量依赖模式显著抑制了与HOXD10基因野生型3’UTR连接的荧光素酶的活性, 但不能抑制HOXD10基因突变型3’UTR连接的荧光素酶的活性, 见图 5B。相反, miR-1269a抑制剂转染胆管癌细胞后, 则以剂量依赖模式显著增加了荧光素酶的活性, 证实miR-1269a通过直接靶向HOXD10基因的3’UTR发挥调控作用, 见图 5C。
|
| A:The putative miR-1269a binding sequence in the 3'-UTR of HOXD10 mRNA; B:Suppressed luciferase activity of wild-type 3'-UTR of HOXD10 by miR-1269a mimic; C:Increased luciferase activity of wild-type 3'-UTR of HOXD10 by miR-1269a inhibitor 图 5 双荧光素酶报告基因验证miR-1269a靶向调控HOXD10 Figure 5 miR-1269a modulated HOXD10 showed by luciferase reporter assays |
miR-1269a模拟物转染Mz-CHA-1及RBE细胞后, 通过聚碳酸酯膜的细胞数量显著高于对照组(Mz-CHA-1:78±2 vs.47±1, P=0.004;RBE 80±1 vs.48±3, P=0.001), miR-1269a抑制剂可显著减少胆管癌细胞的侵袭能力(HCCC9810:25±3 vs.45±1, P=0.016;QBC939:28±2 vs.51±1, P=0.013), 见图 6。提示miR-1269a/HOXD10在胆管癌的侵袭过程中发挥重要作用。
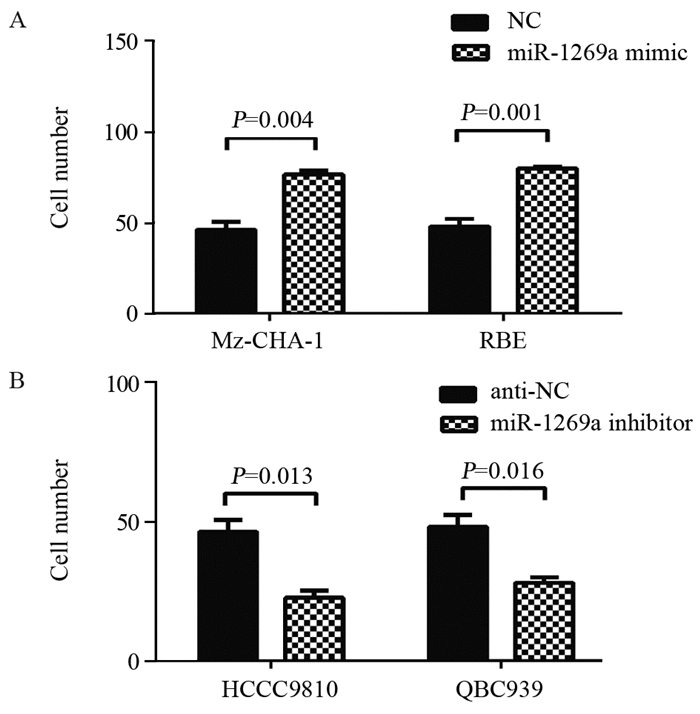
|
| A:miR-1269a overexpression promoted the invasion ability of Mz-CHA-1 and RBE cells showed by Transwell assay; B:miR-1269a inhibition attenuated the invasion ability of HCCC9810 and QBC939cells showed by Transwell assay 图 6 miR-1269a影响胆管癌细胞的侵袭能力 Figure 6 miR-1269a promoted cholangiocarcinoma cells invasion showed by Transwell assay |
miR-1269a模拟物转染Mz-CHA-1及RBE细胞后, 细胞的迁移能力显著增加, 而miR-1269a抑制剂可显著减少QBC939及HCCC9810胆管癌细胞的迁移, 见图 7。提示miR-1269a/HOXD10在胆管癌的迁移过程中发挥重要作用。

|
| 图 7 Mir-1269a促进胆管癌细胞的迁移能力 Figure 7 miR-1269a promoted cholangiocarcinoma cells migration activity showed by scratch assays |
肿瘤的侵袭性生长是发生远处转移的必要前提, 肿瘤细胞获得侵袭能力涉及多因素、多基因相互协调作用, 且具有时空性表达差异[12]。我们前期的结果证实HOXD10基因通过抑制重要的下游靶分子RHOC, 继而影响MMPs及EMT相关分子的功能, 抑制胆管癌的侵袭、转移过程[3]。HOXD10基因在生物学行为最差的低分化胆管癌中低表达甚至缺失, 为胆管癌的远处转移提供条件[11]; 然而, HOXD10在胆管癌中表达下调或缺失的原因尚不明确。
通过两种生物信息学软件TargetScan和miRNA.org预测调控HOXD10的微小RNA, 结果发现数百个miRNA与HOXD10基因的3’UTR区域具有互补结合位点。结合文献报道, 我们重点关注两种软件预测一致的, 且与细胞侵袭、转移能力相关的微小RNA, 并选择其中6个微小RNA在胆管癌组织及癌旁组织中进行差异表达验证。结果发现, miR-1269a与HOXD10基因的3’UTR区域可互补结合, 且miR-1269a在胆管癌组织中表达显著高于癌旁组织, 因此我们提出假设:胆管癌中激活的miR-1269a可直接靶向HOXD10继而抑制HOXD10的活性, 促进胆管癌细胞的侵袭。
miR-1269a是近年来发现的与肿瘤转移相关的微小RNAs。长期随访结果显示, miR-1269a与结肠癌术后的复发及转移显著相关[9]。在体外实验中, miR-1269a可显著增加结肠癌细胞的侵袭及转移能力, 并显示出与肿瘤微环境的相互调控作用[9]。上皮间质转化(epithelial-mesenchymal transition, EMT)是促进肿瘤转移的重要途径之一, 其中TGF-β信号激活与维持对EMT进程至关重要; TGF-β可通过激活下游的Smad或非Smad通路诱导EMT; 还可通过PI3K诱导Akt激活继而启动与细胞生存、侵袭、转移相关的mTOR信号通路, 加速肿瘤的转移[13-15]。Bu等报道, miR-1269a可通过靶向HOXD10强化结肠癌中TGF-β的表达, 并与TGF-β信号形成正反馈环路, 维持结肠癌中持续高活性的TGF-β信号促进结肠癌转移。miR-1269a-HOXD10(或Smad7)/TGF-β信号是结肠癌细胞侵袭、转移的重要机制[9]。目前miR-1269a在胆管癌中的作用及与HOXD10的调控关系尚不明确, 因此本研究通过系列实验证实了胆管癌细胞中miR-1269a可直接靶向抑制HOXD10表达来促进细胞的侵袭。
胆管癌是间质异常丰富的肿瘤, 肿瘤间质微环境中高活性的TGF-β信号与胆管癌的侵袭、转移密切相关[16-19]。在胆管癌中是否也存在TGF-β/miR-1269a-HOXD10/TGF-β正反馈机制, 值得深入研究。回答上述问题有助于深入理解胆管癌侵袭、转移过程中肿瘤细胞与间质细胞间的相互作用, 为胆管癌的治疗提供新思路。
| [1] | Cheung AC, Lorenzo Pisarello MJ, LaRusso NF. Pathobiology of biliary epithelia[J]. Biochim Biophys Acta, 2018, 1864(4 Pt B): 1220–31. |
| [2] | Razumilava N, Gores GJ. Cholangiocarcinoma[J]. Lancet, 2014, 383(9935): 2168–79. DOI:10.1016/S0140-6736(13)61903-0 |
| [3] | Yang H, Zhou J, Mi J, et al. HOXD10 acts as a tumor-suppressive factor via inhibition of the RHOC/AKT/MAPK pathway in human cholangiocellular carcinoma[J]. Oncol Rep, 2015, 34(4): 1681–91. DOI:10.3892/or.2015.4194 |
| [4] | Ou Y, Zhang Q, Tang Y, et al. DNA methylation enzyme inhibitor RG108 suppresses the radioresistance of esophageal cancer[J]. Oncol Rep, 2018, 39(3): 993–1002. |
| [5] | Zhang Y, Yang P, Sun T, et al. miR-126 and miR-126* repress recruitment of mesenchymal stem cells and inflammatory monocytes to inhibit breast cancer metastasis[J]. Nat Cell Biol, 2013, 15(3): 284–94. DOI:10.1038/ncb2690 |
| [6] | Olaizola P, Lee-Law PY, Arbelaiz A, et al. MicroRNAs and extracellular vesicles in cholangiopathies[J]. Biochim Biophys Acta, 2018, 1864(4 Pt B): 1293–307. |
| [7] | Ma L, Teruya-Feldstein J, Weinberg RA. Tumour invasion and metastasis initiated by microRNA-10b in breast cancer[J]. Nature, 2007, 449(7163): 682–8. DOI:10.1038/nature06174 |
| [8] | Li Q, Ding C, Chen C, et al. miR-224 promotion of cell migration and invasion by targeting Homeobox D 10 gene in human hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2014, 29(4): 835–42. DOI:10.1111/jgh.2014.29.issue-4 |
| [9] | Bu P, Wang L, Chen KY, et al. miR-1269 promotes metastasis and forms a positive feedback loop with TGF-beta[J]. Nat Commun, 2015, 6: 6879. DOI:10.1038/ncomms7879 |
| [10] | Hu X, Chen D, Cui Y, et al. Targeting microRNA-23a to inhibit glioma cell invasion via HOXD10[J]. Sci Rep, 2013, 3: 3423. DOI:10.1038/srep03423 |
| [11] | Yang H, Liang J, Zhou J, et al. Knockdown of RHOC by shRNA suppresses invasion and migration of cholangiocellular carcinoma cells via inhibition of MMP2, MMP3, MMP9 and epithelial-mesenchymal transition[J]. Mol Med Rep, 2016, 13(6): 5255–61. DOI:10.3892/mmr.2016.5170 |
| [12] | Yang H, Lu X, Liu Z, et al. FBXW7 suppresses epithelial-mesenchymal transition, stemness and metastatic potential of cholangiocarcinoma cells[J]. Oncotarget, 2015, 6(8): 6310–25. |
| [13] | Huang M, Su L, Yang L, et al. Effect of exogenous TGF-beta1 on the cadmium-induced nephrotoxicity by inhibiting apoptosis of proximal tubular cells through PI3K-AKT-mTOR signaling pathway[J]. Chem Biol Interact, 2017, 269: 25–32. DOI:10.1016/j.cbi.2017.03.010 |
| [14] | Ko DY, Shin JM, Um JY, et al. Rapamycin inhibits transforming growth factor beta 1 induced myofibroblast differentiation via the phosphorylated-phosphatidylinositol 3-kinase mammalian target of rapamycin signal pathways in nasal polyp-derived fibroblasts[J]. Am J Rhinol Allergy, 2016, 30(6): 211–7. DOI:10.2500/ajra.2016.30.4389 |
| [15] | Luo D, Hu S, Tang C, et al. Mesenchymal stem cells promote cell invasion and migration and autophagy-induced epithelial-mesenchymal transition in A549 lung adenocarcinoma cells[J]. Cell Biochem Funct, 2018, 36(2): 88–94. DOI:10.1002/cbf.v36.2 |
| [16] | Zhong W, Tong Y, Li Y, et al. Mesenchymal stem cells in inflammatory microenvironment potently promote metastatic growth of cholangiocarcinoma via activating Akt/NF-κB signaling by paracrine CCL5[J]. Oncotarget, 2017, 8(43): 73693–704. |
| [17] | Patman G. Liver cancer:TGF-β and cholangiocarcinoma[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(1): 2–3. |
| [18] | Wang H, Li C, Jian Z, et al. TGF-β1 Reduces miR-29a Expression to Promote Tumorigenicity and Metastasis of Cholangiocarcinoma by Targeting HDAC4[J]. PLoS One, 2015, 10(10): e0136703. DOI:10.1371/journal.pone.0136703 |
| [19] | Chen Y, Ma L, He Q, et al. TGF-β1 expression is associated with invasion and metastasis of intrahepatic cholangiocarcinoma[J]. Biol Res, 2015, 48: 26. DOI:10.1186/s40659-015-0016-9 |
 2018, Vol. 45
2018, Vol. 45
