文章信息
- 血小板与淋巴细胞比值对肝细胞癌患者预后影响的Meta分析
- Prognostic Significance of Platelet-lymphocyte Ratio in Hepatocellular Carcinoma Patients: A Meta-analysis
- 肿瘤防治研究, 2018, 45(10): 775-780
- Cancer Research on Prevention and Treatment, 2018, 45(10): 775-780
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0151
- 收稿日期: 2018-01-31
- 修回日期: 2018-03-20
据全球癌症统计数据报道,全球范围内每年预计新发肝细胞癌(Hepatocellular carcinoma, HCC)692 000例,肝细胞癌位居恶性肿瘤相关死亡原因的第3位[1]。目前HCC的主要治疗手段包括外科手术切除、肝移植术(Liver transplantation, LT)、肝动脉化疗栓塞术(Transarterial artery chemoembolization, TACE)、物理消融(Radiofrequency ablation, RFA)、以索拉菲尼为代表的靶向药物治疗等,其中外科肝切除和肝移植是主要的根治方法。但是即使已经达到外科根治,大部分HCC患者的预后仍然不令人满意。术后肿瘤高复发率、高远处转移率及随后带来的较高死亡率是导致HCC患者预后较差的主要原因。因此分析影响HCC患者预后的相关因素、确立更准确的预测预后的指标有助于鉴别高风险人群并为临床医师制定个体化治疗方案提供决策依据。目前已有多种肝癌预后评分系统,如Okuda分期、意大利肝癌评分(Cancer of The Liver Italian Program, CLIP)、巴塞罗那临床肝癌分期标准、日本综合分期积分(Japan Integrated Staging(JIS)score)以及TNM分期(Tumor-node-metastasis, TNM)等。近年研究发现血小板/淋巴细胞比值(Platelet-lymphocyte ratio, PLR)可以作为评估肝细胞癌患者总生存的一项简单而有效的指标。循环外周血中血小板计数的增加与恶性肿瘤患者预后差是密切相关的[2]。如前所述,淋巴细胞计数的降低也反映了患者预后较差。大量研究证实了PLR在多种恶性肿瘤中的预后价值[3-4]。血小板也能释放一些生长因子,如:血小板衍生生长因子(PDGF)、血管内皮生长因子(VEGF)、TGF-β等[5];这些生长因子可以刺激恶性肿瘤细胞的增殖、黏附,进而影响肿瘤的生长和转移。但同时也有学者指出PLR并不能作为预测HCC患者的独立预后指标[6]。因此,PLR究竟能否作为整体HCC患者预后标志物仍然具有争议。
本研究通过Meta分析着重探讨术前PLR值高低与肝细胞癌患者预后的相关性。同时对经不同治疗模式、不同PLR临界值、不同种族等进行了详细的亚组分析,旨在全面分析PLR对肝细胞癌患者预后的影响。
1 资料与方法 1.1 检索策略以PLR、platelet-lymphocyte ratio或者platelet to lymphocyte ratio和HCC或hepatocellular carcinoma作为检索词。检索源主要为PubMed、Embase、Web of Science期刊论文数据库中已发表的文献,检索时限为数据库建立至2016年12月31日,文献语种限制为英语,同时通过参考文献手工检索并查找相关文献作为补充,以评估PLR对肝细胞癌患者预后的影响。
1.2 文献纳入和排除标准纳入标准:(1)研究对象为经病理确诊的肝细胞癌患者;(2)研究PLR与HCC预后的关系;(3)报道了PLR与OS或DFS的关系;(4)有完整的HR、RR或OR及其相应的95%CI,或者可以根据文中数据计算出来;(5)明确指出了PLR的Cut-off值;(6)如多篇文献对相同人群数据进行了报道,则选取样本量最大或时间最新的文献。
排除标准:(1)文献类型为Review、系统评价、Comment、Letter、会议摘要;(2)仅有摘要且不能获取全文的文献;(3)动物实验与肝癌细胞系研究;(4)肝胆管细胞癌或非原发肿瘤如转移癌的研究;(5)原文献中研究数据不完整或未提供可提取的研究数据。
1.3 数据提取由两名研究者严格按照纳入和排除标准,对可能纳入的文献全文独立进行判断、筛选以及交叉核对,最终达成一致意见。对最终纳入本研究的合格文献进行信息采集及数据提取分析。提取数据主要包括:第一作者姓名、研究来源地域、发表年限、研究周期、随访周期、样本量、肿瘤分期、主要治疗方法、研究设计、截断值、生存分析的HR及其95%CI或RR及其95%CI(一般直接从研究文献中获取,如原文中未直接提供可参考Tierney[1]的预后相关Meta分析数据提取方法从Kaplan-Meier生存曲线图中提取有效数据并进行计算)。
1.4 质量控制由两名研究者对所纳入的文献进行质量控制,根据纽卡斯尔-渥太华评价量表(Newcastle-Ottawa Quality Assessment Scale, NOS)对入选文献进行质量评分。若有分歧则通过讨论达成一致意见。NOS量表从选择性(0~4分)、可比性(0~2分)及结局评估(0~3分)三个方面对文献质量进行评价,满分为9分,NOS评分≥7分为高质量研究。
1.5 统计学方法采用STATA 12.0统计软件进行Meta分析,将从文献中直接获取的或者根据相关Meta分析数据提取方法从Kaplan-Meier生存曲线图中提取有效数据并进行预测得出的HR值及其95%CI作为效应分析的测量指标。异质性检验采用Cochran's Q统计量检验法,通过I2和P值来评价异质性的大小。根据检验结果选用相应的数据合并方法:若纳入的各研究之间存在异质性(P < 0.05),则采用随机效应模型进行合并分析处理;若各研究是同质的(P > 0.05),则采用固定效应模型进行合并分析处理。采用Begg′s漏斗图法对纳入研究的潜在发表偏倚进行评估。所有统计学检验均为双侧概率检验(α=0.05),P < 0.05为差异有统计学意义。
2 结果 2.1 文献检索结果初步检索到99篇符合条件的研究文献,经过纳入、排除标准筛选及剔除重复文献后,最终纳入6篇文献,共计1 215例HCC患者,见图 1。

|
| 图 1 文献筛选流程图 Figure 1 Flow chart of study selection |
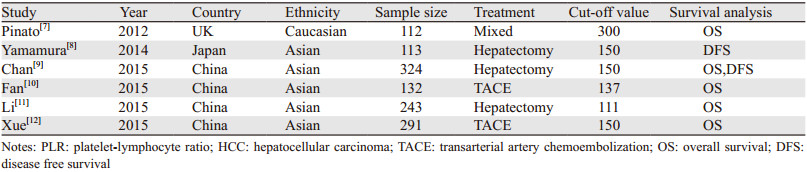
纳入的6篇文献的基本特征见表 1。其中4篇来自中国,1篇来自日本,1篇来自英国。公开发表年限主要为2012年至2015年期间,共计1 215例HCC患者,其中接受根治性外科手术切除680例、TACE 423例、余112例混杂多种治疗方法。单篇研究样本量为112例~324例不等。仅1篇文献统计了DFS和OS结果,1篇文献统计了DFS结果,4篇文献统计了OS结果。各研究根据其不同的统计方法确定了不同的PLR截断值。
有5篇文献报道了PLR与HCC患者OS的相关性,共纳入1 102例HCC患者。其中研究对象为高加索人群的占1篇,亚洲人群占4篇;研究对象所接受的初始治疗方法为TACE占2篇,根治性外科切除术占2篇,余1篇为混杂多种治疗方法。PLR截断值=150的研究占2篇,≠150的占3篇。通过统计得出各研究间存在显著异质性(P < 0.001, I2=87.3%),采用随机效应模型,各研究分析后的合并HR=1.55(95%CI: 1.06~2.29),差异有统计学意义(P=0.025)。意味着低PLR组患者总体生存时间要明显优于高PLR组患者。进一步对人种、治疗方法、不同的PLR截断值进行亚组分析,结果显示亚洲人群各研究合并HR=1.46(95%CI: 0.97~2.18),差异无统计学意义(P=0.07);因仅有1篇文献研究对象为高加索人群,无法进行合并分析,见图 2。治疗方法为外科根治性手术切除的各研究合并HR=1(95%CI: 1~1),差异有统计学意义(P < 0.001);TACE的各研究合并HR=1.97(95%CI: 1.23~3.16),差异具有统计学意义(P=0.005),见图 3。混杂多种治疗方法的研究文献各仅有1篇,无法进行合并分析。PLR截断值=150的研究合并HR=1.52(95%CI: 1.2~1.93),差异有统计学意义(P < 0.001);PLR截断值≠150的研究合并HR=1.73(95%CI: 0.84~3.56),差异无统计学意义(P=0.141),见图 4、表 2。

|
| 图 2 以种族为区分因素做亚组分析PLR与HCC患者OS关系的森林图 Figure 2 Forest plot for subgroup analysis of association between PLR and OS of HCC patients by ethnicity |

|
| 图 3 以治疗手段为区分因素做亚组分析PLR与HCC患者OS关系的森林图 Figure 3 Forest plot for subgroup analysis of association between PLR and OS of HCC patients by treatment |

|
| 图 4 以Cut-off值为区分因素做亚组分析PLR与HCC患者OS关系的森林图 Figure 4 Forest plot for subgroup analysis of association between PLR and OS of HCC patients by Cut-off value |

|
共有2篇文献报道了PLR与HCC患者DFS的相关性,共纳入437例HCC患者。通过统计得出各研究间存在显著异质性(P=0.020, I2=81.7%),采用随机效应模型方法,各研究合并分析后的合并HR=1.65(95%CI: 0.74~3.71),差异无统计学意义(P=0.222)。也就意味着PLR组对患者DFS并无显著影响,见表 2。由于仅有2篇文献纳入,所以无法对人种、治疗方法及不同的PLR截断值进行亚组分析。
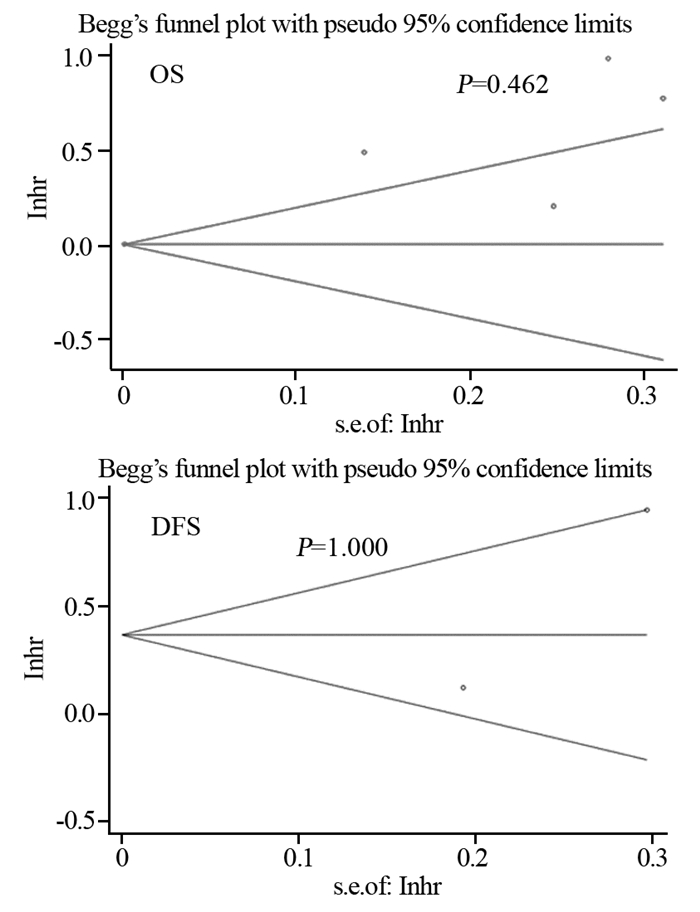
2.3.3 发表偏倚分析发表偏倚主要用于预测Meta分析结果的可信度,尤其是当分析结果显示有统计学意义的时候。通过漏斗图法对各研究间的发表偏倚进行分析,Begg检验结果显示无论是对OS还是对DFS各研究间不存在发表偏倚(均P > 0.05),见图 5。
|
| 图 5 发表偏倚检测的漏斗图 Figure 5 Begg's funnel plot of publication bias detection |
越来越多的研究证实了炎性反应和肝细胞癌的相互关系。当肝脏受到各种感染性和非感染性(肝炎病毒感染、黄曲霉素、酗酒、自身免疫性肝炎)因素的攻击,会促进各种促炎分子如细胞因子、环氧合酶-2、前列腺素及大量胞内信号分子、转录因子等表达上调,导致系统和肿瘤内形成一种持续存在的慢性炎性反应,进而促进肝细胞癌的发生和发展[13]。同时肿瘤组织缺氧或坏死也会引发系统炎性反应,与抗凋亡密切相关[14],通过募集淋巴细胞、活化炎性细胞因子、诱导中性粒细胞增多、打破适应性免疫反应及对激素、化学试剂异常应答等途径促进肿瘤血管新生、侵袭及转移[13, 15]。因而它也可作为多种恶性肿瘤的预后标志物。最为典型的系统炎性反应标志物就包括PLR。
PLR是近些年被多项研究提出的一种常见系统炎性反应标志物,并被认为是影响多种炎性反应相关恶性肿瘤预后的独立危险因素。本文系统回顾了近年来针对系统炎性反应指标PLR与肝细胞癌患者预后包括DFS和OS相互关系的研究以期寻找共性。虽然纳入的研究间存在一定的异质性,但是我们仍然得出了一些有意义的结论。合并各项研究的结果显示PLR值越高,提示HCC患者OS越短,而对DFS无显著影响。
恶性肿瘤患者常常出现血小板增多,血小板增多被认为是多种恶性肿瘤的负性预后标志物[16-17]。它在聚集和脱粒过程中可以异常分泌VEGF,刺激肿瘤血管新生及炎性反应细胞因子而促进肿瘤细胞的生长[5]。此外,血小板还能够保护肿瘤细胞免于自然杀伤细胞介导的溶解反应[18]。反过来,某些炎性细胞因子如IL-1、IL-6能够促进巨核细胞增殖,进而引起血小板增多[19-20]。另一方面,淋巴细胞在恶性肿瘤的免疫监视过程中起着重要作用[21]。恶性肿瘤相关炎性反应可以通过募集调节性T细胞、活化趋化因子来抑制抗肿瘤免疫应答,进而导致肿瘤生长和转移。无论是肿瘤组织中浸润的淋巴细胞含量亦或是外周血中淋巴细胞计数,均被认为是恶性肿瘤患者重要的预后影响因素,淋巴细胞密度越高,预后越好[22-23]。
如上所述,血小板增多和淋巴细胞减少与系统炎性反应程度具有密切的相关性,PLR作为这两项血液学指标的结合,可以作为一种新型的系统炎性反应指标,其对HCC预后价值的探讨也值得进一步分析。本研究共纳入了6项研究来分析PLR与HCC患者预后的相关性。通过合并研究总体显示PLR是影响HCC患者OS的独立风险因素,对DFS无显著影响。进一步的亚组分析显示NLR对高加索HCC人群较亚洲人群的OS的影响要显著,对初始接受何种治疗方式包括根治性切除术、TACE的HCC人群影响是一致的。并且PLR截断值取150对OS的影响也要显著于其他值。但是由于关于PLR与HCC患者预后相关的文献较少,进而纳入本Meta分析的研究也较少,对以上的结论仍然需要保持一定的中立态度。同时也有研究报道了PLR与临床病理因素的相关性,PLR值越高,淋巴结阳性率和转移率越高、肿瘤组织的体积越大、AJCC分期越晚等[24-26]。但是在HCC人群中的相关研究仍然较少,限制了分析的进一步进行。
最后需要提出的是我们的研究结论也存在一定的局限性和不足之处。首先研究结果存在一定的异质性,主要归因于多种因素的混合作用包括患者的基线特征、治疗方式、病情严重程度、随访周期、样本量及不同的PLR截断值。虽然本研究的亚组以及敏感度分析显示上述所有影响异质性的因素都不能完全解释异质性。因此我们提出这种异质性的结果可能是上述多种因素的联合效应。其次,本研究在分析PLR和HCC预后相关性时所纳入的研究文献量偏少,也没有进一步分析PLR和患者临床病理参数之间的相关性,因为仅有2项研究报道了相关性信息,研究数据不够充分,难以进一步进行分析。第三,某些研究评估了系统炎性因子指标单因素分析的结果,而有些则是多因素分析结果,这可能为研究带来了偏倚。另外,本Meta分析纳入的大部分研究得出的均是阳性结果,相关阴性结果的文章较少,可能更多具有争议结果的研究没有被发现并纳入。最后,这些研究主要集中在术前系统炎性反应标志物上,而术后这些标志物水平的改变也具有一定的临床价值,术后系统炎性反应标志物的改变有可能动态反映了宿主炎性反应与免疫反应的平衡状态,而有关于此的研究尚不清楚。
综上,本研究结果提示了系统炎性反应标志物PLR是影响HCC患者预后的独立风险因素,相较其他预后标志物而言,系统炎性反应标志物似乎更为简便、容易获得、可重复、低成本并且可以在一定程度上暗示肿瘤生物学行为,这将有助于筛选不良预后人群,为临床医师提供个体化治疗提供一定的决策依据。此外高PLR水平HCC患者或许能够从抗炎治疗中获益。但是,鉴于本研究存在诸多的局限性,这些结果在临床实践推广应用时仍然需要谨慎。期望未来将有更多设计完善、前瞻性、大样本的研究来进一步证实。
| [1] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(3): 151–66. DOI:10.3322/caac.21173 |
| [2] | Peterson JE, Zurakowski D, Italiano JE Jr, et al. VEGF, PF4 and PDGF are elevated in platelets of colorectal cancer patients[J]. Angiogenesis, 2012, 15(2): 265–73. DOI:10.1007/s10456-012-9259-z |
| [3] | Toda M, Tsukioka T, Izumi N, et al. Platelet-to-lymphocyte ratio predicts the prognosis of patients with non-small cell lung cancer treated with surgery and postoperative adjuvant chemotherapy[J]. Thorac Cancer, 2018, 9(1): 112–9. |
| [4] | Lee BM, Chung SY, Chang JS, et al. The Neutrophil-Lymphocyte Ratio and Platelet-Lymphocyte Ratio Are Prognostic Factors in Patients with Locally Advanced pancreatic cancer treated with chemoradiotherapy[J]. Gut Liver, 2018, 12(3): 342–52. DOI:10.5009/gnl17216 |
| [5] | Bambace NM, Holmes CE. The platelet contribution to cancer progression[J]. J Thromb Haemost, 2011, 9(2): 237–49. DOI:10.1111/j.1538-7836.2010.04131.x |
| [6] | Kinoshita A, Onoda H, Imai N, et al. Comparison of the prognostic value of inflammation-based prognostic scores in patients with hepatocellular carcinoma[J]. Br J Cancer, 2012, 107(6): 988–93. DOI:10.1038/bjc.2012.354 |
| [7] | Pinato DJ, North BV, Sharma R. A novel, externally validated inflammation-based prognostic algorithm in hepatocellular carcinoma: The prognostic nutritional index (PNI)[J]. Br J Cancer, 2012, 106(8): 1439–45. DOI:10.1038/bjc.2012.92 |
| [8] | Yamamura K, Sugimoto H, Kanda M, et al. Comparison of inflammation-based prognostic scores as predictors of tumor recurrence in patients with hepatocellular carcinoma after curative resection[J]. J Hepatobiliary Pancreat Sci, 2014, 21(9): 682–8. DOI:10.1002/jhbp.2014.21.issue-9 |
| [9] | Chan AW, Chan SL, Wong GL, et al. Prognostic nutritional index (pni) predicts tumor recurrence of very early/early stage hepatocellular carcinoma after surgical resection[J]. Ann Surg Oncol, 2015, 22(13): 4138–48. DOI:10.1245/s10434-015-4516-1 |
| [10] | Fan W, Zhang Y, Wang Y, et al. Neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios as predictors of survival and metastasis for recurrent hepatocellular carcinoma after transarterial chemoembolization[J]. PLoS One, 2015, 10(3): e0119312. DOI:10.1371/journal.pone.0119312 |
| [11] | Li X, Chen ZH, Xing YF, et al. Platelet-to-lymphocyte ratio acts as a prognostic factor for patients with advanced hepatocellular carcinoma[J]. Tumor Biol, 2015, 36(4): 2263–9. DOI:10.1007/s13277-014-2833-9 |
| [12] | Xue TC, Jia QA, Ge NL, et al. The platelet-to-lymphocyte ratio predicts poor survival in patients with huge hepatocellular carcinoma that received transarterial chemoembolization[J]. Tumor Biol, 2015, 36(8): 6045–51. DOI:10.1007/s13277-015-3281-x |
| [13] | Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883–99. DOI:10.1016/j.cell.2010.01.025 |
| [14] | Roxburgh CS, McMillan DC. Role of systemic inflammatory response in predicting survival in patients with primary operable cancer[J]. Future Oncol, 2010, 6(1): 149–63. DOI:10.2217/fon.09.136 |
| [15] | Wang DS, Luo HY, Qiu MZ, et al. Comparison of the prognostic values of various inflammation based factors in patients with pancreatic cancer[J]. Med Oncol, 2012, 29(5): 3092–100. DOI:10.1007/s12032-012-0226-8 |
| [16] | Goubran HA, Stakiw J, Radosevic M, et al. Platelet-cancer interactions[J]. Semin Thromb Hemost, 2014, 40(3): 296–305. DOI:10.1055/s-00000077 |
| [17] | Kim SH, Lee HW, Go SI, et al. Clinical significance of the preoperative platelet count and platelet-to-lymphocyte ratio (plt-plr) in patients with surgically resected non-small cell lung cancer[J]. Oncotarget, 2016, 7(24): 36198–206. |
| [18] | Elaskalani O, Berndt MC, Falasca M, et al. Targeting platelets for the treatment of cancer[J]. Cancers(Basel), 2017, 9(7): pii: E94. |
| [19] | Alexandrakis MG, Passam FH, Moschandrea IA, et al. Levels of serum cytokines and acute phase proteins in patients with essential and cancer-related thrombocytosis[J]. Am J Clin Oncol, 2003, 26(2): 135–40. DOI:10.1097/00000421-200304000-00007 |
| [20] | Harano K, Kogawa T, Wu J, et al. Thrombocytosis as a prognostic factor in inflammatory breast cancer[J]. Breast Cancer Res Treat, 2017, 166(3): 819–32. DOI:10.1007/s10549-017-4463-6 |
| [21] | Dunn GP, Old LJ, Schreiber RD. The immunobiology of cancer immunosurveillance and immunoediting[J]. Immunity, 2004, 21(2): 137–48. DOI:10.1016/j.immuni.2004.07.017 |
| [22] | Mahmoud SM, Paish EC, Powe DG, et al. Tumor-infiltrating CD8+ lymphocytes predict clinical outcome in breast cancer[J]. J Clin Oncol, 2011, 29(15): 1949–55. DOI:10.1200/JCO.2010.30.5037 |
| [23] | Morgan RA, Dudley ME, Wunderlich JR, et al. Cancer regression in patients after transfer of genetically engineered lymphocytes[J]. Science, 2006, 314(5796): 126–9. DOI:10.1126/science.1129003 |
| [24] | Asher V, Lee J, Innamaa A, et al. Preoperative platelet lymphocyte ratio as an independent prognostic marker in ovarian cancer[J]. Clin Transl Oncol, 2011, 13(7): 499–503. DOI:10.1007/s12094-011-0687-9 |
| [25] | Azab B, Shah N, Radbel J, et al. Pretreatment neutrophil/lymphocyte ratio is superior to platelet/lymphocyte ratio as a predictor of long-term mortality in breast cancer patients[J]. Med Oncol, 2013, 30(1): 432. DOI:10.1007/s12032-012-0432-4 |
| [26] | Wang D, Wu M, Feng FZ, et al. Pretreatment neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios do not predict survival in patients with cervical cancer treated with neoadjuvant chemotherapy and radical hysterectomy[J]. Chin Med J(Engl), 2012, 126(8): 1464–8. |
 2018, Vol. 45
2018, Vol. 45