文章信息
- 核转录因子E47和LOXL2在食管鳞癌组织中的表达及其临床意义
- Significance of E47 and LOXL2 Expressions in Esophageal Squamous Cell Carcinoma Tissues
- 肿瘤防治研究, 2018, 45(9): 647-651
- Cancer Research on Prevention and Treatment, 2018, 45(9): 647-651
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0137
- 收稿日期: 2018-01-29
- 修回日期: 2018-03-21
2. 830011 乌鲁木齐,新疆医科大学基础医学院组胚教研室;
3. 830011 乌鲁木齐,新疆医科大学第一附属医院病理科
2. Department of Histology and Embryology, Basic Medical College, Xinjiang Medical University, Urumqi 830011, China;
3. Department of Pathology, The First Affiliated Hospital of Xinjiang Medical University, Urumqi 830011, China
E47是由E2A基因编码的碱性螺旋环螺旋转录因子,其以同源或异二聚体与目的基因启动子E-box顺式作用元件结合,从而激活基因转录[1]。近年有研究表明E47可抑制E-cadherin转录,诱导上皮间质转化(epithelial mesenchymal transition, EMT)促进肿瘤细胞侵袭和迁移[2-3]。赖氨酰氧化酶样蛋白2(lysyl oxidase1ike 2 protein, LOXL2)是赖氨酸氧化酶家族成员,在肿瘤细胞的EMT和维持细胞外基质稳态等过程发挥重要作用的修饰酶[4-5]。本课题组前期发现E-cadherin在食管癌组织中阳性表达率升高与肿瘤侵袭、转移等密切相关[6],转录因子E47和LOXL2是否在功能上相互作用,促进食管癌浸润和转移呢?目前E47和LOXL2促进食管鳞癌浸润、转移的分子调控机制鲜见报道。因此,本研究采用实时荧光定量PCR(qRT-PCR)和免疫组织化学法检测E47和LOXL2在食管鳞癌组织中mRNA和蛋白水平表达情况,探讨二者与临床病理特征的相关性及相互关系。
1 资料与方法 1.1 病例与标本收集新疆医科大学第一附属医院病理科2008年1月—2017年9月手术切除食管鳞癌石蜡包埋组织60例,其中男50例,女10例,年龄40~72岁,中位年龄51岁,所有患者术前均无放疗、化疗及免疫治疗史。按照2016WHO分类标准进行病理分级:高分化26例,中低分化34例。其中淋巴结转移41例,无淋巴结转移19例;浸润至黏膜下层20例,浸润至肌层及浆膜层40例;汉族40例,哈萨克族20例。同时收集20例远端正常食管石蜡包埋组织作为对照。全部标本均经40 g/L甲醛固定,常规脱水,石蜡包埋、连续4 μm厚度切片,分别用于HE和免疫组织化学染色。另外,收集手术切除新鲜食管鳞癌及癌旁正常组织标本各20例。手术切除后标本迅速放入液氮冷冻,-80℃冰箱保存待用。石蜡包埋组织及新鲜组织均经病理组织学诊断确诊。
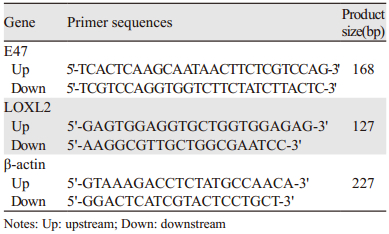
1.2 试剂及仪器TRIzol试剂(美国Invitrogen公司),反转录试剂盒和SYBR Green荧光染料(日本TaKaRa公司),E47和LOXL2的引物(日本TaKaRa公司合成),见表 1。兔抗人E47多克隆抗体、兔抗人LOXL2多克隆抗体购自英国Abcam公司,SP免疫组织化学试剂盒和DAB显色剂均购自北京中杉金桥生物技术有限公司。主要应用仪器有高速低温离心机(北京Bechmann公司)、核酸/蛋白快速测定仪(Gene Quant Ⅱ,美国GE公司)、IQTM 5 Multicolor Real-time PCR Detection System,PCR仪(iCycler,美国Bio-Rad公司)和核酸凝胶成像系统(GelDoc XR,美国Bio-Rad公司)。光学显微镜BA210为美国Motic公司产品。
用TRIzol法提取总RNA,用紫外分光光度计进行定量,OD值均在1.8~2.0,按照反转录试剂盒说明书将总RNA反转录成cDNA。qRT-PCR体系20 μl:荧光染料10 μl,上游、下游引物各0.5 μl,cDNA 2 μl,灭菌蒸馏水7 μl,同时制作标准品曲线。PCR反应程序为:95℃预变性3 min,95℃变性10 s、退火30 s(β-actin、E47和LOXL2的退火温度分别为55℃、60℃和61℃),荧光检测,反应40个循环,并绘制溶解曲线。每个样本设置3个平行孔,取拷贝数均值进行统计分析。以β-actin作为内参,采用标准曲线进行相对定量的方法,分别比较食管鳞癌及其癌旁正常组织E47和LOXL-2的表达差异。2%琼脂糖凝胶电泳鉴定PCR产物。
1.3.2 免疫组织化学SP法检测E47和LOXL2蛋白在食管鳞癌组织中的表达石蜡包埋组织进行连续3 μm厚切片,常规二甲苯脱蜡,梯度酒精水化后微波炉抗原修复,滴加适量3%H2O2 20 μl阻断内源性过氧化物酶,然后滴加一抗4℃冰箱培育过夜。E47和LOXL2抗体的工作液浓度分别为1:100和1:200。次日滴加生物素标记的二抗,37℃孵育30 min。各步骤间隔均用PBS缓冲液(pH7.4)冲洗3遍(10 min)。DAB显色,苏木精对比染色,常规酒精逆浓度梯度脱水、二甲苯透明,中性树胶封片。每批染色均以上述抗体已知阳性的切片为阳性对照,以0.01 mol/L PBS代替一抗作阴性对照。
1.4 免疫组织化学染色结果判定两位病理医师采用双盲法分别观察免疫组织化学染色结果。E47和LOXL2蛋白阳性结果的判定标准:LOXL2的表达以细胞质和(或)细胞膜出现棕黄色颗粒沉淀的细胞为阳性细胞,E47的表达以细胞核或细胞质出现棕黄色颗粒沉淀。随机每张切片取10个高倍视野观察阳性细胞(HPEs×200),以平均每100个细胞中含阳性细胞个数作为阳性细胞率。LOXL2和E47表达阳性细胞率≥50%为强阳性(++),≥25%~50%判断为阳性(+),细胞无染色或阳性细胞率 < 25%判断为阴性(-)。
1.5 统计学方法采用SPSS17.0统计软件包进行统计处理,计量资料选用均数±标准差(x±s)表示,采用两组独立样本的t检验;计数资料采用χ2检验及Pearson相关性分析,P < 0.05为差异有统计学意义。
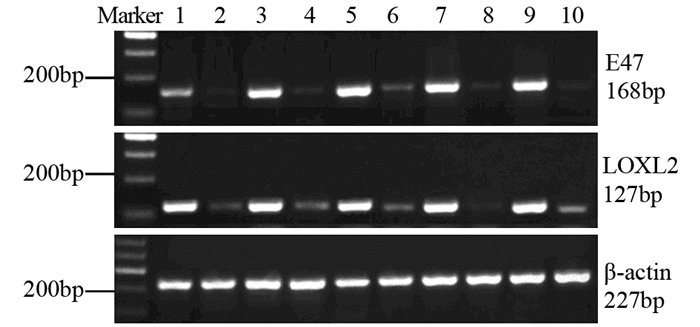
2 结果 2.1 E47和LOXL2 mRNA在食管鳞癌组织和癌旁正常组织中的表达E47和LOXL2 mRNA在食管鳞癌组织中的表达量明显高于癌旁正常组织,差异有统计学意义(均P < 0.05),见表 2,2%琼脂糖凝胶电泳鉴定qPCR产物见图 1。

|
|
| 1, 3, 5, 7, 9: the expressions of E47, LOXL2 and β-actin mRNA in ESCC tissues; 2, 4, 6, 8, 10: the expressions of E47, LOXL2 and β-actin mRNA in adjacent normal tissues 图 1 食管鳞癌和癌旁正常组织中E47和LOXL2 mRNA的表达 Figure 1 Expression of E47 and LOXL2 mRNA in ESCC and adjacent normal tissues |
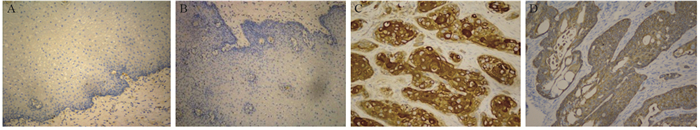
E47蛋白的阳性表达主要定位于细胞核或细胞质,呈棕黄色颗粒,见图 2A、C。LOXL2蛋白的阳性表达主要定位于细胞质或细胞膜,呈棕黄色颗粒,见图 2B、D。E47和LOXL2在个别正常食管组织中表达,但表达程度较弱,多位于食管鳞状上皮的基底细胞层,中间层和表皮层表达几乎呈阴性。食管鳞癌组织中E47和LOXL2蛋白阳性表达率分别为80.0%和83.3%,明显高于癌旁正常组织30%和40%,差异均有统计学意义(均P < 0.05),见表 3。
|
| A, B: the expressions of E47 and LOXL2 in the adjacent normal tissues, respectively (×200); C, D: the expressions of E47 and LOXL2 in ESCC tissues, respectively(×400) 图 2 E47和LOXL2在食管鳞癌和癌旁正常组织中的表达(SP) Figure 2 Expressions of E47 and LOXL2 proteins in ESCC and adjacent normal tissues (SP) |

|
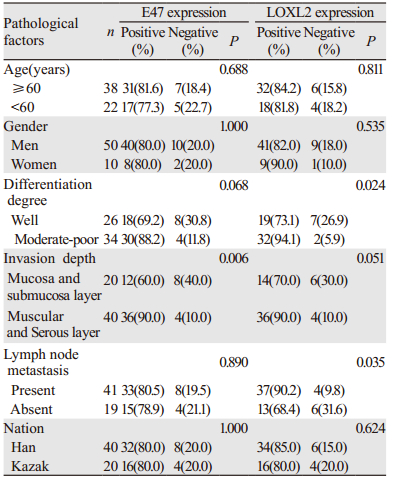
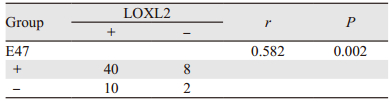
E47蛋白表达水平的表达变化与食管鳞癌的浸润深度密切相关(P < 0.05),在侵及肌层的癌组织中的表达明显高于未侵及肌层组,其表达差异具有统计学意义(P < 0.05)。E47蛋白表达水平与食管癌患者的年龄、性别、分化程度、淋巴结转移、民族无明显相关性;LOXL2蛋白表达与食管鳞癌的分化程度和淋巴结转移相关,蛋白表达在中低分化组明显高于高分化组,在淋巴结转移组蛋白表达明显高于无淋巴结转移组,差异有统计学意义(P < 0.05);LOXL2蛋白表达水平与食管癌患者的年龄、性别、浸润深度及民族无明显相关性,见表 4。进一步分析食管鳞癌组织中E47和LOXL2蛋白表达的相关性,发现E47和LOXL2蛋白表达共同阳性40例,共同阴性2例,两者在食管鳞癌组织中的表达呈正相关(r=0.582, P=0.002),见表 5。
|
|
新疆是我国食管癌高发区之一,其北部哈萨克族食管癌发病率远远高于当地其他民族和全国平均水平[7],其发病机制至今仍不清楚,侵袭和转移是患者死亡的主要原因。EMT是胚胎发育中的一个基本过程,多种因子及信号通路通过启动EMT参与肿瘤细胞的侵袭和转移[8]。近年研究发现,核转录因子E47通过形成同源或异源二聚体,与E-cadherin基因上游启动子的顺式作用元件E-box结合抑制该基因表达,从而诱导EMT的发生[9]。LOXL2作为LOX氧化酶重要成员,有文献报道其与Snail协同作用引起E-cadherin基因沉默的转录而进一步促进EMT的发生[10]。为探讨E47和LOXL2在食管鳞癌组织中的作用,本研究采用qRT-PCR和免疫组织化学SP法检测E47和LOXL2在食管鳞癌及癌旁正常组织中的表达,并分析与临床病理特征的关系。结果显示,食管鳞癌组织中E47 mRNA和蛋白表达均高于癌旁正常组织,提示E47上调表达可能参与了食管鳞癌的发生和发展。同时发现,E47蛋白水平的表达变化与肿瘤的浸润深度密切相关,蛋白表达在侵及肌层组明显高于未侵及肌层组,说明E47蛋白表达越高,肿瘤细胞浸润越深。本研究结果与Cubillo等报道的E47在乳腺癌和恶性黑色素瘤中的表达相似[11]。Kim等[12]在胰腺癌PDA细胞系中发现E47过表达可诱导EMT,RNAi技术沉默E47基因表达后能减慢肿瘤细胞生长速度,同时促进肿瘤细胞的凋亡。Villarino等[13]通过对胰腺癌组织研究,认为E47通过激活p21,Rb磷酸化促进肿瘤细胞的形成及侵袭过程。因此,通过对食管磷癌组织中E47 mRNA和蛋白表达的检测,初步说明E47异常表达在食管磷癌的恶性生物学行为中发挥重要作用,其过表达可作为判断食管鳞癌预后的分子标志物。
LOXL2是一类细胞外基质修饰酶,基因定位于8p21.2~p21.3,正常情况下在前列腺、子宫、胎盘组织中有较高表达,而在其他组织中呈低表达[14]。近年来有文献报道LOXL2参与肿瘤的发生、发展,基因水平上调与非小细胞肺癌、肝内胆管细胞癌等肿瘤细胞侵袭、转移潜能相关,可能在肿瘤的演进过程中扮演极为关键的角色[15-16]。吴胜春等用慢病毒干扰载体转染人胃癌BGC823细胞后,可有效干扰细胞中LOXL2 mRNA和蛋白的表达,抑制肿瘤细胞生长和增殖[17]。Salvador等[18]研究显示,LOXL2可促进乳腺癌细胞迁移、侵袭和增殖,干扰乳腺癌细胞中的LOXL2表达,可明显抑制癌细胞恶性行为,且LOXL2过表达患者预后差及易发生淋巴结转移,认为LOXL2基因可能作用于EMT关键转录因子Snail,减弱由GSK3beta介导的Snail降解,从而降低E-cadherin的表达。本研究结果也显示,食管鳞癌组织中LOXL2 mRNA和蛋白表达均高于癌旁正常组织,提示LOXL2高表达与食管鳞癌的发生有关。同时发现LOXL2蛋白水平与分化程度、淋巴结转移密切相关,与Kurozumi等[19]在食管癌组织中的研究结果一致。进一步说明LOXL2基因表达上调促进食管癌的发生发展和侵袭转移。本研究还分析了E47和LOXL2蛋白的相关性,发现两者在食管鳞癌组织中的表达呈正相关。
综上所述,食管鳞癌组织中E47、LOXL2 mRNA和蛋白表达明显高于正常食管组织,并且与淋巴结转移、分化程度、浸润深度等临床病理特征密切相关。我们认为E47、LOXL2基因可能参与食管鳞癌的侵袭、转移,二者过度表达可作为判断食管癌预后的分子标志物。我们将进一步在体外细胞水平研究E47和LOXL2基因相互作用促进食管癌细胞迁移的分子调控机制。
| [1] | Lee SH, Hao E, Kiselyuk A, et al. The Id3/E47 axis mediates cell-cycle control in human pancreatic ducts and adenocarcinoma[J]. Mol Cancer Res, 2011, 9(6): 782–90. DOI:10.1158/1541-7786.MCR-10-0535 |
| [2] | Tiwari I, Yoon MH, Park BJ, et al. Hepatitis C virus core protein induces epithelial-mesenchymal transition in human hepatocytes by upregulating E12/E47 levels[J]. Cancer Lett, 2015, 362(1): 131–8. DOI:10.1016/j.canlet.2015.03.032 |
| [3] | Teng Y, Li X. The roles of HLH transcription factors in epithelial mesenchymal transition and multiple molecular mechanisms[J]. Clin Exp Metastasis, 2014, 31(3): 367–77. DOI:10.1007/s10585-013-9621-6 |
| [4] | Wu L, Zhu Y. The function and mechanisms of action of LOXL2 in cancer (Review)[J]. Int J Mol Med, 2015, 36(5): 1200–4. DOI:10.3892/ijmm.2015.2337 |
| [5] | Peng DH, Ungewiss C, Tong P, et al. ZEB1 induces LOXL2-mediated collagen stabilization and deposition in the extracellular matrix to drive lung cancer invasion and metastasis[J]. Oncogene, 2017, 36(14): 1925–38. DOI:10.1038/onc.2016.358 |
| [6] | 马红, 陈晓, 马海梅, 等. E-Cadherin、β-catenin和CathepsinD在食管鳞状细胞癌中的表达及其意义[J]. 世界华人消化杂志, 2008, 16(16): 1757–62. [ Ma H, Chen X, Ma HM, et al. Significance of E-cadherin, β-catenin and CathepsinD expression in esophageal squamous cell carcinoma[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2008, 16(16): 1757–62. DOI:10.3969/j.issn.1009-3079.2008.16.009 ] |
| [7] | 居来提·艾尼瓦尔, 李德生, 张力为, 等. 新疆2005~2008年伊犁地区食管癌患病情况调查研究[J]. 新疆医学, 2011, 41(10): 112–4. [ Julaiti AINWER, Li DS, Zhang LW, et al. Investigationof esophageal cancer prevalence in yili area from 2005 to 2008[J]. Xinjiang Yi Xue, 2011, 41(10): 112–4. DOI:10.3969/j.issn.1001-5183.2011.10.052 ] |
| [8] | Baulida J. Epithelial-to-mesenchymal transition transcription factors in cancer-associated fibroblasts[J]. Mol Oncol, 2017, 11(7): 847–59. DOI:10.1002/mol2.2017.11.issue-7 |
| [9] | Canesin G, Cuevas EP, Santos V, et al. Lysyl oxidase-like 2 (LOXL2) and E47 EMT factor: novel partners in E-cadherin repression and early metastasis colonization[J]. Oncogene, 2014, 34(8): 951–64. |
| [10] | Salvador F, Martin A, López-Menéndez C, et al. Lysyl Oxidase-like Protein LOXL2 Promotes Lung Metastasis of Breast Cancer[J]. Cancer Res, 2017, 77(21): 5846–59. DOI:10.1158/0008-5472.CAN-16-3152 |
| [11] | Cubillo E, Diaz-Lopez A, Cuevas EP, et al. E47 and Id1 Interplay in Epithelial-Mesenchymal Transition[J]. PLoS One, 2013, 8(3): e59948. DOI:10.1371/journal.pone.0059948 |
| [12] | Kim S, Lahmy R, Riha C, et al. The Basic Helix-Loop-Helix Transcription Factor E47 Reprograms Human Pancreatic Cancer Cells to a Quiescent Acinar State With Reduced Tumorigenic Potential[J]. Pancreas, 2015, 44(5): 718–27. DOI:10.1097/MPA.0000000000000328 |
| [13] | Villarino N, Signaevskaia L, Van Niekerk J, et al. A screen for inducers of bHLH activity identifies pitavastatin as a regulator of p21, Rb phosphorylation and E2F target gene expression in pancreatic cancer[J]. Oncotarget, 2017, 8(32): 53154–67. |
| [14] | Gilkes DM, Semenza GL, Wirtz D. Hypoxia and the extracellular matrix: drivers of tumour metastasis[J]. Nat Rev Cancer, 2014, 14(6): 430–9. DOI:10.1038/nrc3726 |
| [15] | Zhan P, Lv XJ, Ji YN, et al. Increased lysyl oxidase-like 2 associates with a poor prognosis in non-small cell lung cancer[J]. Clin Respir J, 2018, 12(2): 712–20. DOI:10.1111/crj.2018.12.issue-2 |
| [16] | Bergeat D, Fautrel A, Turlin B, et al. Impact of stroma LOXL2 overexpression on the prognosis of intrahepatic cholangiocarcinoma[J]. J Surg Res, 2016, 203(2): 441–50. DOI:10.1016/j.jss.2016.03.044 |
| [17] | 吴胜春, 杨永宾, 赵伟, 等. siRNA干扰LOXL2基因对人胃癌细胞株BGC823侵袭的影响及机制[J]. 河北医药, 2017, 39(2): 178–80. [ Wu SC, Yang YB, Zhao W, et al. Effect of RNA interference targeting at LOXL2 gene on the invasion of gastric cancer cell line-BGC823[J]. Hebei Yi Yao, 2017, 39(2): 178–80. ] |
| [18] | Salvador F, Martin A, López-Menéndez C, et al. Lysyl Oxidase-like Protein LOXL2 Promotes Lung Metastasis of Breast Cancer[J]. Cancer Res, 2017, 77(21): 5846–59. DOI:10.1158/0008-5472.CAN-16-3152 |
| [19] | Kurozumi A, Kato M, Goto Y, et al. Regulation of the collagen cross-linking enzymes LOXL2 and PLOD2 by tumor-suppressive microRNA-26a/b in renal cell carcinoma[J]. Int J Oncol, 2016, 48(5): 1837–46. DOI:10.3892/ijo.2016.3440 |
 2018, Vol. 45
2018, Vol. 45