文章信息
- 术后化疗对术后淋巴结阳性胸段食管鳞癌患者预后的影响
- Effect of Postoperative Chemotherapy on Prognosis of Postoperative Lymph Node-positive Thoracic Esophageal Squamous Cell Carcinoma Patients
- 肿瘤防治研究, 2018, 45(10): 762-767
- Cancer Research on Prevention and Treatment, 2018, 45(10): 762-767
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0118
- 收稿日期: 2018-02-06
- 修回日期: 2018-03-25
2. 050011 石家庄,石家庄市第一医院影像科
2. Department of Radiation, The First Hospital of Shijiazhuang, Shijiazhuang 050011, China
术后病理显示有无淋巴结转移是食管癌患者主要预后指标之一,淋巴结阳性患者预后显著差于淋巴结阴性患者,且其预后与淋巴结转移数目有关[1-4]。术后辅助治疗可提高部分术后淋巴结阳性食管癌患者的预后[5-8],目前研究对于术后化疗(postoperative chemotherapy, POCT)能否提高此部分患者的预后无明确结论[9-11]。为进一步明确POCT对术后淋巴结阳性胸段食管鳞癌(thoracic esophageal squamous cell carcinoma, TESCC)患者预后的影响,我们对单中心共419例患者进行了回顾性分析,以便为临床医师提供治疗参考。
1 资料与方法 1.1 入组及排除标准入组标准:(1)2007年1月—2010年12月在河北医科大学第四医院胸外科行根治性切除的胸段食管癌患者;(2)术后病理为鳞状细胞癌,且术后阳性淋巴结数≥1枚;(3)术前未行放疗、化疗及其他抗肿瘤治疗;(4)术后未行放疗或放化疗同步治疗;(5)KPS评分>80;(6)随访资料完整。
排除标准:(1)仅行开胸探查术和(或)姑息性手术;(2)非鳞状细胞癌患者;(3)术后行辅助性放疗/放化疗同步治疗;(4)相关资料记录不全者。
1.2 一般资料经筛选共有419例符合标准的患者入组,男310例,女109例,中位年龄60岁。胸上段29例,胸中段271例,胸下段119例;食管病变长度1.5~15.0 cm,中位5.0 cm;左侧开胸390例,右侧开胸29例;术中清扫淋巴结3~30枚,中位10枚。依据第八版食管癌分期标准,T1、T2、T3和T4期患者分别为27、63、293和36例;N1、N2和N3期患者分别为283、120和16例;ⅡB、ⅢA、ⅢB和ⅢC期患者分别为70、211、108和30例。全组单纯手术185例,术后辅助化疗234例。
1.3 术后化疗234例患者术后辅助化疗开始时间为术后1~6周,中位时间为术后3周。化疗疗程为1~6周期,中位4周期,其中完成1、2、3、4、5、6周期的患者分别为38、37、23、74、27和35例。化疗方案为LFP(亚叶酸钙200 mg/次,第1~5天,替加氟1 g/次,第1~5天;顺铂20 mg/次,第1~5天)的158例,TP(紫杉醇240 mg/次,第1天;顺铂20 mg/次,第1~5天)的59例;其他如卡铂联合紫杉醇或5-氟尿嘧啶联合奥沙利铂17例。化疗期间辅助止吐、增强免疫力及扶正等支持治疗。
1.4 随访全组患者随访截至2015年12月31日。采用门诊定期复诊和电话随访两种方式,以月为单位,入组病例随访至死亡或5年以上。随访满1、3、5年者分别有335、153和103例,截至随访日期共死亡332例。
1.5 统计学方法采用SPSSl9.0统计软件进行数据分析,应用Kaplan-Meier法计算总生存率及无瘤生存率,Cox回归模型行多因素预后分析;总生存率(overall survival, OS)计算定义死亡为截尾值,生存为删失值;无病生存(disease free survival, DFS)定义复发和(或)远处转移为截尾值,无复发和(或)远处转移及非肿瘤原因死亡为删失值。P < 0.05为差异有统计学意义。
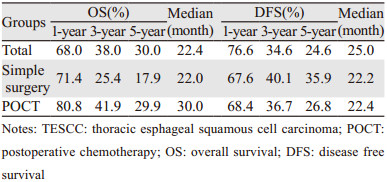
2 结果 2.1 生存情况结果显示单纯手术患者1、3、5年总生存期显著低于POCT组(χ2=12.802, P=0.000);而两组患者1、3、5年无病生存期差异未见统计学意义(χ2=1.159, P=0.282),见表 1。治疗结束至随访截止日期出现胸腔内-区域复发197例,出现远处转移120例,复发合并远处转移59例。
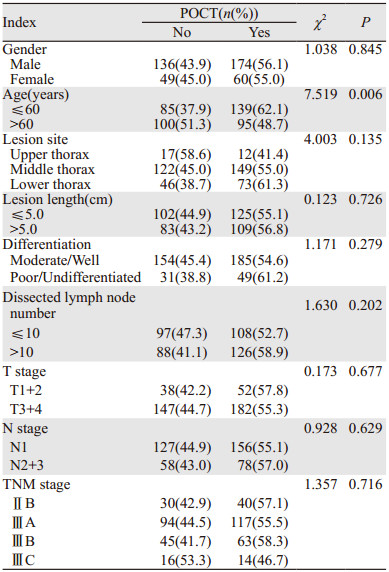
接受单纯手术治疗组和术后化疗组患者的构成比分析结果显示,后者年轻患者比率高于单纯手术组患者(χ2=7.519, P=0.006),其他临床病理资料构成比差异无统计学意义(P > 0.05),见表 2。
|
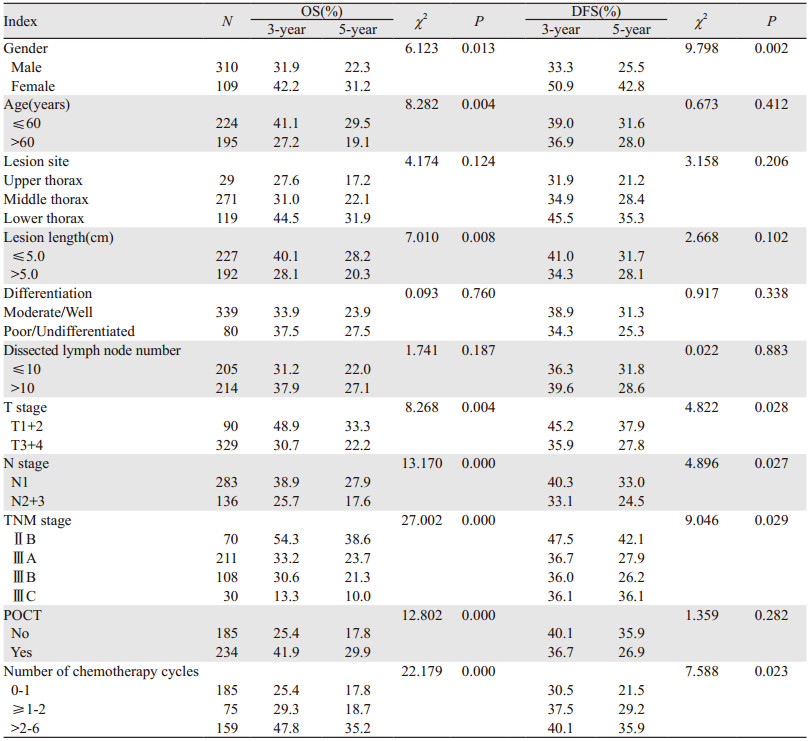
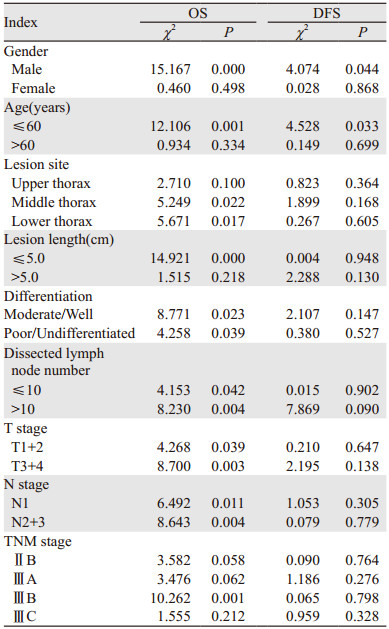
单因素分析结果显示女性、年龄≤60岁、病变长度≤5.0 cm、T、N、TNM分期较早、接受POCT和化疗周期数≥3个的患者OS均显著优于其他组患者(P < 0.05);而病变部位、肿瘤组织分化程度和术中清除淋巴结数目与OS无显著相关性(P > 0.05)。女性、T、N、TNM分期较早和化疗周期数≥3个的患者DFS均显著优于其他组患者(P < 0.05);而年龄、病变部位、病变长度、治疗方式、肿瘤组织分化程度和术中清除淋巴结数目与DFS无显著相关性(P > 0.05),见表 3。
|
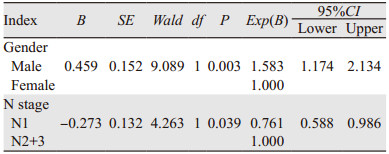
多因素分析结果显示,患者性别、年龄、病变部位、TNM分期、POCT和化疗周期数为患者OS的独立性预后影响因素(P < 0.05),见表 4;而患者性别、N分期为其DFS的独立性预后影响因素(P < 0.05),见表 5。

|
|
为进一步明确POCT对术后淋巴结阳性食管癌患者的预后影响,我们对患者的临床病理资料进行了分层分析,结果显示相对于单纯手术,POCT可以提高男性、年龄≤60岁、胸中下段病变、病变长度≤5.0 cm和ⅢB期患者的OS(P < 0.05);而且可以提高男性和年龄≤60岁患者的DFS(P < 0.05),见表 6。
|
术后病理显示淋巴结阳性为食管癌患者主要预后影响指标之一,即使患者进行了根治性切除术,仍有较高的失败率。NCCN指南指出:淋巴结转移阳性的食管癌,需行术前新辅助放化疗、术后辅助放化疗,以提高患者术后的生存率。然而,食管癌术前新辅助放化疗是否能明确提高亚洲人群的生存率目前缺少前瞻性大宗病例报告,而且日本临床肿瘤协会(Japan Clinical Oncology Group, JCOG)相关研究显示术后辅助治疗对于食管鳞癌患者尤为重要[12]。本研究对我院单中心共419例接受根治性切除术且术后病理显示淋巴结阳性的TESCC患者预后进行了回顾性分析,结果显示本组患者预后较差,5年OS和DFS分别为30%和24.6%,中位时间仅有22.4月和25.0月。相比与单纯手术组患者,POCT患者提高了患者的OS,而对提高DFS贡献不大。JCOG9204实验[11]对242例食管癌术后患者进行了不同治疗模式的研究,结果显示POCT组患者5年DFS高于单纯手术组(P=0.037),两者5年OS比较差异无统计学意义(P=0.130),但进一步亚组分析结果显示POCT可能可以提高淋巴结阳性患者的生存率。Lyu等[13]回顾性分析了349例经左侧开胸的胸段食管癌术后患者,所有患者术后病理淋巴结为阳性,研究分单独手术、术后放疗和术后化疗三组,结果显示单纯手术组患者的3年OS为47.7%,术后放疗组为44.0%,术后化疗组为58.9%,多因素分析显示术后辅助化疗为独立性预后影响因素。Hashiguchi等[14]回顾性分析139例术后淋巴结阳性食管鳞癌患者,结果显示术后化疗可以提高pN2期患者的5年OS和DFS。本研究结果显示POCT可以提高食管癌术后淋巴结阳性患者的OS,而不能提高患者的DFS,可能与以下原因有关:(1)本研究为回顾性病例资料,在一定程度上存在其固有的病例入组缺点,例如淋巴结清扫术数目总体偏低等;(2)本研究接受POCT患者的开始时间、周期数及用药均不统一,在一定程度上影响了研究结果;(3)POCT可能在解决术中肿瘤细胞脱落或已存在远处转移等问题有一定疗效,在降低患者局部复发方面的作用较弱,而食管癌术后局部区域复发为其主要失败模式之一,这也可能是本组患者DFS未见显著提高的原因。
食管癌术后患者预后影响因素众多,各家报道不一,Duan等[15]回顾性分析2006—2010年在天津医科大学附属肿瘤医院收治的328例食管癌根治术后辅助化疗的临床病理资料,多因素分析结果显示,患者性别、肿瘤长度、T分期、N分期和化疗周期数为可以预测患者无病生存期和总生存期的独立性因素。我院胸外科齐战等[16]对329例术后淋巴结阳性胸段食管鳞癌患者接受化疗的情况进行了分析,其多因素分析结果显示:原发肿瘤位置、TNM分期和术后化疗是影响患者总生存的独立因素,而且原发肿瘤位置和TNM分期是影响患者无进展生存的独立因素。本研究结果与上述文献报道结果相似。由于本研究为回顾性资料,因此对于化疗周期数未进行明确规定,但对于不同化疗周期情况的亚组分析结果显示≥3周期患者的预后明显优于周期数较少的患者,且为影响患者OS的独立性因素。刘爱娜等[17]对138例食管癌患者化疗情况进行了分析,其结果显示接受化疗周期数较多组患者的中位生存期和2年OS均显著优于周期数少者,且化疗周期数为影响患者预后的因素之一。综上,我们建议在选择有效的化疗方案及患者耐受的基础上,尽可能完成必要的化疗周期,以改善患者的预后。
为进一步明确术后淋巴结阳性TESCC患者接受POCT后的受益人群,我们进行了进一步亚组分析,结果显示POCT可以提高男性和年龄≤60岁患者的OS和DFS,同时还能提高胸中下段病变、病变长度≤5.0 cm和ⅢB期患者的OS。与本研究结果相似的是齐战等[16]的研究,其亚组分析同样显示POCT可以提高男性、年龄≤60岁、肿瘤长度 < 6 cm、中高分化鳞癌、pT3期、pN2期和ⅢB期患者的生存时间(P < 0.05),且可以提高男性和ⅢB期患者的无进展生存时间(P < 0.05)。于舒飞等[18]同样认为淋巴结阳性的胸中、下段食管癌术后预防性调强放疗同期紫杉醇+顺铂周方案在合理缩小靶区下是安全、有效的。邵国光等[19]对110例N1期食管鳞癌患者的辅助治疗情况进行了分析,其中单纯手术组46例,POCT组24例,POCRT40例,结果显示与单纯手术组患者相比,POCT可以提高N1期食管鳞癌术后患者的预后,且可以提高T3N1M0期(ⅢB期)患者的预后。由于解剖位置、淋巴结清扫范围及程度和手术方式等不同,接受根治性切除术的胸中下段食管鳞癌患者预后好于胸上段患者,并已得到临床多数研究证实,本研究入组患者的手术方式主要为左侧开胸术,因此在一定程度上制约了胸上段食管癌患者的淋巴结清扫程度。因此建议对于男性、年龄≤60岁、胸中下段病变、病变长度≤5.0 cm和ⅢB期TESCC患者进行POCT,以提高患者的预后。
综上所述,根治术后淋巴结阳性TESCC患者的疗效并不理想,POCT的作用目前仍不明确,对于术后放疗的加入是否可以对POCT起到补充作用也不完全明了,同时有研究表明不同的化疗药物亦对患者的预后有影响[20],因此POCT是否可提高此部分患者的预后,需要进行进一步的前瞻性随机对照研究。
| [1] | Akutsu Y, Matsubara H. The significance of lymph nodes status as a prognostic factor for esophageal cancer[J]. Surg Today, 2011, 41(9): 1190–5. DOI:10.1007/s00595-011-4542-y |
| [2] | Xiao ZF, Yang ZY, Miao YJ, et al. Influence of number of metastatic lymph nodes on survival of curative resected thoracic esophageal cancer patients and value of radiotherapy: report of 549 cases[J]. Int J Radiat Oncol Biol Phys, 2005, 62(1): 82–90. |
| [3] | Chen J, Pan J, Zheng X, et al. Number and location of positive nodes, postoperative radiotherapy, and survival after esophagectomy with three-field lymph node dissection for thoracic esophageal squamous cell carcinoma[J]. Int J Radiat Oncol Biol Phys, 2012, 82(2): 475–82. |
| [4] | Schreiber D, Rineer J, Vongtama D, et al. Impact of postoperative radiation after esophagectomy for esophageal cancer[J]. J Thorac Oncol, 2010, 5(2): 244–50. DOI:10.1097/JTO.0b013e3181c5e34f |
| [5] | Chen J, Zhu J, Pan J, et al. Postoperative radiotherapy improved survival of poor prognostic squamous cell carcinoma esophagus[J]. Ann Thorac Surg, 2010, 90(2): 435–42. DOI:10.1016/j.athoracsur.2010.04.002 |
| [6] | Hsu PK, Huang CS, Wang BY, et al. Survival benefits of postoperative chemoradiation for lymph node-positive esophageal squamous cell carcinoma[J]. Ann Thorac Surg, 2014, 97(5): 1734–41. DOI:10.1016/j.athoracsur.2013.12.041 |
| [7] | Xiao ZF, Yang ZY, Liang J, et al. Value of radiotherapy after radical surgery for esophageal carcinoma: a report of 495 patients[J]. Ann Thorac Surg, 2003, 75(2): 331–6. |
| [8] | Qin RQ, Wen YS, Wang W, et al. The role of postoperative adjuvant chemotherapy for lymph node-positive esophageal squamous cell carcinoma: a propensity score matching analysis[J]. Med Oncol, 2016, 33(4): 31. DOI:10.1007/s12032-016-0746-8 |
| [9] | Armanious M, Xu R, Forastiere AA, et al. Adjuvant chemotherapy for resected adenocarcinoma of the esophagus, gastro-esophageal junction, and cardia: phaseⅡ trial(E8296) of the Eastern Cooperative Oncology Group[J]. J Clin Oncol, 2004, 22(22): 4495–9. DOI:10.1200/JCO.2004.06.533 |
| [10] | Zhang J, Chen HQ, Zhang YW, et al. Adjuvant chemotherapy in oesophageal cancer:a meta-analysis and experience from the Shang hai Cancer Hospital[J]. J Int Med Res, 2008, 36(5): 875–82. DOI:10.1177/147323000803600502 |
| [11] | Ando N, Iizuka T, Ide H, et al. Surgery plus chemotherapy compared with surgery alone for localized squamous cell carcinoma of the thoracic esophagus: a Japan Clinical Oncology Group Study-JCOG9204[J]. J Clin Oncol, 2003, 21(24): 4592–6. |
| [12] | Kitagawa Y, Ando N, Nakamura K, et al. The role of adjuvant chemotherapy for localized squamous cell esophageal cancer: current Japanese standard and the unending role of the drawing board[J]. Ann Surg Oncol, 2012, 19(5): 1425–7. DOI:10.1245/s10434-012-2250-5 |
| [13] | Lyu X, Huang J, Mao Y, et al. Adjuvant chemotherapy after esophagectomy: is there a role in the treatment of the lymph node positive thoracic esophageal squamous cell carcinoma?[J]. J Surg Oncol, 2014, 110(7): 864–8. DOI:10.1002/jso.v110.7 |
| [14] | Hashiguchi T, Nasu M, Hashimoto T, et al. Docetaxel, cisplatin and 5-fluorouracil adjuvant chemotherapy following three-field lymphoned dissection for stage Ⅱ/Ⅲ N1, 2 esophageal cancer[J]. Mol Clin Oncol, 2014, 2(5): 719–24. |
| [15] | Duan J, Deng T, Ying G, et al. Prognostic nomogram for previously untreated patients with esophageal squamous cell carcinoma after esophagectomy followed by adjuvant chemotherapy[J]. Jpn J Clin Oncol, 2016, 46(4): 336–43. DOI:10.1093/jjco/hyv206 |
| [16] | 齐战, 王玉祥, 杨琼, 等. 食管鳞癌术后病理淋巴结阳性患者的预后及其术后化疗的作用[J]. 中华肿瘤杂志, 2017, 39(8): 628–34. [ Qi Z, Wang YX, Yang Q, et al. Survival and the value of adjuvant chemotherapy in esophageal squamous cell carcinoma patients with lymphatic metastasis[J]. Zhonghua Zhong Liu Za Zhi, 2017, 39(8): 628–34. DOI:10.3760/cma.j.issn.0253-3766.2017.08.013 ] |
| [17] | 刘爱娜, 黄镜, 蔡锐刚, 等. 138例晚期食管癌的化疗疗效和预后因素分析[J]. 癌症, 2008, 27(4): 400–6. [ Liu AN, Huang J, Cai RG, et al. Responses of advanced esophageal cancer to chemotherapy and prognostic factors: a report of 138 cases[J]. Ai Zheng, 2008, 27(4): 400–6. DOI:10.3321/j.issn:1000-467X.2008.04.012 ] |
| [18] | 于舒飞, 章文成, 王奇峰, 等. 淋巴结阳性食管癌术后预防性IMRT同期化疗的临床Ⅰ期研究[J]. 中华放射肿瘤学杂志, 2016, 25(1): 26–30. [ Yu SF, Zhang WC, Wang QF, et al. Postoperative prophylactic concurrent radiochemtherapy for node-positive esophageal squamors cell carcinoma: a phase Ⅰ clinical study[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2016, 25(1): 26–30. DOI:10.3760/cma.j.issn.1004-4221.2016.01.008 ] |
| [19] | 邵国光, 郭晔, 王星星, 等. 110例N1期食管鳞癌术后辅助治疗疗效分析[J]. 中华肿瘤杂志, 2016, 38(1): 55–62. [ Shao GG, Guo Y, Wang XX, et al. Efficacy of adjuvant therapy in 110 patients with N1 lymph node metastasis of esophageal squamous cell carcinoma[J]. Zhonghua Zhong Liu Za Zhi, 2016, 38(1): 55–62. DOI:10.3760/cma.j.issn.0253-3766.2016.01.011 ] |
| [20] | Courrech Staal EF, Aleman BM, van Velthuysen ML, et al. Chemoradiation for esophageal cancer institutional experience with three different regimens[J]. Am J Clin Oncol, 2011, 34(4): 343–9. |
 2018, Vol. 45
2018, Vol. 45