文章信息
- TEC酪氨酸蛋白激酶在肝癌组织中高表达并参与肝癌耐药
- TEC Expresses Highly in Hepatocellular Carcinoma and Is Involved in Drug Resistance
- 肿瘤防治研究, 2018, 45(9): 660-665
- Cancer Research on Prevention and Treatment, 2018, 45(9): 660-665
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0107
- 收稿日期: 2018-03-22
- 修回日期: 2018-06-27
2. 230032 合肥,安徽医科大学基础医学院病理生理学教研室
2. Pathophysiology Department, School of Basic Medical Science, Anhui Medical University, Hefei 230032, China
肿瘤化疗失败的原因除化学药物的副作用外,主要就是肿瘤细胞对化疗药物产生耐药。肿瘤耐药的机制目前仍然不清楚。TEC是一类非受体型酪氨酸激酶家族(TEC, Btk, Itk/Emt/Tsk, Etk/Bmx和Txk/RIK)中的一员,人和小鼠的TEC基因最早由Mano等克隆[1-2]。我们在肝再生机制研究中发现了大鼠的TEC基因并认为其参与HGF信号通路,是肝再生的早期反应基因。进一步研究发现TEC在耐药的人口腔表皮样癌KBV细胞株中明显高于非耐药KBS细胞株,提示其可能参与肿瘤耐药[3]。本研究在检测肝癌组织中TEC表达的的基础上, 分析其与药物敏感度的关系、药物诱导与TEC表达水平是否发生变化,并在肝癌HepG2细胞系中探索TEC表达水平的改变对其药物敏感度的影响及机制。
1 材料与方法 1.1 实验材料实验材料:HepG2人肝癌细胞株购自ATCC细胞库,用含10%FBS、1%双抗的DMEM完全培养液保存于本室,在37℃、5%CO2培养箱中培养。pcDNA3.1-Tec真核表达载体由本实验室构建保存,TEC siRNA购自上海吉玛公司。TEC抗体(sc-1109,Santa Cruz,美国)、actin(60009,Proteintech,美国)、ERK(CST4695S,Cell Signaling Technology,美国)、p-ERK(BS4621,Bioworld,上海)、py99(sc-7020,Santa Cruz,美国)。阿霉素(1 μmol/L)、长春新碱(1μmol/L)及顺铂(1 μmol/L)购自深圳万东药业公司。PVDF膜为Millipore公司产品。DMEM(C11965500CP)、杂交液购自美国Life Technologies公司。胎牛血清(11011-8611)为中国四季青公司产品。探针标记试剂盒(Prime-a-Gene Labeling System)购自美国Promega公司。
1.2 实验方法 1.2.1 肝癌、癌旁组织收集及RNA、蛋白提取48例肝癌组织取自2003—2005年安徽医科大学第一附属医院,18例肝癌和癌旁组织取自2016—2017年安徽省立医院(项目经安徽医科大学生物医学伦理委员会论证通过)。所有患者术前均未接受放化疗或射频消融等治疗,术后经病理诊断为肝细胞癌。在2 ml EP管中放入组织标本(约50 mg),加入1 ml TRIzol(上海康为世纪公司CW0580A),匀浆,加入0.2 ml氯仿,离心后取上清液,加入上清液等体积的异丙醇沉淀总RNA,75%乙醇洗涤,RNase-free H2O溶解总RNA。
收集肝癌组织,PBS洗2次,剪碎后匀浆,加入RIPA全裂解液裂解提取细胞的总蛋白。肝癌组织标本经中性福尔马林固定,脱水,制成蜡块,2 μm厚连续切片,常规脱蜡,3%H2O2孵育5 min,TEC蛋白一抗4℃孵育过夜,室温使用对应二抗(E-AB-1001, Elabscience, USA))孵育15~20 min,辣根酶标记工作液(PV-6000,北京中杉金桥公司)孵育15 min,DAB(ZLI-9017,北京中杉金桥公司)显色,孵育5 min,苏木精(H8070,北京Solarbio公司)染色3 min,0.5%盐酸乙醇分化10 s,依次经过70%、95%、无水乙醇孵育各3 min复水,二甲苯孵育3 min,透明后封片,显微镜下拍照观察。
1.2.2 mRNA及蛋白水平检测用ReadyScript® cDNA Synthesis Mix将总RNA反转录成cDNA,然用SYBR Green PCR试剂盒进行real-time PCR实验。引物序列为:正义链:5′-GAAGAAACTTTTGGAAGA-3′,反义链:5′-AGGTGGGTTCCTGCTTT-3′(吉玛,上海)。
TEC探针的标记按Prime-a-Gene Labeling System试剂盒(Promega公司)说明书操作。PCR产物100℃变性后,加入DNA聚合酶ⅠKlenow片段, 无核酸酶的BSA,10 μl 5×标记缓冲液,1 μl dNTPs混合物(C, G, T),[α-32P]dATP,2.5 μl 3 000 Ci/mmol,混匀室温放置1 h,95℃ 2 min后终止反应,冰上冷却。SepharoseG50纯化后做狭线杂交(slot blot),总RNA定量后,加入30 μl RNA变性液,65℃水浴加热5 min,冰上冷却,加入等体积20×SSC混匀。取20 μg样品分别加入狭线孔中,用抽滤点膜装置HYBRI-SLOTTM(GIBCO-BRL,美国)将总RNA点于基因转移杂交转移膜(GeneScreen Plus Hybridization Transfer Membrane(DUPONT))进行杂交,-70℃放射自显影24 h后定影。在X线片上有肉眼可见条带显影者为TEC高表达,无明显显影条带者为低表达。
用10%SDS-PAGE凝胶进行电泳,蛋白经湿法电转至PVDF膜上,先用5%脱脂奶粉常温封闭1.5 h,TBST缓冲液洗膜,再加入TEC(1:500)蛋白的特异性抗体4℃孵育过夜,次日TBST洗膜,加辣根过氧化物酶标记的二抗(1:5 000)常温孵育2 h,TBST洗膜3次,每次10 min,随后用凝胶成像仪显影,拍照,并用Quantity One软件(version 4.62,Bio-Rad公司,美国)对蛋白条带进行灰度分析。
1.2.3 MTT法检测肝癌细胞对药物的敏感度用含5%FBS无菌PBS缓冲液从临床手术室收集肝癌组织,无菌操作情况下,将肝癌组织剪成1 mm3大小组织块,放入200目尼龙网磨碎,制备细胞悬液,percoll分层去除非实质细胞。使用锥虫蓝染色计数细胞活率,分别按每孔8×103个活细胞的密度接种于96孔板中,37℃、5%CO2培养24 h后分别加入1 μmol/L阿霉素、长春新碱或者顺铂处理,分别作用12、24、48、72 h后进行MTT检测。每孔加入20 μl浓度为5 mg/ml的MTT,继续培养4 h后弃培养液,每孔加入150 μl DMSO,常温振荡10 min后在490 nm波长处测定吸光度值,比较细胞的增殖活性。
1.2.4 真核表达载体在肝癌细胞中过表达TECHepG2细胞培养于含100 g/L FBS的高糖DMEM培养液中, 同时含有100 000 IU/L青链霉素(转染时不加双抗)和10 g/L的L-谷氨酰胺。在37℃、50 ml/L CO2培养箱中培养。待细胞融合度达80%左右转染,分别设转染组(TEC真核表达质粒)、空载组和空白组,除空白组外每孔分取质粒2 µg和脂质体LipofectamineTM 2000 6 µl用Opti-MEM®ⅠReduced Serum Medium稀释至200 µl, 两者混匀后室温放置5 min, 使之形成复合物后加入,转染5 h后每孔补加2 ml含10%FBS的高糖DMEM培养液。转染24 h后, 将三组细胞分别按5×103个/孔的密度接种于96孔板中,24 h后分别加入阿霉素(adriamycin, Adm, 1 μmol/L)、长春新碱(cincristine, VCR, 1 μmol/L)及顺铂(cis-platinum, CDDP, 1 μmol/L)。分别作用3、6 h后每孔加入20 μl浓度为5 mg/ml的MTT液,4 h后加入150 μl DMSO,常温振荡10 min后在490 nm波长处测定吸光度值,比较细胞的增殖活性。
1.2.5 RNA干扰技术在肝癌细胞中敲低TECHep-G2细胞培养于含100 g/L FBS的高糖DMEM培养液中培养。分别设转染组(siRNA-TEC)、空载组和空白组,转染方法同1.2.4。24 h后分别加入Adm, VCR, CDDP处理。分别作用1、3 h后进行MTT检测。TEC反义核酸合成引物:5’-TGAAATTCATCTCGGTCT-3’,TEC正义核酸合成引物:5’-AGACCGAGATGAATTTCA-3’,序列设计参考前期发表文章[4],使用https://www.genscript.com/ssl-bin/app/rnai,序列合成由美国Invitrogen公司完成。
1.2.6 化疗药物诱导肝癌细胞用Adm, VCR, CDDP(浓度同前)三种化疗药物分别处理HepG2细胞株1、3、5 h后,提取细胞总蛋白,Western blot法检测TEC表达水平,10% SDS-PAGE凝胶进行电泳,蛋白经湿法电转至PVDF膜上,先用5%脱脂奶粉常温封闭1.5 h,TBST缓冲液洗膜,再加入TEC(1:500),ERK(1:500)、p-ERK(1:500)、py99(1:500)抗体4℃孵育过夜,次日TBST洗膜,加辣根过氧化物酶标记的二抗(1:5 000)常温孵育2 h,TBST洗膜3次,每次10 min,凝胶成像仪显影,拍照分析。
1.2.7 用免疫共沉淀技术结合酪氨酸磷酸化抗体检测TEC磷酸化活化水平用Adm、VCR、CDDP(浓度同前)分别处理HepG2细胞株1、3 h后,将细胞沉淀加100 μl RIPA裂解细胞,冰浴裂解,取上清液加入酪氨酸磷酸化抗体,4℃孵育2 h。加入5 μl Agrose A/G Beads和5 μl(1 μg)抗体计匀速旋转过夜。4℃、3 000 r/min离心3 min,弃上清液。加入35 μl的1×裂解液和等体积2×SDS上样缓冲液,混匀后煮沸10 min,10%SDS-PAGE凝胶电泳,转膜、封闭,加入一抗4℃过夜孵育及相应的二抗室温孵育1 h,随后用凝胶成像仪显影,拍照分析。
1.3 统计学方法采用SPSS20.0统计软件对数据进行分析。计数资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析和LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 TEC在肝癌组织中的高表达qPCR检测结果显示,18例肝癌患者组织标本中,TEC mRNA表达明显高于癌旁组织(P=0.0009),Western blot法和免疫组织化学法检测结果显示,同批标本中,TEC蛋白在肝癌组织中表达水平也显著高于癌旁组织,见图 1。
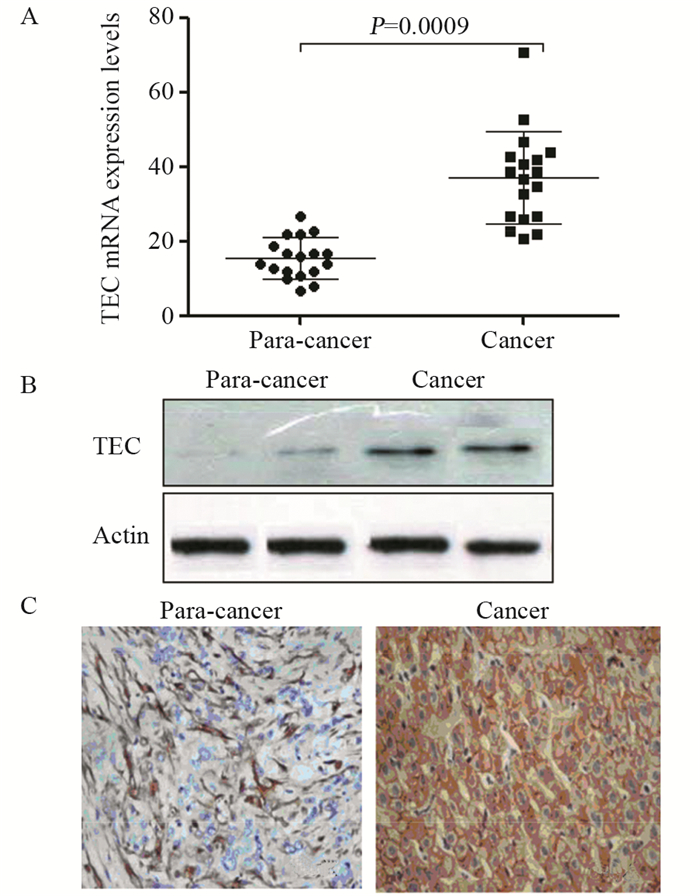
|
| A, B, C: the mRNA levels, the protein levels, the in situ expression of TECs in para-cancer tissues and cancer tissues of HCC patients detected by qPCR, Western blot, IHC staining, respectively (IHC ×400) 图 1 TEC mRNA和蛋白在肝癌组织中的表达(n=18) Figure 1 TEC mRNA and protein expression observed in hepatocellular carcinoma(HCC) tissues and paracancerous tissues (n=18) |
同位素标记的TEC探针检测结果显示,有35例组织TEC表达呈阳性(高表达组),13例组织TEC表达呈阴性(低表达组),见图 2A。MTT检测结果发现,在使用阿霉素(1 μmol/L)、长春新碱(1 μmol/L)及顺铂(1 μmol/L)三种化疗药物分别刺激后,TEC mRNA高表达的肝癌组织对化疗药物敏感度显著低于低表达组,见图 2B。
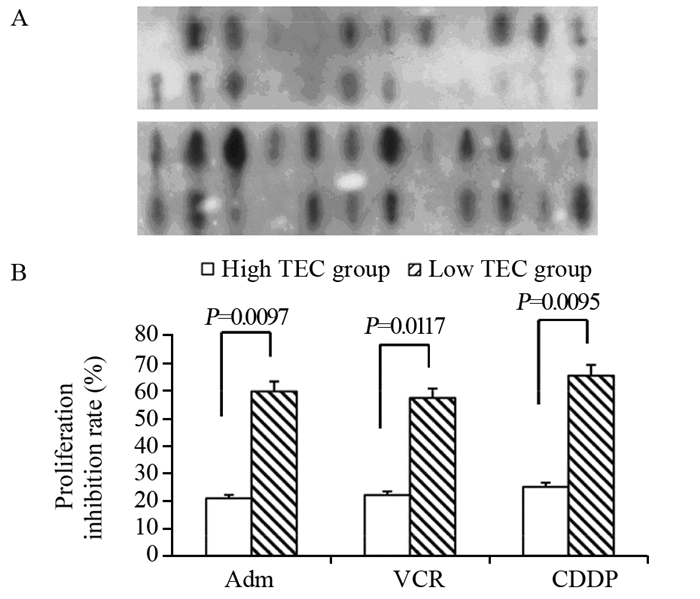
|
| A: TEC mRNA expression was detected in the 48 HCC tissues using RNA slot blot; B: the tumor cells were isolated from cancer tissues, and stimulated with Adm, VCR and CDDP. The cells proliferation was detected by MTT method 图 2 TEC高表达肝癌组织对化疗药物耐受性强 Figure 2 High expression of TEC in HCC tissues was associated with multidrug resistance |
过表达TEC的HepG2细胞(pcDNA3.1-TEC组)对化疗药物敏感度显著降低。相反,用干扰RNA敲低TEC表达的HepG2细胞(TEC-si组)对化疗药物敏感度显著提高,见图 3。
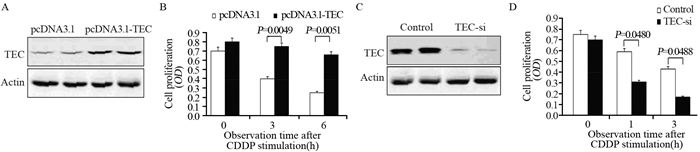
|
| A: the TEC protein expression levels after transfection of TEC-plasmid in HepG2 cells; B: the proliferation of HepG2 cells was detected after transfection of TEC plasmid and stimulation of CDDP; C: the TEC protein expression levels after transfection of TEC siRNA in HepG2 cells; D: The proliferation of HepG2 cells was detected after transfection of TEC siRNA and stimulation of CDDP 图 3 TEC表达改变影响肝癌细胞HepG2对化疗药物耐受性 Figure 3 Modulated TEC expression in HepG2 cells was associated with drug resistance |
为进一步研究肝癌的耐药是否与TEC有关,用阿霉素(1 μmol/L)、长春新碱(1 μmol/L)及顺铂(1 μmol/L)三种化疗药物分别处理HepG2细胞株,检测TEC表达水平。发现化疗药物可以显著诱导肝癌细胞TEC表达上调。由于缺乏TEC磷酸化抗体,用免疫共沉淀技术结合酪氨酸磷酸化抗体发现:在化疗药物诱导下,TEC磷酸化活化水平也显著提高,见图 4。
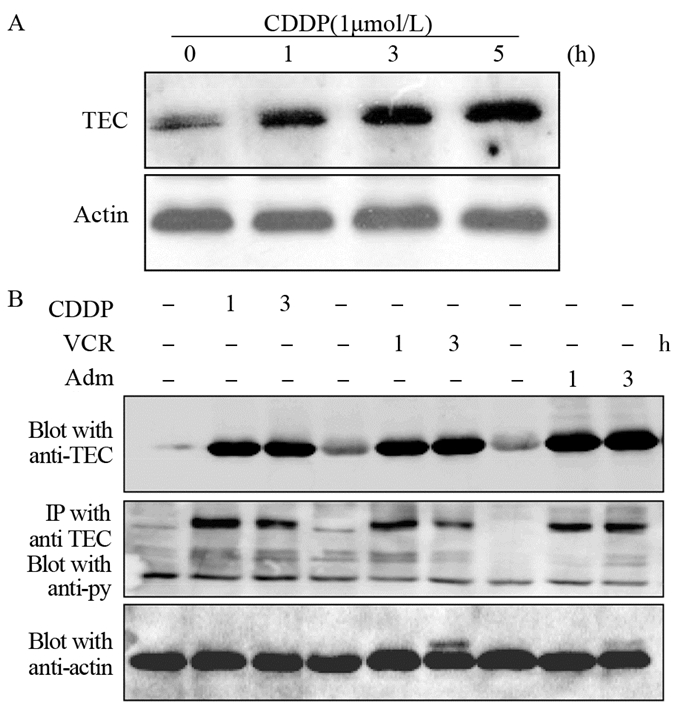
|
| A: the TEC expression level was detected after CDDP stimulation of HepG2 cells; B: the interaction between TEC and py99 was detected after stimulation of CDDP, VCR and Adm, respectively. 图 4 化疗药物处理肝癌细胞HepG2诱导TEC表达并活化 Figure 4 HepG2 cells stimulated by chemotherapy drugs induced TEC expression and activation |
在化疗药物处理肝癌细胞,诱导TEC表达增高的同时,ERK磷酸化水平也显著提高,提示MAPK通路的异常活化,见图 5。
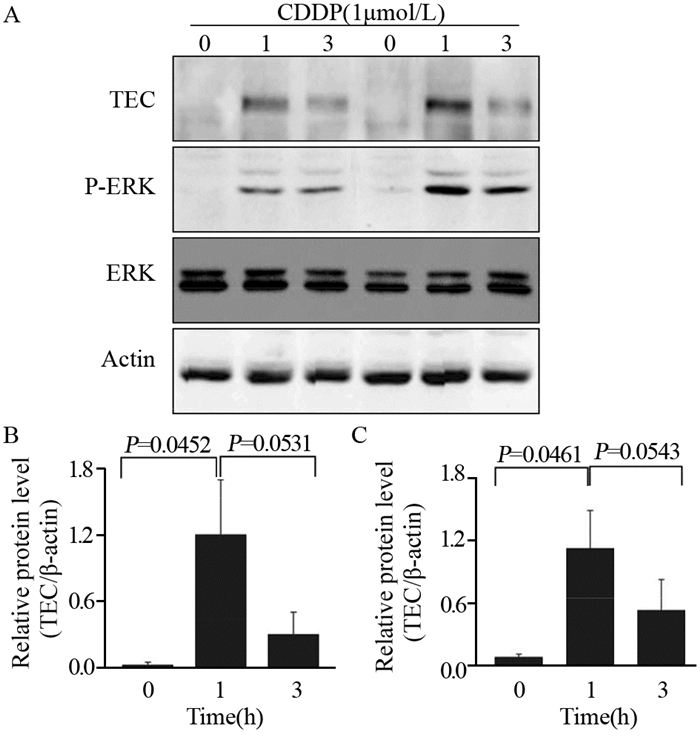
|
| A: The expressions of TEC, p-ERK, ERK and actin were detected by Western blot; B: Protein expression of TEC was quantified by band intensity and normalized to β-actin; C: ERK phosphorylation was quantified by band intensity and normalized to total ERK 图 5 药物诱导的肝癌HepG2细胞TEC高表达促进Erk磷酸化 Figure 5 High expression of TEC in HepG2 cells stimulated by CDDP activated ERK phosphorylation |
肝癌的耐药是其化疗面临的主要问题,目前机制不清。近来研究者发现多种蛋白激酶介导的细胞信号途径可能参与了包括肝癌在内的多种肿瘤多药耐药,一些蛋白激酶通过激活ERK或STAT3/5信号通路、磷酸化p-gp等参与肿瘤多药耐药的形成[5-6]。TEC是一类非受体型酪氨酸蛋白激酶,主要表达于血液和肝组织,尤其在肝癌组织中高表达,是首类被报道的与肝细胞增殖有关的蛋白激酶[3],但是在肝癌组织中高表达的意义并不十分清楚。
本研究中,我们首先用qPCR、Western blot及免疫组织化学方法证实了TEC mRNA或者蛋白在肝癌组织中表达明显高于癌旁组织。随后用收集的48例肝癌组织同步进行TEC检测及药物敏感度实验,结果发现,高表达TEC mRNA的肝癌组织细胞对阿霉素、长春新碱、顺铂三种化疗药物敏感度明显降低,结合我们以前发现TEC在耐药的KBV细胞中高表达,在不耐药的KBS细胞中低表达,提示TEC可能参与了肝癌的耐药[3]。进一步研究发现,高表达TEC的肝癌HepG2细胞对化疗药物敏感度明显下降,相反,用小干扰RNA敲低TEC表达的HepG2细胞对化疗药物的敏感度显著提高,证明了TEC的表达水平与肝癌耐药有关。
蛋白激酶参与肿瘤耐药的机制可能与其激活细胞内增殖信号通路或者抑制细胞凋亡信号通路有关,已经发现TEC家族中另外一个成员Etk/BMX通过调控P53诱导膀胱癌细胞抗凋亡而产生耐药[7]。本实验发现,在化疗药物处理肝癌HepG2细胞时,TEC蛋白可以被诱导表达,同时其磷酸化水平升高,提示TEC活化,同时,ERK磷酸化水平明显升高,提示MAPK信号通路活化[8]。前期荧光素酶报告基因的实验结果[9]也发现TEC对MAPK通路具有活化作用。MAPK信号通路主要与细胞增殖有关, 已有报道MAPK信号通路异常活化时,细胞对化疗药物抵抗性增强[4, 10],揭示了化疗药物诱导TEC增加和活化导致肝癌耐药的机制。
目前认为,化疗药物主要通过线粒体途径诱导细胞的凋亡。因此肿瘤产生化疗药物耐药性的主要机制之一很有可能是因为肿瘤恶性化过程中与凋亡相关途径相关的基因产生突变。本研究发现TEC高表达与肿瘤耐药性的发生有关。这种耐药性的升高表现为细胞增殖能力的提高,以及化疗药物对肝癌细胞杀伤功能的降低,然而,相关机制目前并不清楚。有研究认为Bcl-2途径是线粒体相关的凋亡信号中关键蛋白,通过激活BAK蛋白,在多种凋亡途径中起到信号整合的作用[8]。有研究报道,酪氨酸激酶BMX对BAK有负调控作用,并能够维持BAK的非活性构象[11]。BMX表达升高可以抑制化疗药物诱导的BAK活化,直接导致抗凋亡能力上升,以及患者生存率降低。值得我们关注的是,敲除BMX导致MAPK磷酸化抑制[12]。作为与BMX同家族的TEC蛋白,有可能通过同样的信号通路诱导肿瘤细胞耐药性的提高。因此推测,TEC表达增加,可能通过影响线粒体相关凋亡途径以及增强MAPK信号途径的活化介导肝癌耐药。
致谢
感谢为本研究提供肝癌组织样本的安徽省立医院马金良主任、安徽医科大学第一附属医院徐阿曼主任!
| [1] | Qiu L, Wang F, Liu S, et al. Current understanding of tyrosine kinase BMX in inflammation and its inhibitors[J]. Burns Trauma, 2014, 2(3): 121–4. DOI:10.4103/2321-3868.135483 |
| [2] | Horwood NJ, Urbaniak AM, Danks L. TEC family kinases in inflammation and disease[J]. Int Rev Immunol, 2012, 31(2): 87–103. DOI:10.3109/08830185.2012.670334 |
| [3] | 李菲菲, 郑红, 许望翔, 等. 肝大部切除或HGF刺激可以引起STAT3和TEC的同时激活[J]. 世界华人消化杂志, 2004, 12(12): 2809–12. [ Li FF, Zheng H, Xu WX, et al. Activation of TEC and STAT3 after partial hepatectomy or hepatocytic growth factor stimulation[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2004, 12(12): 2809–12. DOI:10.3969/j.issn.1009-3079.2004.12.009 ] |
| [4] | Lake D, Corrêa SA, Müller J. Negative feedback regulation of the ERK1/2 MAPK pathway[J]. Cell Mol Life Sci, 2016, 73(23): 4397–413. DOI:10.1007/s00018-016-2297-8 |
| [5] | Wang Y, Sun H, Xiao Z, et al. XWL-1-48 exerts antitumor activity via targeting topoisomerase Ⅱ and enhancing degradation of Mdm2 in human hepatocellular carcinoma[J]. Sci Rep, 2017, 7(1): 9989–96. DOI:10.1038/s41598-017-10577-7 |
| [6] | Guan SS, Wu CT, Chiu CY, et al. Polyethylene glycol-conjugated HER2-targeted peptides as a nuclear imaging probe for HER2-overexpressed gastric cancer detection in vivo[J]. J Transl Med, 2018, 16(1): 168. DOI:10.1186/s12967-018-1550-3 |
| [7] | Cenni B, Gutmann S, Gottar-Guillier M. BMX and its role in inflammation, cardiovascular disease, and cancer[J]. Int Rev Immunol, 2012, 31(2): 166–73. DOI:10.3109/08830185.2012.663838 |
| [8] | Fox JL, Storey A. BMX Negatively Regulates BAK Function, Thereby Increasing Apoptotic Resistance to Chemotherapeutic Drugs[J]. Cancer Res, 2015, 75(7): 1345–55. DOI:10.1158/0008-5472.CAN-14-1340 |
| [9] | 钟明贵, 李菲菲, 郑红, 等. Tec酪氨酸蛋白激酶的大鼠组织分布及参与的信号途径[J]. 世界华人消化杂志, 2006, 14(19): 1874–7. [ Zhong MG, Li FF, Zheng H, et al. Tissue distribution and signal transduction of Tec tyrosine kinase in rats[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2006, 14(19): 1874–7. DOI:10.3969/j.issn.1009-3079.2006.19.005 ] |
| [10] | Li F, Jiang Y, Zheng Q, et al. TEC protein tyrosine kinase is involved in the Erk signaling pathway induced by HGF[J]. Biochem Biophys Res Commun, 2011, 404(1): 79–85. DOI:10.1016/j.bbrc.2010.11.068 |
| [11] | Azad A, Storey A. BAK multimerization for apoptosis, but not bid binding, is inhibited by negatively charged residue in the BAK hydrophobic groove[J]. Mol Cancer, 2013, 12: 65. DOI:10.1186/1476-4598-12-65 |
| [12] | Siveen KS, Prabhu KS, Achkar IW, et al. Role of non receptor tyrosine kinases in hematological malignances and its targeting by natural products[J]. Mol Cancer, 2018, 17(1): 31. DOI:10.1186/s12943-018-0788-y |
 2018, Vol. 45
2018, Vol. 45


