文章信息
- HIF-2α对乳腺癌MCF-7细胞生物学功能的影响
- Effects of HIF-2α on Biological Function of Breast Cancer MCF-7 Cells
- 肿瘤防治研究, 2018, 45(10): 722-727
- Cancer Research on Prevention and Treatment, 2018, 45(10): 722-727
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0088
- 收稿日期: 2018-01-19
- 修回日期: 2018-03-22
2. 453003 新乡,新乡医学院病理教研室
2. Department of Pathology, Xinxiang Medical College, Xinxiang 453003, China
低氧微环境存在于大多数实体瘤中,能够调控多种基因的表达,促进恶性肿瘤发生、浸润和转移,其中缺氧诱导因子HIFs在该过程中发挥了重要作用[1]。随着多项精细实验方法的发展及研究的不断深入,HIF-2α逐渐成为国内外研究的新热点[2]。为验证HIF-2α对乳腺癌细胞生物学功能的影响是通过调控乳腺癌细胞的增殖和其他相关生长指标这一假设,本研究在体外以HIF-2α ORF/shRNA慢病毒转染乳腺癌MCF-7细胞,检测HIF-2α的表达对其生物学功能的影响,以探讨HIF-2α在乳腺癌发生、发展中可能发挥的作用。
1 材料与方法 1.1 材料 1.1.1 质粒与细胞株本研究所使用细胞系为保存于郑州大学第一附属医院病理科的人乳腺癌MCF-7细胞株。慢病毒质粒Phelper1.0购自上海吉凯基因公司。
1.1.2 主要试剂胎牛血清、高糖DMEM、胰蛋白酶购自美国Gibco公司,RNA抽提试剂盒购自Magen生物有限公司,RT反转录试剂盒、SYBR Green试剂盒、全蛋白提取试剂盒购自Vazyme公司,HIF-2α兔抗人多克隆抗体购自美国Abcam公司,HRP标记抗鼠二抗购自北京中杉金桥公司,CCK-8 Cell Counting试剂盒购自南京Vazyme公司。
1.2 方法 1.2.1 细胞培养培养于含10%胎牛血清的完全DMEN培养基,37℃、5%CO2的条件下孵育培养,每48~72 h离心换液,待细胞密度达到90%时,经0.25%的胰酶消化传代培养。
1.2.2 质粒构建复苏-80℃保藏的感受态菌株,加入用于转化HIF-2α ORF质粒(或HIF-2α-shRNA质粒)。冰浴30 min后42℃温浴30 s。再次冰浴2~3 min。加入37℃预温好的SOC(super optimal broth with catabolite repression)培养基至1 ml,吹打混匀后37℃振荡培养1 h(160~225 r/min)。取适量菌液涂布含氨苄青霉素的LB琼脂平板培养基,37℃过夜培养。挑取培养基上形成的单克隆菌落,进行菌落PCR,PCR扩增产物进行琼脂糖凝胶电泳鉴定所选单克隆是否为阳性克隆;PCR引物采用质粒说明书中推荐的鉴定引物,见表 1。
以Magen无内毒素质粒抽提试剂盒提取慢病毒包装系统中所需的HIF-2α ORF克隆和HIF-2α shRNA克隆,以紫外光吸收法测定其浓度及纯度,保证所提质粒DNA的A260/A280在1.8~2.0之间。5 μg质粒DNA加入无菌EP管中,用减血清培养基(Opti-MEM Ⅰ)稀释至200 μl,加入稀释的15 μl EndoFectinTM转染试剂,制成DNA/EndoFectin转染混合物。MCF-7细胞培养24 h后选择合适MOI值,加入DNA-EndoFectin慢病毒复合物,37℃、5%CO2条件下孵育培养过夜(8~14 h)。12 h后,用新鲜的DMEM筛选培养基(含5%热灭活FBS、嘌呤霉素、青/链霉)替换旧的培养基,在CO2条件下,以37℃继续培养。收集细胞Real-time PCR及Western blot检测慢病毒感染目的细胞的效率。
1.2.4 荧光定量PCR检测HIF-2α mRNA的表达水平使用TRIzol试剂提取RNA法提取各组细胞RNA,使用Vazyme RT试剂盒反转录成cDNA,qPCR通过系统完成,反应体系为20 μl,内含SYBR Green Master Mix、模板、配对引物。HIF-2α mRNA的相对表达量采用2-ΔΔCt分析法。引物参见表 1。
1.2.5 蛋白免疫印迹(Western blot)法测定HIF-2α蛋白的表达水平使用总蛋白提取试剂盒提取病毒感染的人乳腺癌MCF-7细胞总蛋白。取50 μl蛋白加样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。100 V,200 mA,20 W条件下转膜2 h;转印后的PVDF膜加入5%的脱脂奶粉TBST封闭1 h。将膜置于1:3 000稀释的15 ml一抗(HIF-2α、β-actin)中,4℃冰箱过夜,PBST洗膜10 min×3次;将膜放入1:2 000鼠源性HRP酶标记的二抗中,室温2 h,PBST洗膜10 min×3次。加入ECL化学发光液,室温条件下反应1~2 min;显影仪显影,用扫描仪扫描图像,光密度积分值(Integrated optical density, IOD)用Scion Image图像分析软件进行分析。计算与内参β-actin表达的灰度比值。每个图像均重复分析3次,取平均值。
1.2.6 细胞增殖及毒性检测试剂盒(CCK-8)检测MCF-7细胞的增殖活力将MCF-7细胞消化后配成2×104个/毫升单细胞悬液后,接种于96孔培养板,每孔100 μl细胞,设5复孔,边缘孔加100 μl无菌水或者PBS,37℃、5%CO2培养箱中培养。16 h后,按照转染试剂说明书转染细胞(0.2 μg质粒、0.2 μl和元生物转染试剂)。在24 h检测时间点加入10 μl CCK-8溶液于孔中,无需换液。1 h后,酶标仪测定450 nm各孔的吸光值。将各测试孔的OD值减去调零孔OD值或对照孔OD值。各重复孔的OD值取平均数。细胞活力%=(OD加药细胞-OD空白/OD对照细胞-OD空白)×100%。
1.2.7 Transwell小室侵袭实验检测MCF-7细胞侵袭能力将6孔板中的MCF-7细胞经HIF-2α ORF/shRNA慢病毒感染后,更换为无血清培养基培养12 h,使细胞饥饿化;再将-20℃低温水箱保存的基质胶(Matrigel)的EP管取出,用封口膜封好,置于放冰的烧杯里,24 h内慢慢升温溶解;从4℃取出无血清培养基按照体积比1:3(Matrigel:培养基)稀释,取出-20℃低温保存的Transwell板,加入稀释后的Matrigel,每孔50 μl,盖上板盖,十字形水平摇晃板,每个方向6到10次后,将Transwell板置于37℃培养箱30~50 min;用无血清的培养液调整细胞浓度为2.5×102个/微升;每个上室加100 μl调好浓度的细胞悬液;在下室加500 μl含10%FBS的培养液,置培养箱培养。次日在超净台中取出上室,放到另一个24孔板中,继续培养;吸弃上室的培养基,用棉签将朝上的微孔滤膜面上的胶擦净;在另一个24孔板中加入4%的甲醛600 μl;将上室移到福尔马林洞中,在上室加入无水甲醇150 μl,标记,静置15 min;将上室的无水甲醇吸干净,倒置在24孔板盖子上,在通风厨中自然风干上室的下表面(无gel的一面),约30 min;取另一个24孔板,加入吉姆萨试剂一,静置1 min;取另一个24孔板,加入吉姆萨试剂二,静置5 min;取另一个24孔板,加入PBS,洗30 min,3次;将上室正放在干净的玻片上,有细胞的面贴着玻璃,静置,标记;置于倒置显微镜下观察并拍照。
1.2.8 平板克隆形成实验检测MCF-7细胞克隆形成能力取对数生长期的各组细胞,加入1 ml胰酶消化2~5 min。将含FBS的培养基和胰酶的细胞混合液移到15 ml离心管中,800 r/min,离心5 min。弃上清液,用PBS洗2次,取1 ml PBS悬浮细胞。细胞经过超速流式细胞分选系统计数,500个/孔,共设置三个复孔,将细胞放置37℃、5%CO2饱和湿度的培养箱中培养。每天显微镜下观察细胞生长状态,见有阳性克隆形成,终止培养。弃去培养液,用PBS小心浸洗2次。4%多聚甲醛固定10 min,PBS小心浸洗3次。在六孔板中每个孔加入1 ml结晶紫,染色10 min。吸出结晶紫染色液,用流水洗去结晶紫染色液。室温干燥。用计数器计数,拍照。克隆形成率=(克隆数/接种细胞数)×100%。
1.3 统计学方法所有数据采用SPSS22.0统计软件进行处理,实验数据用均数±标准差表示,不同组别mRNA和蛋白表达水平比较用One-way ANOVA,组间多重比较,方差齐用LSD法,不齐用DunnettT3,显著性水准为α=0.05。
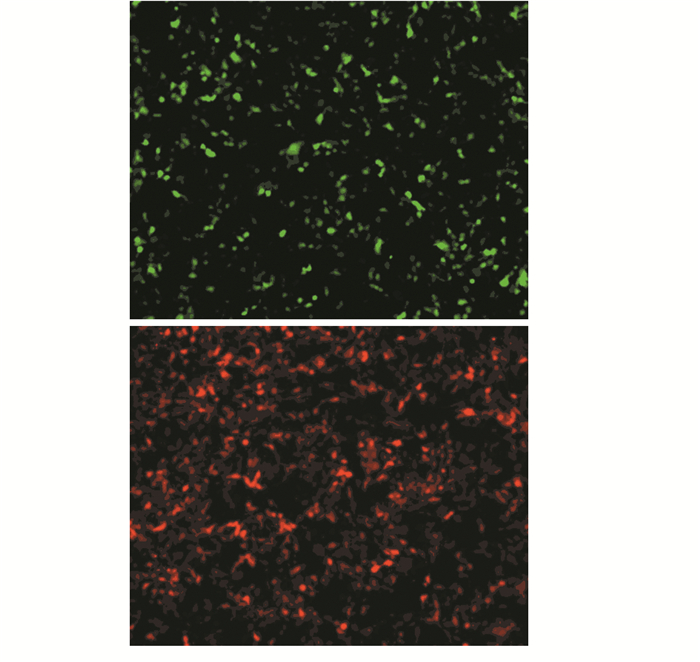
2 结果 2.1 慢病毒感染MCF-7细胞HIF-2α ORF/shRNA慢病毒颗粒分别感染乳腺癌MCF-7细胞48 h后开始对其进行持续5天的嘌呤霉素筛选,将培养瓶置于倒置荧光显微镜下观察,先在明视野观察细胞的密度和生长状态,此时可看到细胞的融合度在80%左右。调好焦距后转至暗视野观察细胞的荧光,此时可看到HIF-2α ORF慢病毒转染后的MCF-7 HIF-2α上调细胞发出绿色荧光;而HIF-2α shRNA慢病毒转染后的MCF-7 HIF-2α下调细胞发出红色荧光,见图 1。
|
| A: MCF-7 HIF-2α knock up cells emitted green fluorescence after HIF-2α ORF lentivirus infection; B: MCF-2 HIF-2α knock down cells emitted red fluorescerce after HIF-2α shRNA lentivirus infection 图 1 慢病毒感染MCF-7细胞嘌呤霉素筛选48 h后结果(×100) Figure 1 Puromycin screening results of MCF-7 cells after lentivirus infection for 48h (×100) |
提取无内毒素HIF-2α shRNA质粒后转染MCF-7细胞,通过Real time-PCR和Western blot进行HIF-2α沉默效率检验,见表 2。
|
与Control组相比:HIF-2α shRNA-1和HIF-2α shRNA-2组HIF-2α的mRNA表达水平均显著下降(P=0.0007, P=0.0040),而HIF-2α shRNA3和shRNA-control组与Control组比较差异无统计学意义(P=0.7898, P=0.1693),见图 2。Western blot结果显示shRNA1/2 HIF-2α蛋白表达水平明显受到抑制,见图 3。

|
| 图 2 HIF-2α shRNA转染MCF-7细胞后HIF-2α mRNA表达水平 Figure 2 Expression level of HIF-2α mRNA in MCF-7 cells transfected with HIF-2α shRNA |

|
| 图 3 HIF-2α shRNA转染MCF-7细胞后HIF-2α蛋白表达水平 Figure 3 Expression level of HIF-2α protein in MCF-7 cells transfected with HIF-2α shRNA |
与正常MCF-7细胞(Control)组相比,HIF-2α ORF质粒转染MCF-7细胞HIF-2α mRNA表达水平显著升高(P < 0.0001),见表 3。
|
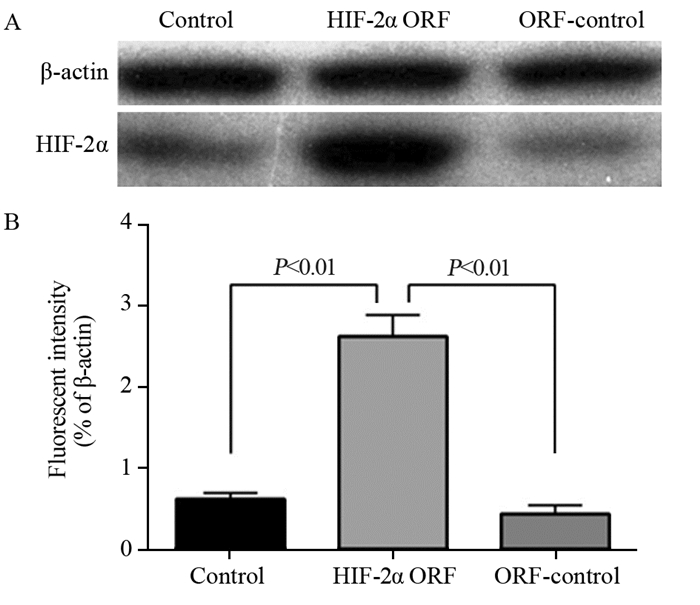
HIF-2α ORF质粒转染后MCF-7细胞中HIF-2α的蛋白表达量显著高于正常MCF-7细胞(Control)和对照慢病毒细胞(ORF-control),与Real-time PCR检测结果趋势一致,见图 4。
|
| 图 4 HIF-2α ORF慢病毒感染后HIF-2α蛋白相对表达水平 Figure 4 Relative expression level of HIF-2α protein after HIF-2α ORF lentivirus infection |
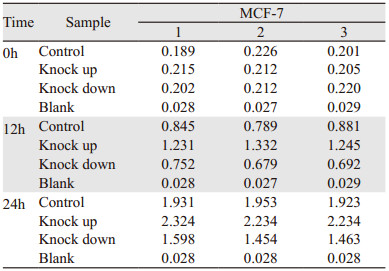
HIF-2α ORF/shRNA慢病毒成功感染乳腺癌MCF-7细胞并经过嘌呤霉素筛选后获得MCF-7 HIF-2α上/下调稳定转染细胞株,对MCF-7细胞及MCF-7 HIF-2α上/下调细胞株进行CCK-8检测,与正常MCF-7细胞(Control)组相比,HIF-2α上调组增殖活力明显增强,而HIF-2α-下调组增殖活力明显减弱,见表 4。
|
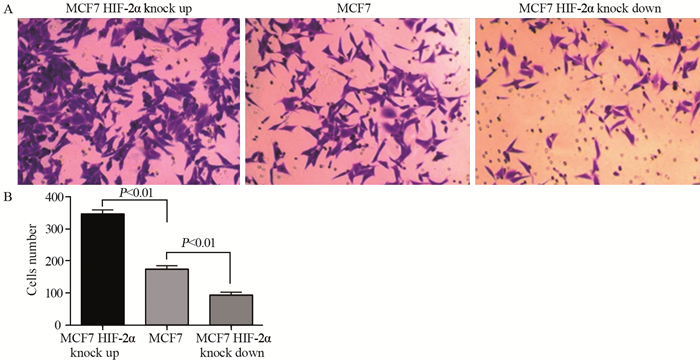
MCF-7 HIF-2α上调细胞穿膜细胞数(340±5.66)明显高于正常MCF-7细胞穿膜细胞数(179.5±0.71),侵袭能力增强(P=0.0333);而MCF-7 HIF-2α下调细胞穿膜细胞数(98.5±10.61)明显低于正常MCF-7细胞穿膜细胞数(179.5±0.71),侵袭能力减弱(P=0.0014),见图 5。
|
| 图 5 Transwell小室实验检测HIF-2α对细胞侵袭能力的影响 Figure 5 Effect of HIF-2α on invasion ability of MCF-7 cells detected by Transwell assay |
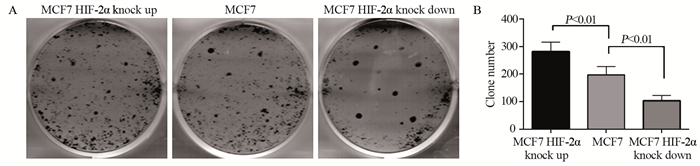
MCF-7 HIF-2α上调组形成细胞集落数为(271.7±39.80)个,显著高于MCF-7细胞组的(157.3±26.15)个,集落数显著上升(P=0.0051),并且集落体积也明显增大;而MCF-7 HIF-2α下调组形成细胞集落数为(103.7±11.10)个,明显低于MCF-7细胞组,细胞集落形成率明显降低(P =0.0026),见图 6。
|
| 图 6 克隆形成实验检测HIF-2α对乳腺癌MCF-7细胞克隆形成的影响 Figure 6 Effect of HIF-2α on clone formation of MCF-7 cells detected by clone formation assay |
HIFs属于转录因子的一个家族,是由一个不稳定的α亚基和稳定的β亚基(芳香烃受体核转运蛋白分子)组成,与肿瘤的发展、恶化、转移等过程密切相关[3]。在HIFs的三种HIF-α亚型(HIF-1α、HIF-2α、HIF-3α)中,HIF-1α和HIF-2α被广泛研究。HIF-2α与HIF-1α具有高度的同源性,它们的bHLH、PAS、氧气依赖型降解域(ODD)等结构生物基因序列十分相似。目前很多研究证明它们是具有独特翻译水平的靶点并且对肿瘤的生长有不同的作用[4]。HIF-2α的表达比广泛存在于肿瘤细胞内的HIF-1α更具有组织特异性[5]。目前已证实肿瘤耐受低氧微环境下生长的标志因子HIF-2α参与到肿瘤的发生发展机制中。Xia等[6]研究显示在侵袭性膀胱癌中HIF-2α起重要作用;Jeong等[7]研究表明HIF-2α对雄激素不敏感的前列腺癌细胞的增殖和侵袭能力很重要;徐可等[8]研究显示HIF-2α在肾透明细胞癌中高表达;Ji等[9]研究显示HIF-2α mRNA高表达与膀胱癌的高侵袭性呈正相关,因此HIF-2α可能成为肿瘤治疗的新靶点。
实体肿瘤中之所以普遍存在缺氧现象,是因为实体肿瘤增殖的速度远超过供养血管增生的速度,导致内部氧分压明显低于正常组织。肿瘤细胞通过内源性基因表达的变化来适应周围缺氧微环境,处于上游的缺氧诱导因子(HIF)是最重要的内源性基因,通过影响其靶基因的表达从而使细胞的蛋白组成成分发生变化,生理活动产生改变[10]。肿瘤细胞在缺氧微环境下,不仅明显增强对化疗药物和放射治疗的耐受能力,还显著增强转移侵袭能力,极易发生远处转移,导致肿瘤快速进展。因此,缺氧诱导因子HIF对肿瘤的代谢、侵袭转移、凋亡增殖及血管生成等生物学特性产生明显的影响[11]。Semenza[12]发现:在乳腺癌肺转移患者中,HIF-1及HIF-2均高表达,并且血管生成素的表达亦上调,推测肿瘤细胞的增殖及远处转移与HIFs促进肿瘤血管生成及其侵袭性生长密切相关;李洋等[13]发现:在非小细胞肺癌细胞中通过RNA干扰技术下调HIF-2α的表达,可以抑制趋化因子受体CCR7的表达,推测HIF-2α与调节多种实体肿瘤细胞发生转移的CCR7可能是介导肿瘤细胞发生转移的主要信号通路。
肿瘤侵袭与转移涉及多种机制,其中肿瘤发展过程中的关键环节是瘤细胞突破基底膜进入间叶组织。目前广泛采用的评估体外培养实验细胞的侵袭力的有效实验手段是通过Transwell小室实验模拟机体基底膜结构。本研究中Transwell小室实验结果研究显示,HIF-2α过表达增加细胞迁移能力,增加穿膜细胞数目,而HIF-2α抑制则导致细胞迁移能力减慢,穿膜细胞数明显减少,提示HIF-2α的过表达会促进MCF-7细胞的侵袭和转移相关生物学行为。平板克隆形成实验及CCK-8检测结果表明,HIF-2α过表达促进MCF-7细胞克隆形成,提高MCF-7细胞的增殖活力,而HIF-2α沉默则具有相反的趋势。
| [1] | Subarsky P, Hill RP. The hypoxic tumour microenvironment and metastatic progression[J]. Clin Exp Metastasis, 2003, 20(3): 237–50. DOI:10.1023/A:1022939318102 |
| [2] | Wiesener MS, Jürgensen JS, Rosenberger C, et al. Widespread hypoxia-inducible expression of HIF-2alpha in distinct cell populations of different organs[J]. FASEB J, 2003, 17(2): 271–3. DOI:10.1096/fj.02-0445fje |
| [3] | Tiburcio PD, Choi H, Huang LE. Complex role of HIF in cancer: the known, the unknown, and the unexpected[J]. Hypoxia(Auckl), 2014, 2: 59–70. |
| [4] | Huang Y, Lin D, Taniguchi CM. Hypoxia inducible factor (HIF) in the tumor microenvironment: friend or foe?[J]. Sci China Life Sci, 2017, 60(10): 1114–24. DOI:10.1007/s11427-017-9178-y |
| [5] | Talks KL, Turley H, Gatter KC, et al. The Expression and Distribution of the Hypoxia-Inducible Factors HIF-1α and HIF-2α in Normal Human Tissues, Cancers, and Tumor-Associated Macrophages[J]. Am J Pathol, 2000, 157(2): 411–21. DOI:10.1016/S0002-9440(10)64554-3 |
| [6] | Xia G, Kageyama Y, Hayashi T, et al. Positive expression of HIF-2α/EPAS1 in invasive bladder cancer[J]. Urology, 2002, 59(5): 774–8. DOI:10.1016/S0090-4295(01)01607-7 |
| [7] | Jeong CW, Yoon CY, Jeong SJ, et al. The role of hypoxia-inducible factor-1α and -2α in androgen insensitive prostate cancer cells[J]. Urol Oncol, 2013, 31(8): 1448–56. DOI:10.1016/j.urolonc.2012.03.022 |
| [8] | 徐可, 丁强, 李映川, 等. HIF-1α和HIF-2α在人肾透明细胞癌中的表达及意义[J]. 复旦学报(医学版), 2008, 35(2): 265–8. [ Xu K, Ding Q, Li YC, et al. Expression and significance of HIF-1α and HIF-2α in human renal clear cell cancer[J]. Fudan Xue Bao(Yi Xue Ban), 2008, 35(2): 265–8. DOI:10.3969/j.issn.1672-8467.2008.02.025 ] |
| [9] | Ji P, Xuan JW, Onita T, et al. Correlation study showing no concordance between EPAS-1/HIF-2alpha mRNA and protein expression in transitional cell cancer of the bladder[J]. Urology, 2003, 61(4): 851–7. DOI:10.1016/S0090-4295(02)02405-6 |
| [10] | Leo C, Giaccia AJ, Denko NC. The hypoxic tumor microenvironment and gene expression[J]. Semin Radiat Oncol, 2004, 14(3): 207–14. DOI:10.1016/j.semradonc.2004.04.007 |
| [11] | Yang Y, Sun M, Wang L, et al. HIFs, angiogenesis, and cancer[J]. J Cell Biochem, 2013, 114(5): 967–74. DOI:10.1002/jcb.v114.5 |
| [12] | Semenza GL. Molecular mechanisms mediating metastasis of hypoxic breast cancer cells[J]. Trends Mol Med, 2012, 18(9): 534–43. DOI:10.1016/j.molmed.2012.08.001 |
| [13] | 李洋, 张清富, 江黎黎, 等. HIF-1α和HIF-2α上调非小细胞肺癌中CCR7的表达[J]. 中国肺癌杂志, 2008, 11(5): 724–8. [ Li Y, Zhang QF, Jiang LL, et al. Upregulation of the Chemokine Receptor CCR7 expression by HIF-1α and HIF-2α in non-small cell lung cancer[J]. Zhongguo Fei Ai Za Zhi, 2008, 11(5): 724–8. DOI:10.3779/j.issn.1009-3419.2008.05.024 ] |
 2018, Vol. 45
2018, Vol. 45