文章信息
- PTCD术后并发胆汁瘤7例临床分析
- Biloma After Percutanous Transhepatic Cholangio Drainage: A Report of Seven Cases
- 肿瘤防治研究, 2018, 45(9): 687-690
- Cancer Research on Prevention and Treatment, 2018, 45(9): 687-690
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0082
- 收稿日期: 2018-01-18
- 修回日期: 2018-04-12
2. 510515 广州,广东省人民医院介入中心
2. Intervention Center, Guangdong Provincial People's Hospital, Guangzhou 510515, China
胆汁瘤(biloma)是指胆汁在胆管树以外聚积,影像学上表现为肝内外的囊性瘤样结构[1],是一种少见的胆道并发症,预后凶险,若处理不当可导致死亡[2]。多见于肝胆手术、外伤及肝脏肿瘤介入治疗后,而继发于经皮肝穿胆道置管引流术(percutanous transhepatic cholangio drainage, PTCD)后的尚未见相关文献报道。本文回顾性分析厦门大学附属成功医院7例PTCD术后并发胆汁瘤患者资料进行总结,旨在提高对本症的认识。
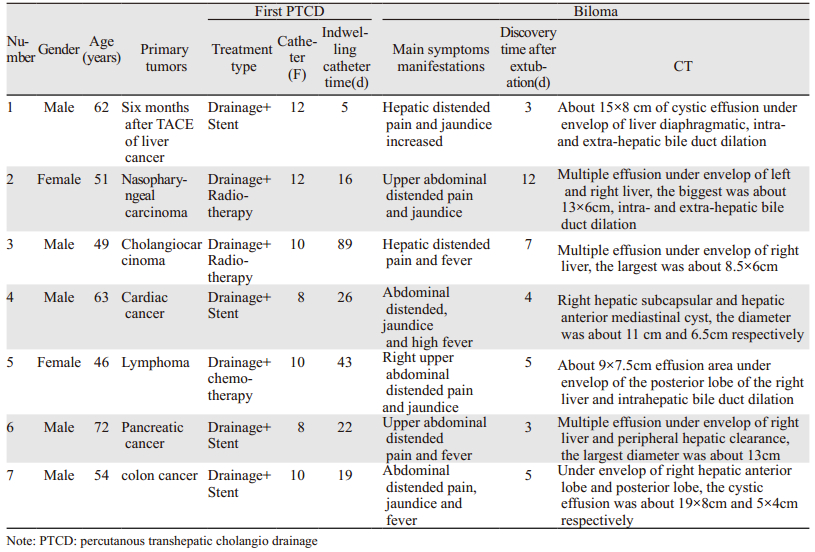
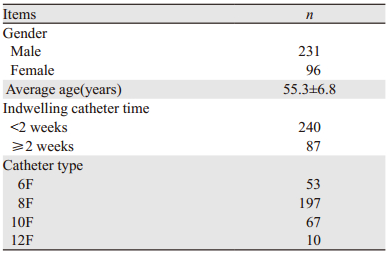
1 资料与方法 1.1 一般资料收集2006年6月1日—2017年1月31日间厦门大学附属成功医院327例行PTCD的恶性梗阻性黄疸患者,均在完成引流任务后拔除胆道引流导管,拨管前黄疸改善且无胆汁瘤,无胆结石、胆道手术或外伤史,见表 1。其中7例患者在拔管后3~12 d(平均5.57 d)出现肝区胀痛或伴黄疸、发热等症状,CT检查提示肝包膜下或肝周间隙积液,最大径值8.50~19.00 cm(平均12.64 cm),均经穿刺抽取胆汁确诊为胆汁瘤,其中2例为单发胆汁瘤、2例双发、3例多发;3例为无感染的单纯性胆汁瘤、4例合并感染;5例合并黄疸、2例无黄疸;4例曾联合胆道支架置入、3例仅单纯PTCD减黄,见表 2。
|
327例患者中除17例首次PTCD是在外院彩超下引导外,其余均在成功医院数字减法血管造影术(digital subtraction angiography, DSA)引导下穿刺。经皮穿刺成功后在肝总管或胆总管近端内置入6~12 F外引流或内外引流管。此后根据置管目的,决定是否加放胆道支架或完成引流任务后拔管。若行胆道支架放置,一般在引流2~5 d后在DSA引导下选择合适支架在狭窄处置入。支架置入后常规留置同型号导管预防性外引流2~3 d。拔管时先夹管1~2 d,若无异常,经引流管造影原胆道狭窄缓解,造影剂顺利由肝内胆管进入肠腔,自引流管导入黑泥鳅超滑导丝支撑下拔除引流管。
1.2.2 胆汁瘤治疗在利胆保肝及静脉抗炎治疗的同时,对直径≤2 cm的胆汁瘤给予临床观察;3~5 cm的采用经皮穿刺抽吸法,若抽出液伴脓性者改置管引流;> 5 cm的采用置管引流法。彩超引导下确定安全穿刺路径,抽吸法采用18或19 G穿刺针直接穿刺入胆汁瘤内抽净积液后拔针,必要时5~7 d重复;引流法同上,穿刺后置入6 F引流管至瘤腔底部并固定于腹壁,术后持续引流,若引流液伴脓性者予庆大霉素及替硝唑7~14 d,每日冲洗,必要时根据药敏调整抗生素。对合并黄疸者同时加PTCD引流。当临床症状消失,胆汁瘤引流量减少至≤10 ml/d,复查CT瘤腔最大直径缩小≥75%或消失,胆汁及血培养阴性,则先夹闭PTCD管2~3 d,若胆汁瘤引流量无增加,先拨PTCD管后再予胆汁瘤夹管2~3 d,若仍无异常,复查胆汁瘤无复发或新发,则拔其各引流管。记录各管引流时间及预后,并连续3月每月复查CT或彩超,胆汁瘤消失或不再变化即为临床治愈。
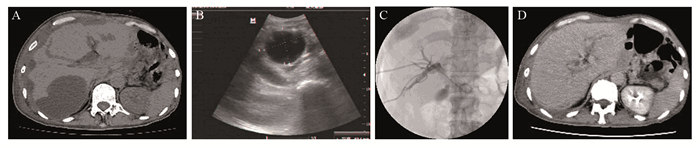
2 结果均成功对7例患者的最大胆汁瘤灶置管引流,其中对1例双发及1例多发者的另外2个直径 > 5 cm的瘤腔各加置管1根;1例双发胆汁瘤的另外1个5 cm且合并感染的瘤腔加置管1根;2例多发者各加2次穿刺抽吸。4例胆汁瘤合并感染者中,3例引流液起初为黄绿色伴脓性胆汁或伴腥臭味,经加抗生素冲洗后1周内逐渐转清无异味。5例合并黄疸者同时加行二次PTCD引流后黄疸均消退,引流7~21 d(平均12.53 d)后拔管。7例患者中,除1例(序号4)经引流后黄疸消退,但胆汁瘤引流量仍持续在20~30 ml/d,反复伴脓性、多重感染而未能拔管,治疗3周后因家属放弃治疗主动出院并死于肿瘤衰竭;其余6例均达临床治愈,在引流9~24 d(平均14.35 d)后拔管,见图 1。
|
| A: CT: The biloma under the envelop of the posterior lobe of the right liver was about 9cm×7.5cm, intrahepatic bile duct dilation; B: The biloma catheter drainage operation was guided by color ultrasound; C: The second time of PTCD drainage; D: Two months after biloma catheter drainage operation, CT revealed that the biloma was cured 图 1 1例淋巴瘤PTCD引流51天拔管后并发胆汁瘤患者影像图 Figure 1 CT image of one lymphoma patient with biloma 51 days after PTCD |
胆汁瘤的发病机制目前仍不明确,国内外学者将其成因归纳为医源性、外伤性和自发性3种[3-7],其中以医源性胆汁瘤最多见。而对于PTCD并发胆汁瘤,我们推测可能成因有:(1)本组7例患者均发生在导管型号≥8 F,且型号越大,发生率越高,可见所用的较粗导管是PTCD造成胆道医源性损伤的主要原因。(2)首次PTCD留管时间除1例为5 d(由于其组织水肿暂时性胆道梗阻,胆汁排出不畅而破裂穿孔),其余6例留管均≥2周,可见留管较久也是主要的危险因素,由于恶性黄疸患者多伴有肝内转移、营养不良及肝硬化,加上导管可使肝包膜及附近软组织水肿,留管越久肝瘘道愈合越慢。(3)PTCD本身可能的炎性过程使来自肝动脉系统的供血减少,导致肝功能损伤并继发萎缩及胆管因血管痉挛狭窄或微血栓形成而缺血坏死。(4)原有胆道梗阻、压力升高的毛细胆管穿孔破裂的基础,加上PTCD的直接机械损伤,使胆汁渗出在疏松水肿的肝包膜下或从瘘道逆流至肝周间隙并聚积。(5)本组4例曾有支架置入史,是否存在因胆泥形成暂时性支架堵塞,或增加胆汁瘤机会仍不确定,但其可直接损害胆管系统及破坏周围血管丛,加重胆道内膜坏死[8],也为肠菌逆行提供了通路,易诱发感染,促进胆汁瘤的发生。
3.2 胆汁瘤的诊断早期胆汁瘤常无症状,而随着胆汁瘤的增大,尤其是PTCD并发的胆汁瘤常位于肝包膜下,多为大而薄的均匀性囊肿,可推挤周围组织出现肝区胀痛,或压迫较大胆管出现黄疸,若合并感染时可伴有全身中毒症状。但可被部分PTCD术后的一般性反应或普通感染表现的类似症状而掩盖,使胆汁瘤不易被及时发现。因此,如PTCD术后出现难以解释或明显的腹痛、持续发热,尤其是出现原黄疸加重或腹膜刺激症状时,应警惕胆汁瘤可能。此时应尽快进行影像学检查,如发现肝内外边界清楚并与胆汁密度相似的液性区时,加穿刺抽出胆汁样液体即可确诊,而胆汁或血培养阳性时可确定合并感染。但胆汁瘤的积液区也常在肝穿路径的附近,使其与PTCD穿刺并发的肝内血肿难以区分,而肝内血肿通过彩超的经时变化特点(即早期的血肿为较均匀的积液回声,以后血肿机化则表现为固态的实质性回声,最终机化的血肿发生溶解,又表现为液性回声)、CT值和局部解剖学结构可帮助其鉴别诊断[9-10]。
3.3 胆汁瘤的治疗决定胆汁瘤是否治疗以及治疗方式的主要因素是其大小及是否合并感染。直径≤5 cm的胆汁瘤,由于胆管缺血坏死和胆汁淤积较轻,组织增生修复快,经单纯抽吸治疗即可达满意效果,其中直径≤2 cm的无症状者多数也能自愈。而直径 > 5 cm或伴感染的胆汁瘤,由于胆管坏死重、胆漏多,组织修复困难,并可引发临床症状和阻塞性黄疸,置管引流仍是首选疗法。本组7例患者的胆汁瘤最大直径8.5~19.0 cm,均采用置管引流并2例加抽吸治疗、4例合并感染者加抗生素冲洗,除1例因反复多重感染,导致肿瘤进展加快而衰竭死亡,其余6例均临床治愈。由于多数胆汁瘤的坏死胆管破口已闭,经引流后可逐渐缩小消失而无需进一步治疗。但若引流后无缩小甚至增大时,当胆汁瘤与胆道不相通,考虑其内壁上皮化,具分泌功能,则可加无水乙醇硬化剂治疗[11];若与胆道相通,引流可使瘤腔内呈负压状态,胆汁经瘘道流入瘤腔较多,瘘道愈合变慢,甚至导致引流管无法拔除。对合并胆道扩张者此时联合PTCD引流,可降低胆道压力,减少甚至阻止胆汁漏出,促进原瘘道闭合,并减少新的胆汁瘤发生。本组5例合并黄疸者同时接受二次PTCD引流,既消退黄疸又加快胆汁瘤愈合。
3.4 胆汁瘤的预防PTCD并发胆汁瘤正是由于PTCD导致肝内胆管受损坏死,而留管时间≥2周或型号≥8 F是其危险因素,因此,应严格遵循PTCD操作原则,术中应尽量穿刺3级胆道分支,避免穿刺压力较高、易于造成胆汁逆流的较大胆管,同时尽量减少穿刺次数,穿刺针以较细的21G套针为佳,减少胆管受损机会;导管型号选择以不易阻塞又能通畅引流的6~8 F为宜,并尽可能缩短留管时间;拔管前应常规造影复查及夹管试验,证实无再发梗阻、胆汁排泄通畅;对存在高危因素者,在拔管前及时有效封堵引流瘘道,避免胆汁漏出。我们于2017年2月—2017年12月间又行PTCD患者47例,均采用8 F导管引流,对其中6例留管超过2周者,在拔管的同时用明胶海绵条预防性填塞肝组织引流瘘道后,无一例并发胆汁瘤,但由于病例数偏少,仍有待进一步观察。
| [1] | 刘昭明, 李祯, 许丙辉, 等. 肝细胞癌患者介入手术后胆汁瘤发病因素与临床特点[J]. 中国普通外科杂志, 2016, 25(7): 973–8. [ Liu ZM, Li Z, Xu BH, et al. Pathogenic factors and clinical features of biloma in hepatocellular carcinoma patients after interventional therapy[J]. Zhongguo Pu Tong Wai Ke Za Zhi, 2016, 25(7): 973–8. ] |
| [2] | 李旭, 高普均, 许芳, 等. 误诊为肝囊肿的胆汁瘤合并感染性休克一例[J]. 中华内科杂志, 2014, 53(1): 57–8. [ Li X, Gao PJ, Xu F, et al. A case of a biloma that was misdiagnosed as a hepatic cyst combined with septic shock[J]. Zhonghua Nei Ke Za Zhi, 2014, 53(1): 57–8. DOI:10.3760/cma.j.issn.0578-1426.2014.01.014 ] |
| [3] | 刘军山, 张秀文, 杨志艳. 肝癌经肝动脉化疗栓塞介入手术术后胆汁瘤的形成原因及治疗[J]. 山西医药杂志, 2017, 46(8): 932–4. [ Liu JS, Zhang XW, Yang ZY. The causes and treatment of biloma after hepatic arterial chemoembolization[J]. Shanxi Yi Yao Za Zhi, 2017, 46(8): 932–4. ] |
| [4] | 宋莉, 邹英华. 射频消融治疗肝脏高危部位肿瘤的并发症及其防治策略[J]. 临床肝胆病杂志, 2017, 33(4): 647–50. [ Song L, Zou YH. Prevention and treatment of complications after radiofrequency ablation for hepatic tumors in high-risk locations[J]. Lin Chuang Gan Dan Bing Za Zhi, 2017, 33(4): 647–50. DOI:10.3969/j.issn.1001-5256.2017.04.009 ] |
| [5] | 李名安, 黄明声, 姜在波, 等. 肝移植术后缺血性胆道病变的介入治疗探讨[J]. 器官移植, 2015, 6(1): 31–6. [ Li MA, Huang MS, Jiang ZB, et al. Interventional treatment for ischemic-type biliary lesion after liver transplantation[J]. Qi Guan Yi Zhi, 2015, 6(1): 31–6. DOI:10.3969/j.issn.1674-7445.2015.01.007 ] |
| [6] | 向江侠, 胡平, 高劲谋. 108例严重肝脏损伤诊治分析[J]. 创伤外科杂志, 2014, 16(4): 317–9. [ Xiang JX, Hu P, Gao JM. Diagnosis and treatment of 108 cases of severe liver injury[J]. Chuang Shang Wai Ke Za Zhi, 2014, 16(4): 317–9. ] |
| [7] | 程文芳, 马晶晶, 陈晓星, 等. 胆汁瘤的诊断和治疗二例报道及文献复习[J]. 中华消化内镜杂志, 2011, 28(2): 97–9. [ Cheng WF, Ma JJ, Chen XX, et al. The diagnosis and treatment of two cases of biloma were reviewed[J]. Zhonghua Xiao Hua Nei Jing Za Zhi, 2011, 28(2): 97–9. DOI:10.3760/cma.j.issn.1007-5232.2011.02.014 ] |
| [8] | Nacif LS, Bernardo WM, Bernardo L, et al. Endoscopic treatment of post-liver transplantation anastomotic biliary stricture:systematic review and meta-analysis[J]. Arq Gastroenterol, 2014, 51(3): 240–9. DOI:10.1590/S0004-28032014000300014 |
| [9] | 李琴, 唐建华, 林毅, 等. 超声引导下经皮穿刺置管引流术在胆汁瘤治疗中的应用[J]. 海南医学, 2016, 27(8): 1362–3. [ Li Q, Tang JH, Lin Y, et al. The application of ultrasound-guided percutaneous catheter drainage in the treatment of biloma[J]. Hainan Yi Xue, 2016, 27(8): 1362–3. DOI:10.3969/j.issn.1003-6350.2016.08.056 ] |
| [10] | 杨志艳, 刘军山, 张秀文. 肝癌介入治疗后并发胆汁瘤CT表现及临床意义[J]. 检验医学与临床, 2017, 14(15): 2199–200. [ Yang ZY, Liu JS, Zhang XW. CT manifestations and clinical significance of biloma formation after interventional therapy[J]. Jian Yan Yi Xue Yu Lin Chuang, 2017, 14(15): 2199–200. DOI:10.3969/j.issn.1672-9455.2017.15.012 ] |
| [11] | 叶洁仪, 谢晓燕, 林满霞, 等. 肝癌消融术后胆道并发症65例患者超声特征及临床转归[J]. 中华肝胆外科杂志, 2016, 22(6): 374–7. [ Ye JY, Xie XY, Lin MX, et al. Biliary complications after percutaneous ablation for patients with hepatic malignant tumors: retro-spective analysis of ultrasonic imaging features and clinical outcomes[J]. Zhonghua Gan Dan Wai Ke Za Zhi, 2016, 22(6): 374–7. DOI:10.3760/cma.j.issn.1007-8118.2016.06.005 ] |
 2018, Vol. 45
2018, Vol. 45