文章信息
- 不同放化疗治疗模式对肺癌患者放射性肺炎发生的影响
- Influence of Different Radio-chemotherapy Modes for Incidence of Radiation Pneumonitis in Patients with Lung Cancer
- 肿瘤防治研究, 2018, 45(6): 376-380
- Cancer Research on Prevention and Treatment, 2018, 45(6): 376-380
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0065
- 收稿日期: 2018-01-15
- 修回日期: 2018-03-19
2. 730000 兰州,兰州大学第一临床医学院
2. The First Clinical Medical College of Lanzhou University, Lanzhou 730000, China
肺癌是人类最常见的恶性肿瘤,大多数患者就诊时多为中晚期,多采用放疗+化疗的非手术治疗手段,放射性肺损伤是限制这种综合治疗疗效的主要原因,10%~30%的胸部放疗患者会出现放射性肺炎(radiation pneumonitis, RP)[1],它不仅限制了治疗的实施,影响了治疗疗效,也降低了患者的生存质量。一些研究表明放化疗联合治疗模式增加了放射性肺炎发生的危险性,特别是同期放化疗使放射性肺炎发生率明显增加[2]。另有研究表明诱导化疗可以增加放射性肺炎发生的风险,因为化疗药物会引起间质性肺炎、肺水肿、肺纤维化、肺静脉闭塞和支气管阻塞等导致肺损伤[3]。为此,本研究通过对2014年1月至2016年1月于甘肃省肿瘤医院放疗科行胸部放疗的肺癌患者进行回顾性分析,比较不同治疗模式下2级以上RP发生情况的差异,以及临床治疗特征对RP发生的影响,以期为临床降低严重RP发生提供一定的参考依据。
1 资料与方法 1.1 临床资料及入组标准2014年1月—2016年1月共有136例患者符合入组标准,其中男92例、女44例;年龄28~78岁, 中位年龄56岁;病理类型为小细胞癌54例、非小细胞癌82例;治疗模式为序贯放化疗89例、同步放化疗47例。入组标准:经病理学或细胞学确诊的肺癌患者;预计生存期 > 6月;KPS评分 > 60分;实验室检查白细胞 > 4×109/L,血小板 > 70×109/L,肝肾功能无明显异常,心电图基本正常;既往无其他肿瘤病史;无严重的可能影响治疗计划按期完成的内科疾病。排除标准:Ⅳ期广泛转移者;行全肺切除手术者;有胸部放疗史;有严重慢性支气管炎、肺气肿、肺心病,FEV1 < 预计值60%;或有其他严重疾病,如6月内发生过心肌梗塞者。
1.2 研究方法所有入组病例必须于治疗前完成以下检查:常规病史采集及体格检查、胸部CT、血常规、肝肾功能、免疫功能、电解质、血糖、心电图、肺功能。病史采集及体格检查详细记录呼吸道症状及体征。放疗及化疗按常规进行,放疗采用三维适形/调强放疗。放疗结束及放疗后1、3、6月复查肺功能、胸部CT,按RTOG急性放射性肺炎标准对肺损伤进行分级,根据≥2级射性肺炎发生情况,分析评价临床特征及治疗模式对RP发生的影响。
1.3 治疗方法所有患者均采用三维适形或三维适形调强放疗,采用热塑膜固定体位,CT模拟扫描定位,勾画GTV包括原发病灶及转移淋巴结,GTV外扩6~8 mm为临床靶区(CTV),CTV外扩5~10 mm为计划靶区(PTV)。照射剂量根据病理类型而不同,非小细胞肺癌60~70 Gy/30~35次,小细胞肺癌50~60 Gy/25~30次,计划必须达到危及器官限量:双肺V20 < 30%,V30 < 20%,MLD < 15Gy;心脏V40 < 30%,V30 < 40%;脊髓最大剂量 < 45 Gy。计划完成后根据DVH统计相关剂量学参数。
入组患者均接受了以铂类为基础的两药联合化疗方案,包括EP(依托泊苷+顺铂)、NP(长春瑞滨+铂类)、TP(多西他赛+铂类)、GP(吉西他滨+铂类)、PC(培美曲塞+铂类)等。化疗周期数1~10个,中位数2周期。
1.4 评价指标主要观测指标为放射性肺损伤的程度。按修订后RTOG急性放射性肺炎标准评价[4]。0级:症状体征同放疗前无明显变化;1级:轻微咳嗽、用力时气短;2级:持续性咳嗽需用麻醉性镇咳药、轻微用力时呼吸困难但静息时消失;3级:严重咳嗽、麻醉性镇咳药无效、静息时气短、临床或放射影像证实的急性肺炎、可能需要间断吸氧或应用皮质激素;4级:严重呼吸功能不全、持续吸氧或辅助通气。本研究中以≥2级的放射性肺损伤作为放射性肺炎的诊断。
1.5 随访及统计学方法所有患者完成治疗后,开始进行随访,每3月复查一次,内容包括肺功能、胸部X线/CT检查,最短随访时间为6月,随访终点为患者死亡。数据采用SPSS17.0统计学软件进行分析,均数比较采用t检验,≥2级放射性肺炎发生率的比较采用χ2检验和Fisher’s精确检验。Logistic多因素回归分析和Pearson相关分析法分析放射性肺炎发生的影响因素。检验水准α=0.05,P < 0.05为差异有统计学意义。
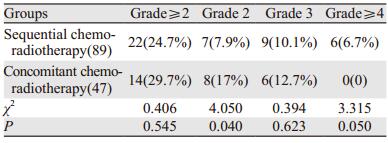
2 结果 2.1 临床特征与放射性肺炎(RP)的关系随访6~24月,中位随访9月。全组患者共136例,发生2级以上RP 36例,发生率为26.5%,其中21例为3级以上,6例为4级。发生RP和未发生RP患者一般状况及临床特征,见表 1~2。结果显示患者性别、年龄、KPS评分、有无吸烟史、肺癌病灶位置、疾病分期、放疗技术、联合靶向治疗、是否合并阻塞性肺炎及肺不张方面,两组差异均无统计学意义,而粉尘接触史和病理类型方面两组间差异有统计学意义(P=0.048, 0.047),具有粉尘密切接触史和NSCLC患者RP发生率高于无粉尘接触史者和SCLC患者。
|
|
治疗模式方面,序贯放化疗与同步放化疗比较,2级以上RP总发生率分别为24.7%和29.7%,两组比较差异无统计学意义(P=0.545);按照不同分级进行亚组分析,2级RP发生率分别为7.9%和17%,同步组高于序贯组,且差异有统计学意义(P=0.040);3级RP发生率分别为10.1%和12.7%,两组比较差异无统计学意义(P=0.623);≥4级RP发生率分别为6.7%和0,两组比较差异有统计学意义(P=0.050),序贯组高于同步组,见表 2。
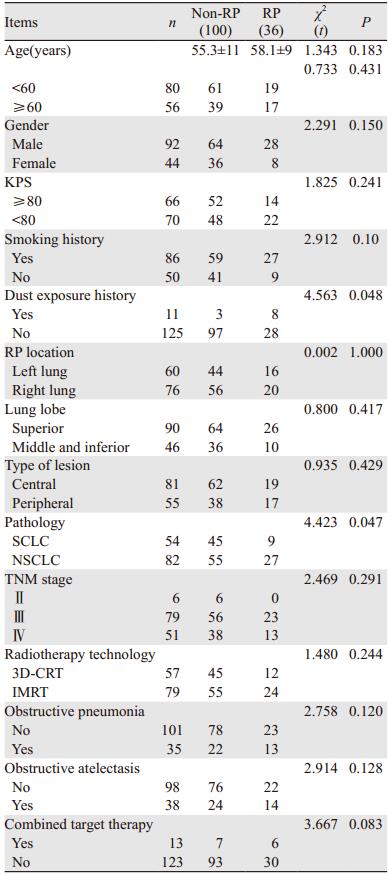
2.3 不同化疗方案对放射性肺炎发生的影响对不同化疗方案所致的≥2级的RP发生率进行比较,结果显示TP、EP、NP、GP、PC 5种常见化疗方案所致≥2级RP发生率分别为24%、16.9%、25%、37.5%和0,剔除PC方案3例患者,其余4种化疗方案比较差异无统计学意义(P=0.08),见表 3。
RP发生与未发生患者在总化疗周期方面差异有统计学意义(P=0.000),且总化疗周期数与RP严重程度呈显著正相关(r=0.437, P=0.000);RP发生与未发生患者在诱导化疗周期方面差异也有统计学意义(P=0.000),且诱导化疗周期与RP的严重程度也呈显著正相关(r=0.397, P=0.000),见图 1。RP发生与未发生患者在辅助化疗周期方面差异无统计学意义(P=0.151),但辅助化疗周期与RP严重程度也呈正相关(r=0.216, P=0.012),但在是否诱导化疗、是否同步化疗、是否辅助化疗方面进行比较,RP发生率差异均无统计学意义,见表 4。
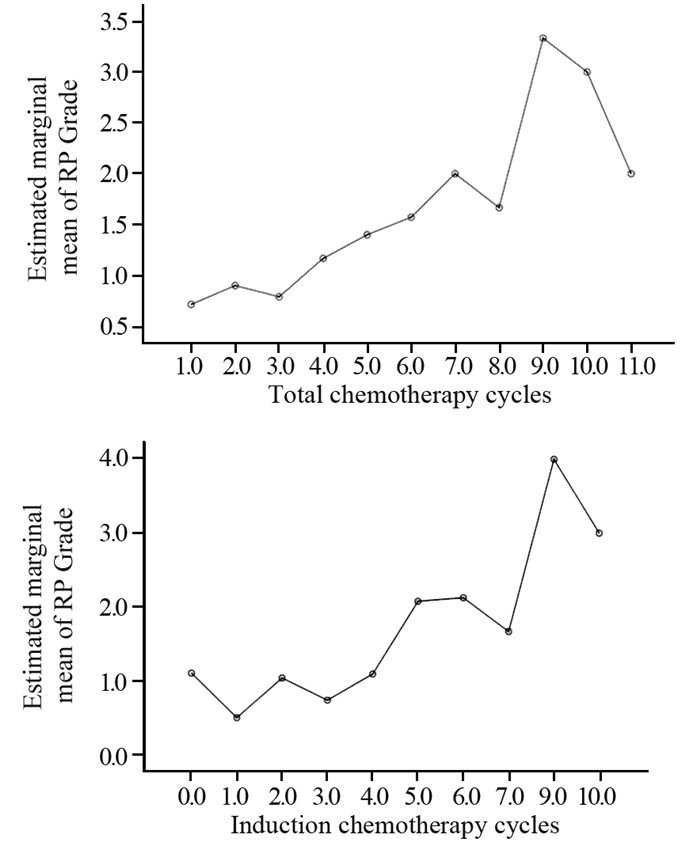
|
| 图 1 总化疗周期和诱导化疗周期与RP分级之间的相关性分析 Figure 1 Correlation of total chemotherapy cycles and induction chemotherapy cycles with PR grade |
放射性肺炎是胸部肿瘤放疗的最大限制因素, 尤其是肺癌患者,无论是小细胞肺癌还是非小细胞肺癌,大多数患者为中晚期,需要采用放化疗联合的综合治疗,虽然肿瘤局控率和患者生存率有所提高,但治疗并发症也随之增加。研究表明有症状的放射性肺炎发生率为8.4%~23.6%[5-6],且多发生在照射后1~6月,特别是照射后2~3月为发病高峰期,平均发病时间约50天[7]。影响放射性肺损伤发生发展的因素大致可概括为以下几个方面:(1)放射物理学方面,如肺受照剂量-体积因素的影响;(2)患者基本状况,如年龄、性别、既往肺病史、肺功能情况、吸烟史、营养状况、并发症等;(3)放射生物因素指患者内在易感性生物学的特征、某些细胞因子活性的不同及在治疗中的变化与放射性肺损伤的相关性;(4)不同治疗模式作为影响患者疗效的主要因素,其并发症也是不容忽视的,无论是同步放化疗或序贯放化疗,因化疗方案、周期、放疗时期等不同而显得更加复杂。本研究采用放化疗综合治疗的136例肺癌患者为研究对象,探讨患者基本临床特征、不同治疗模式、不同化疗周期及模式对RP发生的影响。
全组患者≥2级RP发生率为26.5%,其中2级和3级均为11%,4级以上为4.5%,从RP严重程度来看,主要为2~3级。从临床特征方面进行分析,患者性别、年龄、KPS评分、有无吸烟史、肺癌病灶位置、肿瘤病理类型、疾病分期、放疗技术、联合靶向治疗、是否合并阻塞性肺炎及肺不张方面,RP发生组与未发生组比较差异均无统计学意义,说明患者临床病理特征及放疗技术与RP发生无直接相关性。但就粉尘接触史而言,两组间差异有统计学意义,具有粉尘密切接触史患者RP发生率明显高于无粉尘接触史者。关于尘肺与肺癌发生的相关性,国内外所发表的一些队列研究、病例对照研究或横断面研究均反映出模棱两可的结果[8],周军等[9]对82例尘肺合并肺癌患者临床资料进行研究,结果表明尘肺与肺癌发生并无直接相关性,但在尘肺基础上吸烟与肺癌发生有很大的关系。由于尘肺患者肺功能比较差, 多数尘肺合并肺癌患者不能手术治疗, 放疗成为其主要治疗手段[10]。尘肺病变形成后肺内残留的粉尘还继续与肺泡巨噬细胞起作用,这是尘肺患者虽然脱离粉尘作业但病变仍继续发展直至肺纤维化的主要原因。而放射性肺炎的发生发展和演变过程与尘肺类似,一旦发展至肺纤维化阶段,与尘肺一样尚无特殊挽救方法。结合本研究结果,尘肺并发肺癌的患者进行放疗时, 放射性肺炎发生率明显升高,更应注意保护正常肺组织。
在治疗模式方面,无论是序贯放化疗还是同步放化疗,两组2级以上放射性肺炎的总发生率并无差别,序贯组为24.7%(22/89),同步组为29.7%(14/47)。放化疗综合治疗的患者RP发生率要比单纯放疗高,这是因为化疗可能增强正常肺组织对放疗的敏感度,加重放射损伤,使放射性肺炎的发生率增高[11]。但按照RP的严重程度进行不同分级亚组分析,2级RP发生率,同步组高于序贯组,而4级RP发生率,序贯组高于同步组。可能是与能接受同步放化疗患者PS评分较高、一般状况较好有关,虽然一定程度上增加了低分级RP的发生率,但并未增加严重RP发生率,甚至低于序贯放化疗。这有利于我们在今后的临床实践中充分利用同步放化疗的优点,在疗效上协同的同时,进一步缩短化疗周期,从而提高生活质量, 节省治疗成本。而且随着放疗设备及技术的改进, 以及新的低毒化疗药物的不断出现,患者的耐受性将得到进一步提高,使得放化疗同时应用所引起的不良反应能更好地控制,从而进一步提高局部晚期肺癌患者的生活质量和生存率。
为了进一步探讨化疗在放化疗综合治疗方案中对RP的影响,现对不同化疗周期与模式对RP发生率的影响进行了研究,其结果表明总化疗周期和诱导化疗周期对RP影响最为显著,且与RP的严重程度呈正相关。这样的结果不得不让我们重新审视化疗药物对肺组织的潜在毒性作用。在化疗联合放疗是否增加RP发生率方面,既往文献报道结果基本一致认为放化疗联合较单纯放疗明显增加RP发射率。Kim等[12]、Zhang等[13]报道,联合化疗者≥2级RP明显升高;Palma等[14]报道 > 65岁使用卡铂+紫杉醇化疗者≥2级RP危险度 > 50%;Dang等[15]报道化疗是预测NSCLC放疗后是否发生≥3级RP的独立危险因素;Parashar等[16]报道,放化疗和单纯放疗相比RP发生率增加5倍。但对于化疗周期数与RP发生的关系,鲜为报道。本研究中,化疗周期数与RP的发生率及严重程度呈现出一定的相关性,表明化疗药物对肺组织的潜在毒性不容忽视。既往已对化疗药物对肺损伤的分子机制进行了深入研究,认为药物对肺的损伤是由于药物在代谢过程中对肺泡细胞的直接损伤和诱发免疫反应产生一系列生化物质所致,且与药物的剂量直接相关,同时受药物-药物、药物-饮食、药物-环境相互作用的影响[17]。此外,相关临床研究结果也显示肺癌常用的化疗药物,多西他赛、紫杉醇、吉西他滨、长春瑞滨均会导致肺泡上皮细胞的损伤[18-19]。这些药物导致肺损伤大多数情况是潜在的,经肺泡上皮修复机制修复或停留在某一阶段,在此基础上如果再经历射线损伤,二者相互作用,表现为临床上常见的RP。基于本研究数据和既往基础及临床研究结果,无不提示化疗是增加放射性肺炎发生的一个独立因素,且与化疗剂量、方案和周期有关。因此建议将“irradiation induced lung injure”改为“treatment induced lung injure”可能更为准确。
总之,粉尘接触史是肺癌治疗中增加RP发生的一个独立因素,而不同治疗模式对RP的发生有一定影响,RP发生与患者化疗周期数密切相关,不论是总化疗周期或诱导化疗周期。笔者建议,对于局部晚期需行放化疗综合治疗的肺癌患者,规范、精准诊治,选择恰当的放疗介入时机,减少不必要的化疗才是降低肺癌患者RP发生的关键因素。
| [1] | Uchida Y, Tsugawa T, Tanaka-Mizuno S, et al. Exclusion of emphysematous lung from dose-volume estimates of risk improves prediction of radiation pneumonitis[J]. Radiat Oncol, 2017, 12(1): 160. DOI:10.1186/s13014-017-0891-z |
| [2] | Jones CM, Brunelli A, Callister ME, et al. Multimodality Treatment of Advanced Non-small Cell Lung Cancer: Where are we with the Evidence?[J]. Curr Surg Rep, 2018, 6(2): 5. DOI:10.1007/s40137-018-0202-0 |
| [3] | Mao J, Kocak Z, Zhou S, et al. The impact of induction chemotherapy and the associated tumor response onsubsequent radiation-related changes in lung function and tumor response[J]. Int J Radiat Oncol Biol Phys, 2007, 67(5): 1360–9. DOI:10.1016/j.ijrobp.2006.11.003 |
| [4] | Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer(EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341. DOI:10.1016/0360-3016(95)00060-C |
| [5] | 段晨阳, 刘梦颖, 吴剑, 等. 肺癌放射性肺炎危险因素的Meta分析[J]. 循证医学, 2013, 13(2): 106–15. [ Duan CY, Liu MY, Wu J, et al. Risk Factors on Radiation Pneumonitis: A Meta-Analysis[J]. Xun Zheng Yi Xue, 2013, 13(2): 106–15. ] |
| [6] | 张延可, 李宝生, 杨曼茹. 非小细胞肺癌精确放疗致急性放射性肺炎的相关因素研究进展[J]. 中华放射医学与防护杂志, 2011, 31(1): 109–11. [ Zhang YK, Li BS, Yang MR. The study progress on the related factors of acute radiation pneumonia caused by precise radiotherapy of non-small cell lung cancer[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2011, 31(1): 109–11. ] |
| [7] | Jin H, Jeon S, Kang GY, et al. Identification of radiation response genes and proteins from mouse pulmonary tissues after high-dose per fraction irradiation of limited lung volumes[J]. Int J Radiat Biol, 2017, 93(2): 184–93. DOI:10.1080/09553002.2017.1235297 |
| [8] | 李宝平, 周云芝, 杨德昌, 等. 尘肺肺癌的流行病学[J]. 职业与健康, 2007, 23(8): 644–7. [ Li BP, Zhou YZ, Yang DC, et al. Epidemiology of pneumoconiosis and lung cancer[J]. Zhi Ye Yu Jian Kang, 2007, 23(8): 644–7. ] |
| [9] | 周军, 石江涛, 杨勇. 82例尘肺并发肺癌患者的临床探讨[J]. 四川解剖学杂志, 2016, 24(1): 29–30. [ Zhou J, Shi JT, Yang Y. Clinical Study of 82 Cases of Pneumoconiosis Complicated with Lung Cancer Patients[J]. Sichuan Jie Pou Xue Za Zhi, 2016, 24(1): 29–30. ] |
| [10] | 李珠明, 崔玉琴. 三维适形放射治疗尘肺并发肺癌的疗效观察[J]. 中国职业医学, 2005, 232(5): 48–9. [ Li ZM, Cui YQ. Curative effect observation of three-dimensional conformal radiotherapy for lung cancer complicated with pneumoconiosis[J]. Zhongguo Zhi Ye Yi Xue, 2005, 232(5): 48–9. ] |
| [11] | Tekatli H, Duijm M, Oomen-de Hoop E, et al. Normal Tissue Complication Probability Modeling of Pulmonary Toxicity After Stereotactic and Hypofractionated Radiation Therapy for Central Lung Tumors[J]. Int J Radiat Oncol Biol Phys, 2018, 100(3): 738–47. DOI:10.1016/j.ijrobp.2017.11.022 |
| [12] | Kim M, Lee J, Ha B, et al. Factors predicting radiation pneumonitis in locally advanced non-small cell lung cancer[J]. Radiat Oncol J, 2011, 29(3): 181–90. DOI:10.3857/roj.2011.29.3.181 |
| [13] | Zhang XJ, Sun JG, Sun J, et al. Prediction of radiation pneumonitis in lung cancer patients: a systematic review[J]. J Cancer Res Clin Oncol, 2012, 138(12): 2103–16. DOI:10.1007/s00432-012-1284-1 |
| [14] | Palma DA, Senan S, Tsujino K, et al. Predicting radiation pneumonitis after chemoradiationtherapy for lung cancer: an international individual patient data Meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2013, 85(2): 444–50. DOI:10.1016/j.ijrobp.2012.04.043 |
| [15] | Dang J, Li G, Ma L, et al. Predictors of grade≥2 and grade≥3 radiation pneumonitisin patients with locally advanced non-small cell lung cancer treated with three-dimensional conformalradiotherapy[J]. Acta Oncol, 2013, 52(6): 1175–80. DOI:10.3109/0284186X.2012.747696 |
| [16] | Parashar B, Edwards A, Mehta R, et al. Chemotherapy significantly increases the risk of radiation pneumonitis in radiation therapy of advanced lung cancer[J]. Am J Clin Oncol, 2011, 34(2): 160–4. |
| [17] | Higenbottam T, Kuwano K, Nemery B, et al. Understanding the mechanisms of drug-associated interstitial lung disease[J]. Br J Cancer, 2004, 91(Suppl 2): S31–7. |
| [18] | Wang CJ, Chang HT, Chang CY. Docetaxel-related interstitial pneumonitis[J]. Ther Clin Risk Manag, 2015, 11: 1813–6. |
| [19] | Lerouge D, Rivière A, Dansin E, et al. A phase Ⅱ study of cisplatin with intravenous and oral vinorelbine as induction chemotherapy followed by concomitant chemoradiotherapy with oral vinorelbine and cisplatin for locally advanced non-small cell lung cancer[J]. BMC Cancer, 2014, 14: 231. DOI:10.1186/1471-2407-14-231 |
 2018, Vol. 45
2018, Vol. 45